抗菌肽JH-3 对耐甲氧西林金黄色葡萄球菌的抑菌和抗炎作用研究
2020-08-31赵娅娅刘欣欣赵雪芹刘双双朱春玲夏小静张慧辉徐彦召杭柏林孙亚伟陈仕钧胡建和
赵娅娅,刘欣欣,赵雪芹,刘双双,朱春玲,王 恒,夏小静,张慧辉,王 青,徐彦召,杭柏林,孙亚伟,陈仕钧,胡建和,王 磊
(河南科技学院 动物科技学院,河南 新乡 453003)
金黄色葡萄球菌(Staphyloccocus aureus)是人畜共患的重要病原菌之一,可以引起皮肤溃疡、伤口感染、心内膜炎、骨髓炎、肺炎和中毒性休克综合症等各种感染性疾病[1]。自1961 年首次发现耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)以来[2],MRSA 分离率逐年增加,已成为医院感染重要的革兰阳性细菌,多重耐药现象日益严重[3-4]。周顺等对分离自鸡、猪、家兔及小鼠的75 株金黄色葡萄球菌进行检测,检出MRSA 株占57.3%[5],2017 年1 月~2018 年12 月某医院接收的453 例金黄色葡萄球菌阳性住院患者中检测出95 例多重耐药菌,其中有62 例耐甲氧西林金黄色葡萄球菌[6]。万古霉素是治疗MRSA 感染最有效的药物,但是有些MRSA 菌株已经表现出了对万古霉素的抗性(Vancomycin-resistant Staphylococcus aureus, VRSA),这引起了医学界的广泛关注[7-8]。因此,开发不易产生耐药性、活性高、安全可靠的新型抗菌类药物十分必要。
抗菌肽(Antimicrobial Peptides,AMPs)是机体先天性免疫系统的重要组成部分,构成机体的第一道防线,具有抗菌、抗病毒、抗肿瘤和免疫调节等活性[9]。与抗生素相比,抗菌肽的抗菌机制独特、不易诱发耐药性、安全性较高,因此,抗菌肽是抗生素的理想替代品之一[10]。本实验室前期研究发现牛红细胞源抗菌肽P3 细胞毒性较小,杀菌活性强,具有很好的临床开发前景[11],通过对其氨基酸序列进行改造获得JH-3,其氨基酸序列更短(20aa),杀菌和抑菌活性更强[12-13],其类似物JH-1 能够显著抑制猪胸膜肺炎放线杆菌生物被膜的形成[14]。本研究以MRSA(ATCC 25923)为研究对象,体外评价了JH-3对MRSA 的抑菌和抗炎作用,并且发现JH-3 对多种MRSA(W3275、R89、R5886、YB57、B6994、R196、R238、R6040)均具有迅速有效的杀菌作用,本研究可为后期新型抗MRSA 菌药物的研发奠定理论基础。
1 材料与方法
1.1 主要实验材料抗菌肽JH-3(RRFKLLSHSLLVTLASHL,分子量2091.51 ku,脂溶性指数151.67,电荷数12),由上海吉尔生化有限公司合成,经反相高效液相色谱纯化和质谱鉴定纯度>98%。MRSA ATCC25923 购 自American type culture collection, 其 它MRSA(W3275、R89、R5886、YB57、B6994、R196、R238、R6040)为本实验分离保存菌株,采用LB 培养基培养。
BCA 蛋白试剂盒为碧云天科技公司产品;LDH 细胞毒性试剂购自Roche公司;PBS、TaKaRa gDNA荧光定量用反转录试剂盒(货号:DRR047A)、75%酒精、胎牛血清FBS、0.25%不含EDTA 胰蛋白酶均购自新乡智宝生物科技有限公司。
A549 细胞购自美国标准生物品收藏中心(ATCC)。
1.2 抗菌肽JH-3 对金黄色葡萄球菌ATCC25923抑菌效果的检测取过夜培养的金黄色葡萄球菌100 μL(1×108cfu)与高压灭菌后的100 mL LB 琼脂培养基(50 ℃左右)混匀,制备凝固培养基,之后在凝固培养基上打孔,加入100 μg/mL 的JH-3(10 μL/孔)。以ddH2O、DMSO 为阴性对照,以庆大霉素(Gentamicin,100 μg/mL,10 μL/孔)、氨苄青霉素(Ampicillin,100 μg/mL,10 μL/孔)为阳性对照。37 ℃培养12 h~16 h,采用琼脂扩散法检测JH-3 对ATCC25923的抑菌活性。同时,在96 孔聚丙乙烯微孔板中加入JH-3 并以LB 液体培养基稀释,使其浓度分别为100 μg/mL、50 μg/mL、25 μg/mL、12.5 μg/mL、6.3 μg/mL、3.1 μg/mL,总体积为50 μL,以ddH2O为阴性对照,每孔接种1×106cfu/mL 的金黄色葡萄球菌ATCC25923 50 μL,37 ℃培养12 h~16 h,观察抑菌效果,参照文献[15]进行最小抑菌浓度测定(Minimum inhibitory concentration ,MIC)。
1.3 抗菌肽JH-3 对金黄色葡萄球菌ATCC25923体外抑菌作用的检测将金黄色葡萄球菌培养至对数生长期(OD600nm约1.0),分别加入JH-3至终浓度为1 MIC和4 MIC,ddH2O 为阴性对照,37 ℃180 r/min 继续培养,观察菌液的生长情况,1 h 之内每隔10 min 吸取100 μL 菌液,测定其OD600nm值,参照文献[16]绘制JH-3 对ATCC25923 的抑菌曲线。同时,采用BCA 蛋白浓度测定试剂盒每隔1 h 测定细菌上清液中总蛋白含量,分析JH-3 对细菌破坏作用。
另外,为检测不同pH 条件下的JH-3 抑菌效果,配制pH 值分别为3、4、5、6、8、9、10 的LB固体培养基,高压灭菌后于42 ℃下分别加入ATCC25923菌悬液(终浓度为106cfu/mL)混匀,倒入无菌培养皿中待其冷却凝固后,进行打孔(直径3 mm),然后每孔加入相同体积的JH-3(终浓度为1 MIC)于不同pH 培养基中,无菌水孔作为阴性对照。37 ℃培养3 h后倒入覆盖琼脂,倒置,37 ℃培养24 h。观察抑菌圈大小,测量抑菌圈直径,根据公式绘制pH-抑菌直径。抑菌圈直径=处理抑菌圈直径-对照抑菌圈直径。
1.4 检测抗菌肽JH-3对金黄色葡萄球菌ATCC25923生物被膜的影响
1.4.1 生物被膜形成能力检测 在96 孔聚苯乙烯微孔板上,将过夜培养的金黄色葡萄球菌ATCC25923接入到LB 液体培养基中,每孔按照1%的比例接种,定容至100 μL;分别加入终浓度为1.0 MIC、0.5 MIC 、0.25 MIC 的JH-3,以ddH2O 为阴性对照,37 ℃培养12 h;吸出培养物上清,用200 μL 无菌PBS 清洗微孔板3 次,用70%甲醇固定30 min,吸出固定液,37 ℃干燥30 min;用1%的Hucker 结晶紫染色液室温染色5 min,吸出染色液,用水冲洗至无颜色残留,37 ℃干燥后拍照记录实验结果,然后每孔加入100 μL 的70%乙醇溶液溶解,使用酶标仪测定OD570nm的吸光值[17]。
1.4.2 扫描电子显微镜观察细菌生物膜 在6 孔细胞培养板上放置无菌盖玻片并使其与底面充分贴合,按1∶100体积比加入培养过夜的菌液与新鲜培养液,加入终浓度为0.5 MIC 的JH-3,37 ℃培养24 h,用无菌NaCl 溶液2 mL冲洗盖玻片3次,利用2.5%戊二醛溶液室温固定30 min,以pH 7.2 的磷酸缓冲液冲洗3 次,每次10 min,再分别以30%、50%、70%、80%、90%、95%、100%的乙醇梯度脱水,CO2临界点干燥,离子喷金镀膜,通过扫描电镜(SEM)进行细菌生物被膜观察。
1.5 抗菌肽JH-3 对金黄色葡萄球菌ATCC25923 介导的A549 细胞LDH 和细胞因子影响的检测
1.5.1 乳酸脱氢酶(LDH)细胞毒性试验 将A549细胞(1×105个/mL)接种于96孔板,孵育12 h,然后再加入不同浓度的JH-3(10 μmol/L、20 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L),使JH-3 最终浓度分别为1 MIC、2 MIC、4 MIC、8 MIC、16 MIC,分别于37 ℃,5%CO2条件下继续培养6 h 后利用细胞毒性检测试剂盒检测LDH 的释放,评价JH-3 单独作用对A549 细胞的影响;同时,将A549 细胞(1×105个/mL)接种于96 孔板,孵育12 h 后,采用ATCC25923(MOI 10 或MOI 100)感染1 h 后加入终浓度为2 MIC的JH-3,继续培养6 h 后利用细胞毒性检测试剂盒检测JH-3 对ATCC25923 介导的LDH 释放的影响。其中PBS 作为阴性对照,用1%Triton X-100 裂解后细胞液作为100%细胞毒性阳性对照,测定OD490nm值。
1.5.2 RT-PCR 检测细胞因子mRNA 的转录 将A549 细胞(1×106个/mL)接种于6 孔板,孵育12 h 后感染ATCC25923(MOI 10),37 ℃,5%CO2条件下继续培养1 h 后,分别加入终浓度为1 MIC、2 MIC、4 MIC 的JH-3,采用TaKaRa gDNA 荧光定量用反转录试剂盒提取处理组和对照组A549 细胞总RNA 并进行反转录,利用荧光定量RT-PCR方法检测IL-1β、IL-2、IL-6等细胞因子转录情况(引物见表1),荧光定量RT-PCR 扩增条件为:95 ℃5 min;95 ℃30 s、55 ℃30 s、72 ℃20 s,共40 个循环,循环结束后从60 ℃,每10 s 升高0.5 ℃,至95 ℃停止。

表1 引物表Table 1 primers
1.6 抗菌肽JH-3 对MRSA 广谱性的检测为测定JH-3 的抑菌广谱性,分别将W3275、R89、R5886、YB57、B6994、R196、R238、R6040 菌 株 接 种LB 液体培养基,每株接种两管,37 ℃过夜培养,使细菌生长至浓度约为1×108cfu/mL,一管加入终浓度为1 MIC 的JH-3,另一管加入同体积ddH2O 为阴性对照,37 ℃培养20 min,取少量菌液10 倍倍比稀释涂板计数。
1.7 统计学分析使用GraphPad Prism 5 数据处理软件对实验结果进行数据统计及差异性分析(One-Way ANOVA 或Two-Way ANOVA),p≤0.05 为差异显著(文中标注*:p<0.05;**:p<0.01;***:p<0.001)。
2 结 果
2.1 抗菌肽JH-3 对金黄色葡萄球菌ATCC25923抑菌效果的检测结果通过琼脂扩散法测定JH-3 对金黄色葡萄球菌ATCC25923 的抑菌活性,结果显示100 μg/mL JH-3 的孔抑菌环直径为8.1±0.2 mm,抑制作用强于100 μg/mL 的庆大霉素(抑菌环直径为7.0±0.1 mm),弱于100 μg/mL 的氨苄青霉素(抑菌环直径为12.2±0.3 mm)。而阴性对照组的DMSO 与ddH2O不能抑制金黄色葡萄球菌的生长。MIC 测定结果显示,JH-3 对金黄色葡萄球菌的最小抑菌浓度为25 μg/mL。表明抗菌肽JH-3 对ATCC25923 具有较好的抑菌作用。
2.2 抗菌肽JH-3 对金黄色葡萄球菌ATCC25923体外抑菌作用的检测结果对JH-3 作用6 h 内MRSA ATCC25923 菌液中活菌数量和菌液OD600nm进行测定,结果显示,1 MIC JH-3 即可在360 min 内消除细菌,可对MRSA ATCC25923 起到明显抑制和杀菌 作 用(图1A,p<0.01;图1B,p<0.001);4 MIC JH-3 可在30 min 内快速杀灭细菌,使细菌浓度降低至104cfu/mL,120 min 内清除活菌,杀菌效果更为显著(图1B,p<0.001)。
细菌总蛋白的释放检测结果显示,1 MIC 和4 MIC 的JH-3 作用ATCC25923 5 h 和2 h 后,细菌培养液上清中总蛋白量显著增加(OD595nm1.75±0.02、1.37±0.01 vs 0.65±0.03,图1C,p<0.05),表明JH-3能够显著破坏细菌细胞壁和细胞膜,导致细菌内容物的释放,从而介导菌体死亡。通过对不同pH 条件下的杀菌作用进行检测,结果显示,不同pH 值没有对JH-3 的杀菌作用产生影响,抑菌半径在均8 mm 左右(图1D,p>0.05),表明JH-3 在酸碱环境下的抑菌效果稳定性较好。

图1 JH-3 对MRSA ATCC25923 的体外杀菌结果Fig.1 In vitro killing curve of JH-3 for MRSA ATCC25923
2.3 抗菌肽JH-3 对金黄色葡萄球菌ATCC25923生物被膜影响的检测结果通过不同浓度JH-3 的添加,静态培养MRSA ATCC25923 24 h 后结晶紫染色,观察可见0.5 MIC、0.25 MIC 的JH-3 均对MRSA ATCC25923 的生物被膜形成能力有抑制作用,1MIC的JH-3 即可完全消除MRSA ATCC25923 的生物被膜(图2A)。70%乙醇溶解结晶紫后,OD570nm测定结果显示, 0.5 MIC 的JH-3 能够显著降低ATCC25923生物被形成(图2B,p<0.05),1 MIC的JH-3能够极显著降低ATCC25923 生 物 被 膜 形 成(图2B,p<0.01),表 明JH-3 对生物被膜形成的影响具有明显的剂量依赖性。扫描电子显微镜观察细菌发现未处理组细菌大量聚集成团,呈多层结构,生物被膜牢固;0.5 MIC JH-3 处理组粘附到盖玻片上的细菌数明显降低,呈单层结构,生物被膜形成降低(图2C)。综上,表明抗菌肽JH-3 能够降低ATCC25923 生物被膜形成。

图2 抗菌肽JH-3 对ATCC25923 生物被膜的影响Fig.2 Inhibition of biofilm formation in MRSA ATCC25923 by JH-3
2.4 抗菌肽JH-3 对金黄色葡萄球菌ATCC25923介导的A549 细胞LDH 和细胞因子转录的影响检测结果在A549 细胞上评价JH-3 对LDH 的释放,结果显示,不同浓度JH-3 对LDH 的释放均较小,LDH 释放率为15%,组间包括与阴性对照相比差异不显著(图3A,p>0.05),表明JH-3 对A549 细胞毒性较小,不影响正常细胞LDH 的释放;然而当A549 细胞加入ATCC25923 时,能够显著增加A549 LDH 的释放,LDH 的阳性率升至46±2%和73±2%(图3B,p<0.05),2 MIC JH-3(50 μg/mL)能够显著抑制不同浓度ATCC25923 诱导的LDH 释放(LDH阳性率46±2%vs 20±1%,73±2%vs 37±2%,图3B,p<0.05)。ATCC25923 感染A549 细胞能够显著增加炎性相关细胞因子IL-1β、IL-2、IL-6 的转录,JH-3 能够不同浓度抑制ATCC25923 诱导的炎性因子转录,且呈剂量依赖性:2 MIC JH-3 能够显著降低IL-1β 和IL-6 的 转 录(IL-1β:2.1±0.1 vs 7.8±0.2;IL-6:2.0±0.4 vs 7.2±0.2;图3C 和3E,p<0.05),1MIC JH-3 能够显著降低IL-2 的转录(IL-2:7.5±0.2 vs 14.6±0.1,图3D,p<0.05)。综上,表明抗菌肽JH-3 在200 μmol/L 内对A549 细胞无毒性作用,且可降低ATCC25923 介导的细胞LDH 释放和炎症相关因子(IL-1β、IL-2 和IL-6)的转录水平。
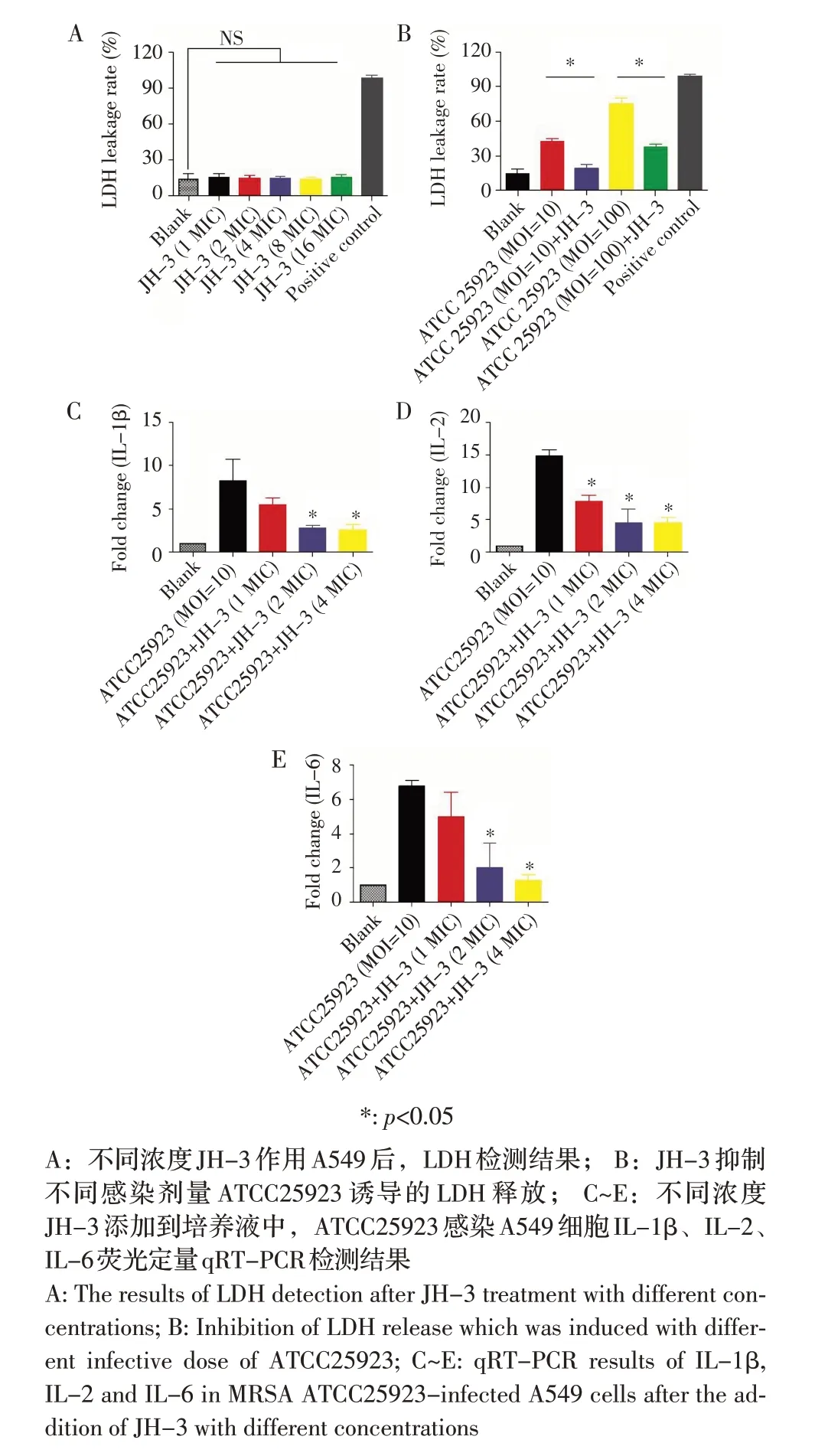
图3 JH-3 作用后,ATCC25923 诱导A549 细胞LDH 和细胞因子释放的检测结果Fig.3 Release of LDH and cytokine in A549 cells after JH-3 treatment
2.5 抗菌肽JH-3 对MRSA 广谱性的检测结果对不同MRSA 菌株进行JH-3 杀菌广谱性评价,结果显示JH-3 对W3275、R89、R5886、YB57、B6994、R196、R238、R6040 菌株20 min 内均可使活菌数极显著降低至103cfu/mL~107cfu/mL(图4,p<0.001)。表明JH-3 具有较强的抑菌和杀菌活性,且能对多种MRSA 具有良好的杀菌作用。

图4 JH-3 对多种MRSA 的杀菌作用测定结果Fig.4 Bactericidal activity of JH-3 against MRSA
3 讨 论
耐甲氧西林金黄色葡萄球菌(MRSA)是目前临床感染控制的重大挑战,在侵袭性感染中MRSA 患者的死亡率显著高于MSSA 患者[18]。糖肽类仍是目前MRSA 感染治疗的主流药物之一[19],在治疗MRSA 感染中万古霉素常作为系统性MRSA 感染的经验性和目标治疗药物[20],但是万古霉素治疗失败的病例已经不断出现[21-22]。因此,寻找一种能够替代现有抗生素的抗菌药物十分必要。赖崇发等研究发现ZTW-41 对革兰氏阳性菌具有较强的抗菌作用,其中包括对MRSA,抗菌活性比万古霉素强2~64 倍[23]。邱敏等研究发现丁香油对MRSA 具有一定的抗菌活性,同β-内酰胺类抗生素联用能协同增加β-内酰胺类抗生素抗MRSA 活性[24]。本研究首次发现JH-3 对多种MRSA 均具有较强杀菌作用,1 MIC的JH-3 可在20 min 内使耐甲氧西林金黄色葡萄球菌ATCC25923 活 菌 数 降 低1 000 倍,360 min 内 消 除 细菌,4 MIC 杀菌效果更为显著。此外,本研究发现JH-3 能够降低MRSA 感染造成的细胞炎症和LDH 的释放,对MRSA 的生物被膜形成也能起到良好的抑制作用,本实验可为新型抗MRSA 药物的开发提供参考。
目前,针对抗菌肽的杀菌机制尚未定论,但多数学者一致认为抗菌肽的杀菌机制主要是在细菌表面打孔,形成孔道,致使细胞膜结构破坏,造成胞内水溶性物质大量渗出,而最终导致细菌死亡[25]。Cathelicidin PMAP-36 衍生物G124 能够破坏E.coli 细胞膜,增强其通透性,内容物外泄,从而导致菌体死亡[26]。抗菌肽HJH-3 能够使细菌细胞膜迅速去极化,破坏膜的完整性,导致细菌变形、破裂、黏连,从而起到杀菌作用[27]。HBV 核心蛋白(HBc)富含精氨酸结构域(ARD),能够结合到铜绿假单胞菌和大肠杆菌表面,结合位点为细菌脂多糖,改变细菌膜通透性,进而起到杀菌作用[28]。抗菌肽papiliocin C 端疏水性芳香族氨基酸残基能够起到快速破坏大肠杆菌内膜和外膜通透性的作用,为抗菌肽选择性抗菌机制的研究提供参考[29]。本研究发现抗菌肽JH-3 能够在1 h 内快速破坏金黄色葡萄球菌ATCC25923 膜结构,导致内容物(菌体蛋白)外泄,从而起到杀菌的作用。
抗菌肽抗炎功能成为近年来研究热点。HanR等发现添加不同浓度抗菌肽CEN1HC-Br,能够显著降低痤疮丙酸杆菌刺激HaCaT 细胞和人单核细胞IL-6、IL-1β、TNF-α和TLR2 的高表达,减轻大鼠耳肿胀,并降低促炎性细胞因子IL-8 的高表达,且抗菌肽CEN1HC-Br 的抗炎效果优于克林霉素,该结果与本研究中JH-3 能够显著降低金葡菌感染后IL-6的转录相一致[30]。KR-12-a5 是12-聚体α-螺旋抗菌肽,其功能与LL-37 类似,研究发现KR-12-a5 及其类似物能够显著抑制LPS 刺激RAW264.7 后TNF-α、NO、IL-6 和MCP-1 分泌,从而降低细胞炎症反应[31]。Fusco A 等发现抗菌肽hBD-2 和hBD-3 能够降低沙门氏菌感染Caco-2 细胞后TNF-α、IL-6、IL-8和IL-1β 的表达,增加抗炎细胞因子TGF-β 的表达,表明抗菌肽能够显著降低鼠伤寒沙门氏菌感染Caco-2 细胞引起的炎症反应,从而调控免疫应答,该结果与本研究中JH-3 能够显著降低金葡菌感染后IL-6 和IL-1β的转录相一致[32]。血管活性肠肽VIP类似物rVIPa 能够显著降低TNBS 诱导的兔结肠中TNF-α 表达水平,并显著增加结肠中抑炎因子IL-10 含量,从而缓解兔结肠炎症反应[33]。本实验室前期研究发现抗菌肽JH-3 通过抑制p38 MAPK 信号通路活化降低炎性细胞因子IL-2、IL-6 和TNF-α分泌,通过抑制caspase-8 和caspase-9 活化,进而抑制caspase-3 活化,从而起到降低RAW264.7 细胞凋亡的作用[34]。A549 细胞是研究金黄色葡萄球菌与宿主细胞相互作用的模式细胞[35],因此,选择在A549细胞上进行抗菌肽JH-3 对耐甲氧西林金黄色葡萄球菌的抑菌和抗炎作用研究,发现JH-3 能够抑制ATCC25923 诱导的炎性因子释放,且呈剂量依赖性,表明抗菌肽JH-3 具有良好的抗炎效果,在抗炎作用方面具有良好的应用前景。
本研究系统评价了抗菌肽JH-3 对耐甲氧西林金黄色葡萄球菌的的杀菌作用,初步阐明了JH-3的杀菌机制,主要通过改变ATCC25923 细胞通透性,导致细菌内容物释放,从而介导菌体死亡,并能够显著抑制本菌生物背膜的产生,进一步发现JH-3 能够降低MRSA 感染造成的细胞炎症和LDH 的释放。本研究还发现抗菌肽JH-3 对多种MRSA 均具有较强杀菌作用,可为新型抗MRSA 药物的研发提供参考。
