APS治疗CVA模型小鼠的效果评价
2020-08-31王福玲许慧琳
鲁 蓉,王 昊,王福玲,许慧琳,杨 波
(哈尔滨商业大学 药学院,哈尔滨 150076)
咳嗽变异性哮喘(cough variant asthma,CVA)常因上呼吸道感染、寒冷天气、尘螨和油烟引起或加重,这种咳嗽经常持续或复发一个月以上,属于一种慢性气道炎症性疾病,涉及到了多种炎症细胞的参与,而过敏性炎症是CVA的基本发病机制[1].目前,激素是CVA的主要治疗手段,但其长期使用不良反应较多,所以对于CVA的治疗可以考虑中医的疗法,并且多年来中医在CVA的治疗方面也积累了大量经验,如黄芪作为一种免疫调节剂,在哮喘的防治中发挥着重要作用.黄芪多糖(astragalus polysaccharide,APS)是黄芪的提取物,研究表明APS在CVA动物模型实验中表现出良好的抗炎作用,并且既往研究发现APS可抑制CVA小鼠气道炎症,调节Th17/Treg细胞因子表达[2].
1 实验试剂仪器及材料
氢氧化铝(上海凌峰化学试剂有限公司);0.9%氯化钠注射液(哈尔滨三联药业股份有限公司);卵清蛋白OVA(上海沪宇生物科技有限公司);丙酮(广州化学试剂二厂);伊红(广州化学试剂二厂);602C压缩空气式雾化器(丹阳市恒宁医疗器械有限公司);ZZ-6小鼠自主活动测试仪(成都泰盟科技有限公司);TGL-10K台式离心机(上海医疗仪器厂);DMM-100C光学显微镜(上海蔡康光学仪器有限公司);ICR小鼠(长春市亿斯实验动物技术有限责任公司);孟鲁司特钠(上海科顺生物有限公司);小鼠(Mouse)肿瘤坏死因子ELISA检测试剂盒(杭州诚维生物科技有限公司);小鼠(Mouse)白细胞介素2(IL-2)ELISA检测试剂盒(杭州诚维生物科技有限公司).
2 实验方法
2.1 动物模型建立及给药
选取18只小鼠(雌雄小鼠各半),随机抽取6只作为空白对照组[3],其余各组予小鼠腹腔注射新配制的OVA致敏液0.2 mL致敏,1次/d,连续15 d;第15~20天将小鼠置于透明雾化吸入箱中,雾化吸入1%OVA溶液激发,第21天雾化吸入2%OVA溶液激发,小鼠自然吸入,30 min/次,1次/d.将造模成功的小鼠随机分为CVA模型组和黄芪多糖组,黄芪多糖组动物灌胃给药200 mg/(kg·d),空白对照组和CVA模型组小鼠采用等量的生理盐水灌胃给药,连续一周.
2.1.1 OVA致敏液配制
先量筒量取生理盐水5 mL,加入氢氧化铝200 mg充分混悬,制成4%的氢氧化铝凝胶液;再取2.5 mL的生理盐水,加入1.5 mg OVA充分溶解,最后取氢氧化铝凝胶液2.5 mL与之充分混悬作为致敏液,即时使用[4].
2.1.2 1%OVA雾化液配制
首先用电子天平称取1 mg OVA,在与100 mL生理盐水混合后,用恒温磁力搅拌器充分搅拌使之溶解,制成1%OVA雾化液.即时使用[5].
2.1.3 2%OVA雾化液配制
首先用电子天平称取2 mg OVA,方法同上.即时使用[5].
2.2 观测CVA模型小鼠整体指标
实验第21天,观察10 min内小鼠抓鼻次数以及哮喘发作症状.实验第20~21天测定小鼠24 h 内的进食量与饮水量;实验第21天下午6点测定小鼠自主活动,开启小鼠自主活动仪,将小鼠放入并适应3 min后,测定5 min的活动次数与抬头(站立)次数[6].
2.3 测定CVA模型小鼠离体指标
2.3.1 外周血的收集
在实验的第22天,处死小鼠后眼球取血.静置,离心,取上清于-20 ℃条件下保存备用[7].
2.3.2 CVA模型小鼠肺湿干重
小鼠经眼球取血后仰卧,将其四肢及头固定,暴露其胸腔,结扎右肺,取右肺下叶,称小鼠肺湿重,然后再置于56 ℃烤箱中烘烤72 h后称其肺干重,最后计算其肺湿干重比值[6].
2.3.3 外周血中白细胞计数及分类
1)用100 μL冷的 PBS稀释外周血细胞沉淀物,取30 μL用血细胞计数器计数其细胞总数.
2)取 50 μL细胞沉渣涂片,干燥固定,经 Wright′s(瑞氏)染色后,显微镜下计数200个白细胞(Leu),然后按形态学特征[8]将细胞依次分为嗜酸性粒细胞(Eos)、中性粒细胞(Neu)、淋巴细胞(Lym)及单核细胞(Mon).
2.3.4 ELISA 法检测小鼠血清中TNF-α和IL-2的质量浓度
按试剂盒说明书[9]测定小鼠血清中TNF-α和IL-2的质量浓度.
3 实验结果
3.1 各组小鼠进食量及饮水量的比较
如表1所示,模型组与空白组比较,模型组小鼠的进食量及饮水量均减少了.与模型组相比,黄芪多糖组小鼠进食量有所减少,而饮水量增加了,但无显著性差异(P>0.05).
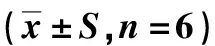
表1 黄芪多糖对哮喘小鼠进食量及饮水量的影响
3.2 各组鼠自主活动及哮喘行为学的比较
如表2所示,模型组与空白组相比小鼠的活动次数及抓鼻次数均有明显的增加,存在极显著性差异(P<0.01).与模型组相比黄芪多糖组小鼠的活动次数及抓鼻次数均减少,但无显著性差异(P>0.05).
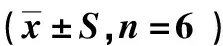
表2 黄芪多糖对哮喘小鼠自主活动及哮喘行为学的影响
3.3 各组小鼠肺湿干重的比较
如表3所示,模型组与空白组相比小鼠肺湿重、肺干重均有明显增加,存在极显著性差异(P<0.01),且模型组小鼠肺湿干重比值有明显升高,存在显著性差异(P<0.05).与模型组比较,黄芪多糖组小鼠肺湿重、肺干重及肺湿干重比值均降低,但无显著性差异(P>0.05).
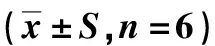
表3 黄芪多糖对哮喘小鼠肺湿干重的影响
3.4 各组小鼠血液中白细胞的比较
如表4所示,模型组与空白组相比小鼠白细胞总数、中性粒细胞及嗜酸性粒细胞均有明显增加,存在极显著性差异(P<0.01).与模型组比较,黄芪多糖组小鼠白细胞总数、中性粒细胞均减少,且嗜酸性粒细胞减少明显,存在显著性差异(P<0.05).
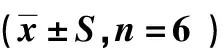
表4 黄芪多糖对哮喘小鼠白细胞的影响
3.5 各组小鼠血液中单核细胞及淋巴细胞的比较
如表5所示,与空白组相比模型组小鼠单核细胞及淋巴细胞均有明显增加,存在极显著性差异(P<0.01).与模型组比较,黄芪多糖组小鼠单核细胞减少明显,存在显著性差异(P<0.05),且黄芪多糖组小鼠淋巴细胞也减少,但无显著性差异(P>0.05).
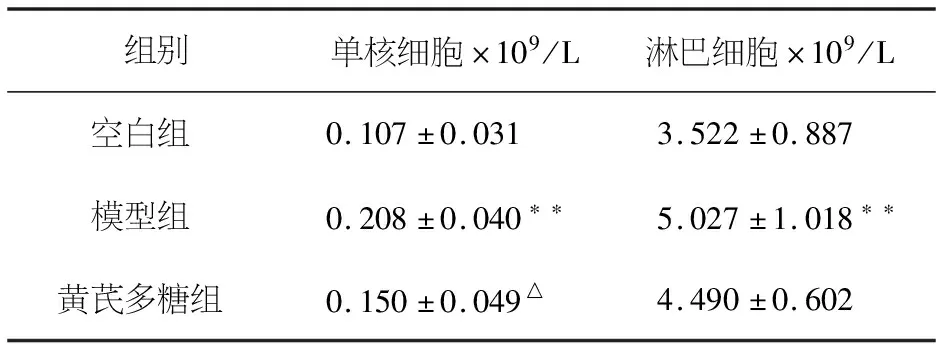
表5 黄芪多糖对哮喘小鼠单核细胞及淋巴细胞的影响(x±S,n=6)
3.6 各组小鼠血清中IL-2、TNF-α质量浓度的比较
如表6所示,模型组与空白组比较,小鼠血清中IL-2质量浓度有明显降低,存在显著性差异(P<0.05),而TNF-α质量浓度升高.与模型组小鼠比较,黄芪多糖组小鼠血清中IL-2质量浓度有明显升高,存在极显著性差异(P<0.01),而血清中TNF-α质量浓度降低,但无显著性差异(P>0.05).

表6 黄芪多糖对小鼠血清中IL-2、TNF-α质量浓度的影响(x±S,n=6)
4 讨 论
本文通过建立小鼠模型的方式证实了黄芪多糖具有良好治疗小鼠CVA的作用.实验中模型组小鼠肺组织的病理变化与哮喘气道炎症的基本病理特征一致,说明OVA致敏和气雾剂吸入刺激法制备小鼠CVA模型是成功的[10].其中,给药组小鼠气道炎症和炎性细胞的浸润程度低于模型组, 且APS组的效果更明显,从此结果可以看出APS具有良好的抗炎作用;与模型组比较,APS组血清中TNF-α的表达降低,而IL-2的表达增高,此结果进一步证实APS具有良好的抗炎效果,其抗炎机制可能与血清中TNF-α及IL-2表达有关[11].
