在体常温局部灌注对猪心死亡供体肝脏的修复作用
2020-08-31李鹏谭晓宇雷志斌陈耀王春政何锡然邝伟键郭家钘陈素平欧阳青何洹陈建雄林炎志霍枫广东顺德工业设计研究院广东顺德创新设计研究院广东佛山583中国人民解放军南部战区总医院肝胆外科与肝移植中心广东广州5000
李鹏,谭晓宇,雷志斌,陈耀,王春政,何锡然,邝伟键,郭家钘,陈素平, 欧阳青,何洹,陈建雄,林炎志,霍枫〔. 广东顺德工业设计研究院(广东顺德创新设计研究院〕,广东 佛山 583;.中国人民解放军南部战区总医院肝胆外科与肝移植中心,广东 广州 5000)
目前供体器官缺乏,成为医疗界亟待解决的问题[1-2]。1955 年Hume 首次报道了使用心死亡器官捐献(donation after circulatory death, DCD)进行移植手术[3],其后DCD 器官使用数量逐年增多,但由于DCD 供体在移植前经历了长时间的热缺血,致使移植后缺血/再灌注损伤更为严重,导致原发性无功能(primary non-function,PNF)和移植物丢弃等严重术后并发症的风险升高[4-5]。根据英国DCD 指南,功能性热缺血时间(warm ischemia time, WIT)超过20 min,肝功能将受到明显影响,不建议使用WIT 超过30 min 的供肝[6]。
体外膜肺氧合 (extracorporeal membrane oxygenation, ECMO)代替了呼吸和心脏的功能,可以偿还DCD器官功能性热缺血阶段导致的“氧债”,减轻器官热缺血损伤,越来越多地运用于器官捐献领域[7],但ECMO 作为机械性的体外循环装置,血液中炎性因子释放、肝素等抗凝药物以及其他多因素均会制约ECMO 运行时间[8],Thomas 等[9]研究发现,在体常温局部灌注对肾脏供体最佳的灌注时间为 4 h,临床专家也建议:采用V-A 模式,对DCD供体腹腔器官原位氧合血灌注2 ~4 h,可对损伤的器官进行一定的“修复”作用[7]。但WIT 超过30 min 的边缘供肝是否可以通过原位氧合灌注对其进行修复,目前无相关研究报道。
因此,本研究利用自主研发的在体机械灌注设备(in situ machine perfusion device,IMPD)对 猪DCD 30 min 肝脏进行在体常温局部灌注4 h,来探索在体常温局部灌注对猪DCD 30 min 肝脏的修复作用。
1 资料与方法
1.1 设备:课题团队针对供体器官维护、修复和获取的具体需求,利用ECMO 原理研发出了国内首创专用于器官捐献领域的灌注设备,命名为便携式IMPD(图1)。

图1 在体机械灌注设备(IMPD)
1.2 实验动物与耗材
1.2.1 实验动物:检疫合格的巴马小型猪3 只, 雌性,月龄4 个月,体重40 ~45 kg。术前12 h 禁食,4 h 禁水。
1.2.2 耗材:氧合器(科威,中国)、离心泵泵头 (索林,意大利)、管路(科威,中国)。
1.2.3 管路预冲液配方:羟乙基淀粉400 ml +生理盐水400 ml +肝素0.1 ml +甘露醇200 ml,共配 置1 L。
1.2.4 实验中扩容用液:① 胶体液组:羟乙基淀粉500 ml;② 晶体液组:生理盐水500 ml。
1.3 手术通路:肌肉注射2 ml 阿托品,15 min后肌肉注射2 ml 舒泰和阿托品混合液诱导麻醉, 建立耳缘静脉通路和气管插管,连接呼吸机, 呼吸机参数设置SIMV 模式:潮气量=体重×7, 频率为20,呼气终末正压为5 cmH2O(1 cmH2O = 0.098 kPa),静脉连接微量注射泵,连续泵入丙泊酚维持麻醉〔丙泊酚∶生理盐水=1 ∶1,流速为1 ml /(kg·h)〕,对动物呼吸频率、心率、血氧 饱和度、心电图、体温和有创动脉压进行监测。 备皮,右侧颈静脉经皮放入6 F 血管鞘(美敦力,美国),建立扩容通路;右侧股动脉经皮放入11 F血管鞘(cordis,美国),连接压力传感器,监测动脉压;分离左侧颈外静脉,使用超声定位,将 23 F 静脉插管(科威,中国)放入到右心耳处,建立引流通路;分离左侧髂动脉,放入18 F 动脉插管(科威,中国),建立灌注通路;沿最后肋弓切开,行胆囊管插管,收集胆汁,缝合切口;注射肝素 1 ml(6 250 U),将动、静脉插管接入体外循环管路,连接微量注射泵,配制肝素生理盐水(1 ml 肝素加入60 ml 生理盐水),注射流速为20 ml/h,激活全血凝固时间(activated clotting time,ACT)维持在180 ~ 220 s,等IMPD 设备运行后再启动。
1.4 心停跳:耳缘静脉注射2 meq/kg 的氯化钾,诱发心脏停搏,维持5 min 后,确定心死亡,开始计算死亡时间,维持30 min,同时停止呼吸机。
1.5 局部灌注:20 mm 阻断球囊(科威,中国)通过右股动脉插管进入,由0.035 inch × 260 cm 导引导丝(cordis,美国)引导置入胸主动脉,超声定位,使用球囊压力扩张泵扩张球囊,阻断胸主动脉,DCD 30 min 后,局部灌注4 h,调节转速,维持静脉血氧饱和度(oxygen saturation of mixed venose blood,SVO2)为60%~70%。
1.6 取样:在灌注前和灌注后0、1、2、3、4 h 的时候取血样,检测血气、生化、ACT。在灌注前和灌注后4 h 取肝脏组织,浸泡于10%甲醛溶液中,送广州金域医学检验中心进行HE 染色并出具第三方病理检验报告,评分标准参照文献[10]。
1.7 统计分析:运用SPSS 23.0 统计学软件,采用单因素方差分析方法进行不同时间点间分析,计量资料采用均数±标准差(±s)表示,P <0.05为差异有统计学意义,P <0.01 为差异极显著。
2 结 果
2.1 设备监测指标(表1):IMPD 在局部灌注过程中,各时间点、流量和转速稳定,引流压大于 -50 mmHg,灌 注 压 小 于150 mmHg,SVO2维 持在60%~70%,各项设备指标均在临床推荐范围 之内[11]。
2.2 血气指标(表2):0 h pH 值显著低于基础值和其他时间点(P <0.05),除0 h 以外,各时间点pH 值与基础值相比差异不显著(P >0.05), 各时间点间差异不显著(P >0.05)。二氧化碳分压(partial pressure of carbon dioxide,pCO2)各时间点数值比0 h 低,与2 h 和4 h 相比具有统计学差异(P <0.05)。乳酸(lactic acid,Lac)各时间点浓度都显著高于基础值(P <0.05),0 h 和1 h的乳酸浓度显著高于2、3 h 及4 h(P <0.05)。
表2 血气指标(±s)
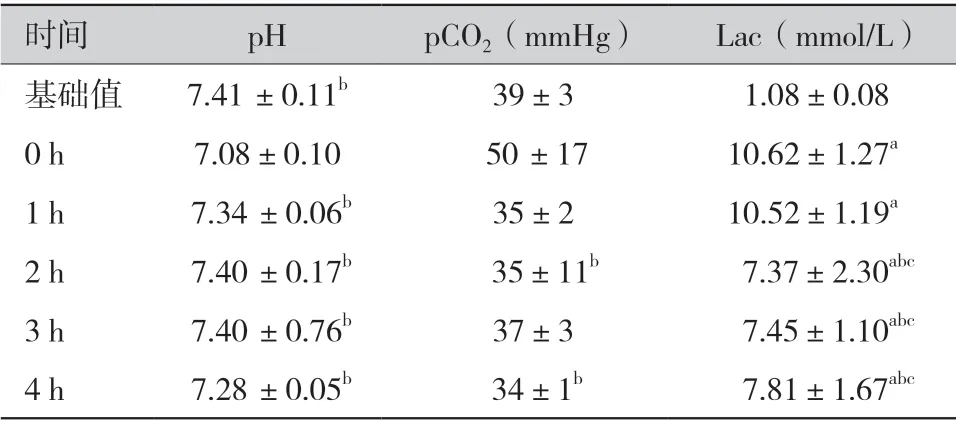
表2 血气指标(±s)
注:a 为与基础值相比,P <0.05;b 为与0 h 相比,P <0.05;c 为与1 h 相比,P <0.05
时间 pH pCO2(mmHg) Lac(mmol/L)基础值 7.41 ±0.11b 39±3 1.08±0.08 0 h 7.08±0.10 50 ±17 10.62±1.27a 1 h 7.34 ±0.06b 35±2 10.52±1.19a 2 h 7.40 ±0.17b 35±11b 7.37±2.30abc 3 h 7.40 ±0.76b 37±3 7.45±1.10abc 4 h 7.28 ±0.05b 34±1b 7.81±1.67abc
2.3 生化指标(表3):天冬氨酸转氨酶(aspartate aminotransferase,AST)浓度在第3 小时和第4 小时显著高于基础值和第0 小时(P <0.05),但都在正常生理值范围。各时间点Na+、丙氨酸转氨酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin,TBil)及谷氨酰转肽酶(glutamyl transpeptidase,GGT)浓度稳定,与生理值比较,无统计学差异(P >0.05)。在灌注阶段,胆汁生成量均高于10 ml/h,其中第2 小时的生成量显著高于其余时间点(P <0.05)。
表1 设备监测指标(±s)

表1 设备监测指标(±s)
时间 管路流量(L/min) 血泵转速(kr/min) 引流压(mmHg) 灌注压(mmHg) SVO2(%)0 h 2.08±0.25 1.98±0.38 -24±19 123±25 59±5 1 h 1.62±1.41 2.00±0.26 -39±23 115±19 63±2 2 h 2.45±0.20 2.21±0.41 -49±21 144±34 60±1 3 h 2.06±0.31 2.07±0.23 -42±28 134±31 63±2 4 h 2.05±0.28 2.00±0.28 -31±8 120±20 63±3
2.4 肝脏病理分析:图2 显示DCD 30 min 后,肝脏变为暗黑色,经过IMPD 灌注4 h 后,肝脏的颜色变为鲜红色。图3 显示DCD 30 min 肝脏灌注前肝脏瘀血和肝细胞空泡化严重,灌注后4 h,肝脏瘀血、坏死和肝细胞空泡化为无或者较少,灌注前和灌注后病理评分平均值分别为:(11.7±0.6)分和(4.7±2.5)分,具有统计学意义(P <0.01)。
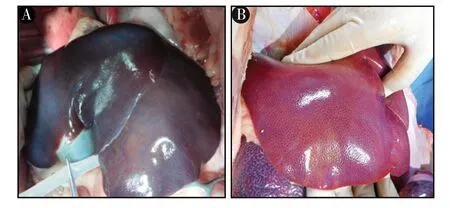
图2 DCD 30 min 肝脏灌注前和灌注4 h 后大体观察
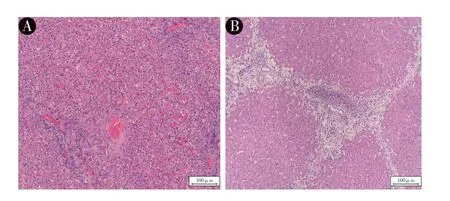
图3 DCD 30 min 肝脏灌注前和灌注后4 h HE 切片
3 讨 论
近年来,人类对供体器官的需求量与日俱增与捐献者供体器官的数量相对不足之间的矛盾日益突出,扩大标准供体成为解决这一问题的关键方法。临床上,WIT 超过30 min 肝脏将被遗弃[12],本研究通过利用自主研发的IMPD,探索在体常温局部灌注对猪DCD 30 min 肝脏的修复作用,为临床使用提供理论依据。
结果显示,在灌注期间,IMPD 运行稳定,静脉引流压全程高于-50 mmHg,灌注压全程低于150 mmHg,SVO2全程维持在60%~70%,符合临床推荐标准[11],以上结果表明,自主研发的IMPD 可对供体进行稳定的局部灌注。
由于DCD 供体获取前经历了低流量灌注、 缺血和缺氧的损伤,直接导致细胞供氧不足, 线粒体呼吸链功能发生改变,无氧酵解增多导致乳酸、酮体沉积,引起代谢性酸中毒[13-14]、细胞肿胀和坏死[15],ECMO 可通过恢复组织器官的血流灌注与供氧、纠正酸中毒,减轻脏器的热缺血损伤[8]。本研究结果显示,在DCD 30 min 后,灌注0 h 时,与基础值相比,pCO2与乳酸浓度显著升高(P <0.05),pH 值显著下降(P <0.05),出现 酸中毒症状。在IMPD 作用下,在灌注第1 小时, pH 和pCO2恢复到正常生理值,乳酸在第2 小时之后浓度显著低于第0 小时和第1 小时(P <0.05),表明机体内环境得到改善。肝脏颜色由DCD30 min 后的暗黑色变为灌注4 h 后的鲜红色。对组织学观察发现,DCD 30 min 肝脏灌注前,肝脏淤血和肝细胞空泡化严重,肝脏灌注4 h 后,肝脏瘀血、坏死和肝细胞空泡化变为无或者较少,灌注前、后病理评分平均值分别为(11.7±0.6)分和(4.7±2.5)分,统计学差异极显著(P <0.01),这表明,IMPD 在对DCD 30 min 在体常温局部灌注的4 h 内,肝细胞空泡化与肝窦内淤血得到明显 改善。
表3 生化指标(±s)
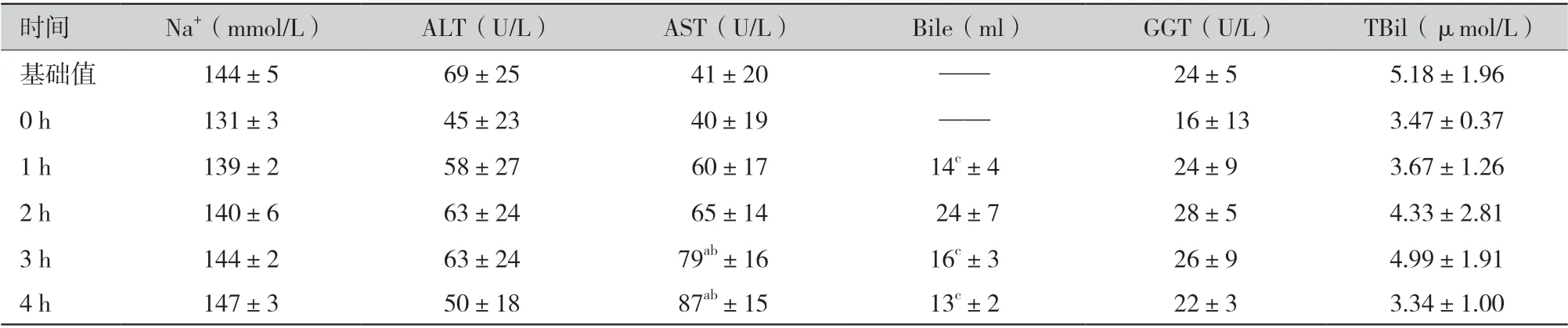
表3 生化指标(±s)
注:a 为与基础值相比,P <0.05;b 为与0 h 相比,P <0.05;c 为与2 h 相比,P <0.05;ALT 为丙氨酸转氨酶;AST 为天冬氨酸转氨酶;Bile 为胆汁生成量;GGT 为谷氨酰转肽酶;TBil 为总胆红素
时间 Na+(mmol/L) ALT(U/L) AST(U/L) Bile(ml) GGT(U/L) TBil(μmol/L)基础值 144±5 69±25 41±20 —— 24±5 5.18±1.96 0 h 131±3 45±23 40±19 —— 16±13 3.47±0.37 1 h 139±2 58±27 60±17 14c±4 24±9 3.67±1.26 2 h 140±6 63±24 65±14 24±7 28±5 4.33±2.81 3 h 144±2 63±24 79ab±16 16c±3 26±9 4.99±1.91 4 h 147±3 50±18 87ab±15 13c±2 22±3 3.34±1.00
在供体维护时,供体肝功能与血清钠离子水平是影响供肝移植效果的重要因素[16]。本研究发现,全程胆汁持续产生,每小时胆汁的生成量都高于10 ml,第2 小时为(24±7)ml,显著高于其他时间段(P <0.05)。肝功能指标中,ALT、TBil及GGT 稳定,各时间点与生理值比较,无统计学差异(P >0.05),AST 在灌注过程中呈上升趋势,第3 小时和第4 小时显著高于基础值与第0 小时(P <0.05),但均低于90 U/L,不属于边缘供肝范畴[17]。Na+先下降,后上升,各时间点与生理值比较,无统计学差异(P >0.05),未出现高钠血症,这表明,IMPD 在对DCD 30 min 在体常温局部灌注的4 h 内,肝脏指标稳定,无高钠血症,符合规范对供肝维护的要求。
综上所述,本研究证明在体常温局部灌注对猪DCD 30 min 肝脏具有修复作用。
