miR-21对人牙周膜干细胞增殖及成骨分化的影响
2020-08-29马灵芝施娇壮戈文斌张琨余兵刘亚丽
马灵芝, 施娇壮, 戈文斌, 张琨, 余兵, 刘亚丽
昆明医科大学附属口腔医院口腔正畸科,云南 昆明(650101)
人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)是牙周组织中修复和再生重要的细胞群,因其具有免疫调节特性,且可以分化成为不同的细胞类型,如脂肪细胞、成骨细胞等,而被认为是牙周炎治疗的最有潜力的种子细胞。微小RNA(microRNA,miRNA)是18~25 个核苷酸组成的非编码、高度保守的RNA,因其在细胞分化、凋亡、增殖及迁移等多种过程中的作用而受到广泛关注[1]。有报道miRNA 在牙周炎的发生发展和宿主免疫发挥重要作用[2-3]。研究发现在牙周炎患者的血清miRNAs 表达谱中,miR-21 表达量异常,提示miR-21 作为关键miRNA 参与牙周炎的发生发展[4]。此外,有学者发现[5],miR-21 可以作为牙周炎控制的干预靶点,抑制牙周炎症。但miR-21 在牙周骨再生方面的研究较少,因此,本实验通过研究miR-21 对牙周膜干细胞增殖和分化的影响,旨在为牙周炎的治疗提供实验基础。
1 材料和方法
1.1 主要试剂和仪器
α-MEM 培养基(Hyclone,美国),胎牛血清(四季青,中国),PBS(Hyclone,美国),青霉素、链霉素(Gibco,美国),0.25%胰蛋白酶(Gibco,美国),Lipofectamine 2000(Invitrogen,美国),细胞周期检测试剂盒(Sysmex,日本),CCK-8 试剂盒(诺唯赞,中国),CD34(PE 标记)、CD45(PE 标记)、CD90(FITC标记)、CD105 抗体(FITC 标记),兔抗人Runx2 抗体(Abcam,美国),鼠抗兔荧光二抗(Proteintech,美国),成人骨髓间充质干细胞成骨诱导分化培养基试剂盒(Cyagen,美国),CO2培养箱(Thermo,美国),倒置相差显微镜以及照相系统(Olympus,日本),流式细胞仪(Partec,德国)、pre-miR-21 及其阴性对照pre-miR-21-NC,anti-miR-21 及其阴性对照anti-miR-21(锐博,中国),实时荧光定量PCR 仪(安捷伦。美国)。
1.2 hPDLSCs 的分离培养、鉴定
经患者知情同意,昆明医科大学附属口腔医院伦理委员会批准同意,收集因正畸治疗需要拔除的健康前磨牙,患者年龄为12~16 岁。酶解组织块法分离培养hPDLSCs,原代培养至细胞汇合达70%时,进行传代培养。取P3 代hPDLSCs,含2%胎牛血清的PBS 洗涤两次,调整细胞浓度为1 × 105个/mL,加入PE 标记的CD34、CD45 和FITC 标记的CD90、CD105 的抗体,避光4 ℃孵育30 min,含2%胎牛血清的PBS 洗涤两次,加入1 mL 的含2%胎牛血清的PBS 重悬,流式细胞仪上机检测进行鉴定。
1.3 细胞转染
待细胞融合至70%后,更换为不含青链双抗的α-MEM 培养基过夜培养,次日使用Lipofectamine 2000 进行pre-miR-21 及anti-miR-21 转染。pre-miR-21 为miR-21 模 拟 物,化 学 合 成 的 成 熟miRNA 双链,模拟天然存在的miRNA;anti-miR-21 是miR-21拮抗物,为化学修饰的成熟miRNA 互补单链,构建时,与成熟体序列的互补,参与抑制内源性miRNA的表达。实验分组为过表达组(mimics 组)、过表达阴性对照组(mimics-NC 组)、抑制组(inhibitor组)、抑制阴性对照组(inhibitor-NC组)。转染后24 h,实时荧光定量PCR 检测转染效率,引物序列参见表1。

表1 引物序列Table 1 Primer sequences
1.4 hPDLSCs 细胞增殖检测
1.4.1 CCK-8 检测 0.25%胰酶消化P3 代hPDLSCs,将细胞以每孔4 × 103个接种于96 孔板中,进行miR-21 及anti-miR-21 的转染,实验分组:过表达阴性对照组(mimics-NC 组)、过表达组(mimics组)、抑制阴性对照组(inhibitor-NC 组)、抑制组(inhibitor 组)。分别在转染后1、2、3、4 d,酶标仪测定在450 nm 波长处的吸光度。每组设5 个复孔,实验重复3 次。具体操作参照CCK-8 试剂盒说明书。
1.4.2 细胞周期检测 转染48 h 后,0.25%胰酶分别消化各组细胞,离心弃上清,加入1 mL 的细胞周期检测Buffer(试剂盒为一步法检测细胞周期),流式细胞仪上机检测。
1.5 hPDLSCs 成骨向分化检测
1.5.1 茜素红染色 转染后24 h,开始加入成骨诱导液(含地塞米松、β-甘油磷酸钠、抗坏血酸、谷氨酰胺的成骨诱导分化基础培养基),每隔3 d换液1次,镜下观察到矿化结节后改为半定量换液,至21 d 时,PBS 洗2 次,4%多聚甲醛固定30 min,加入茜素红染色3 min,PBS 洗2 次,镜下观察矿化结节。
1.5.2 Western blot 检测成骨相关蛋白Runx2 在成骨诱导7 d 后,提取蛋白并测定浓度。行SDSPAGE 电泳,半干法转膜,10%脱脂奶粉封闭2 h,加一抗,4 ℃孵育过夜,加二抗孵育,TBST 洗膜,条带显影及凝胶图像分析。
1.6 统计学方法
使用SPSS 18.0 统计学软件分析,计量资料以x±s表示,采用单因素方差分析和两样本独立t检验,P <0.05 为差异有统计学意义。
2 结 果
2.1 hPDLSCs 的原代培养和鉴定
原代细胞在培养7 d 左右爬出,细胞形态为长梭形。传代后的hPDLSCs 生长状态良好,呈典型的旋涡状生长(图1)。
Figure 1 Primary culture of hPDLSCs图1 hPDLSCs 原代培养
经流式细胞仪检测表面分子发现,所培养的hPDLSCs 低表达造血干细胞表面标志物CD34(1.51%)、CD45(1.01%),高表达间充质表面标志物CD90(94.16%)、CD105(98.33%)(图2)。
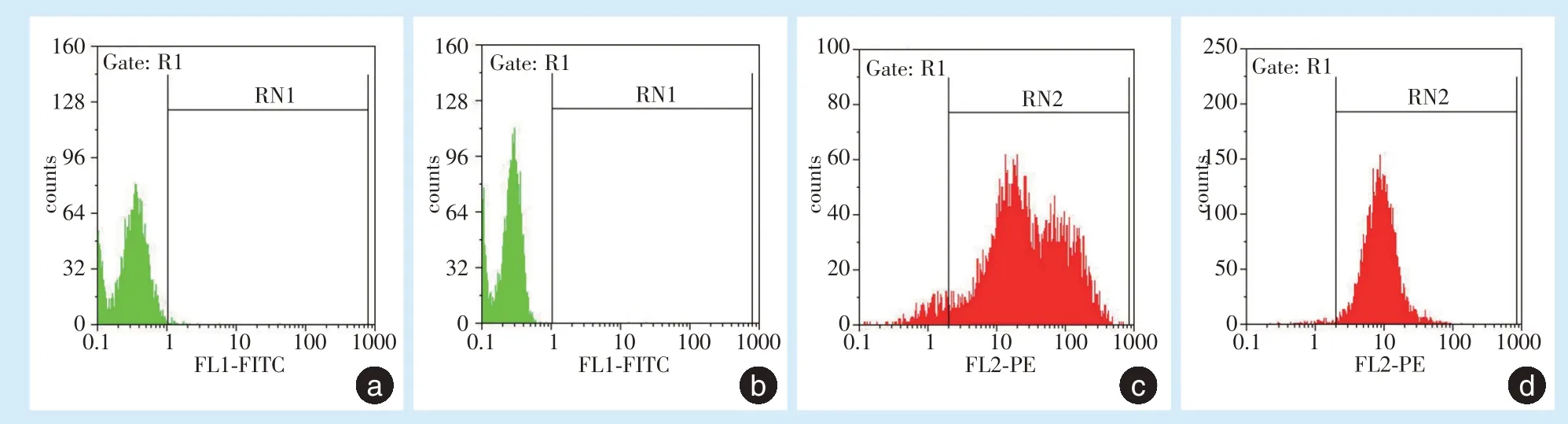
Figure 2 Surface molecules of hPDLSCs were measured by flow cytometry图2 流式细胞仪检测hPDLSCs 表面标志物
2.2 转染后miR-21 mRNA 的表达
转染后24 h,通过qRT-PCR 检测hPDLSCs 中miR-21 的mRNA 表 达 水 平,mimics 组 明 显 高 于mimics-NC 组,而inhibitor 组的表达明显低于inhibitor-NC组,差异均具有统计学意义(P<0.01)(图3)。
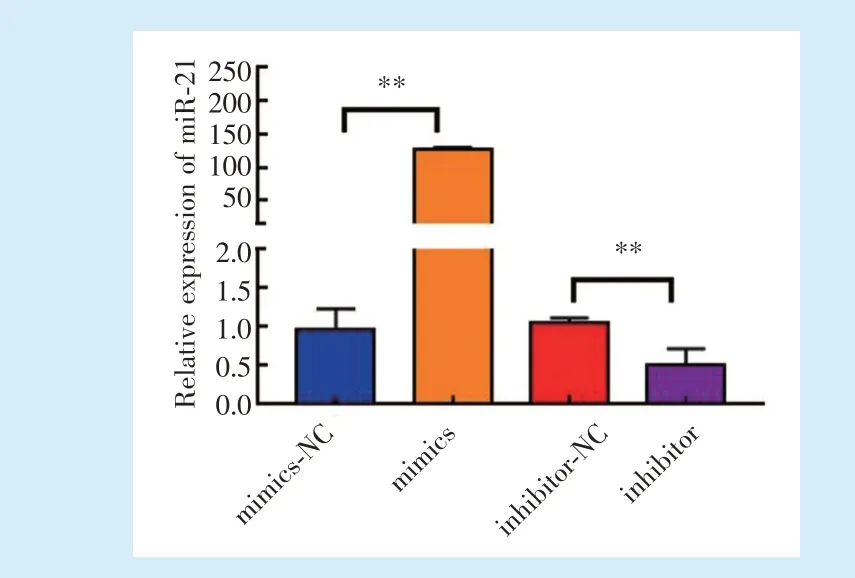
Figure 3 Relative expression of miR-21 in transfected hPDLSCs detected by qRT-RCR图3 实时定量PCR 检测转染后miR-21 mRNA 的表达
2.3 hPDLSCs 增殖检测
2.3.1 CCK-8 检测 hPDLSCs 的增殖经酶标仪检测OD 值发现,48、72、96 h 时,与mimics-NC 组相比,mimics 组细胞增殖明显增加(P<0.01),与inhibitor-NC 组相比,inhibitor 组细胞增殖明显减少(P<0.05)(图4)。
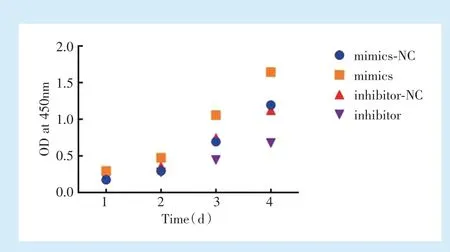
Figure 4 Proliferation of hPDLSCs after overexpression and inhibition of miR-21图4 miR-21 过表达及抑制后hPDLSCs 的增殖能力
2.3.2 hPDLSCs 细胞周期检测 经流式细胞仪检测发现(图5),mimics 组S 期细胞比例为(14.67 ±0.14)%,较mimics-NC 组(10.84 ± 0.64)%明显增加(t=10.127,P<0.01),与inhibitor-NC 组S 期细胞比例(11.72 ± 0.57)%相比,inhibitor 组S 期细胞比例(7.35±0.36)%明显减少(t=-11.334,P<0.05)。
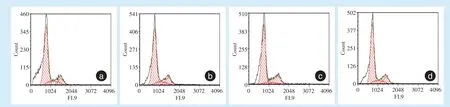
Figure 5 Cell cycle of hPDLSCsafter overexpression and inhibition of miR-21图5 miR-21 过表达及抑制后hPDLSCs 的细胞周期
2.4 hPDLSCs 成骨向分化的检测
2.4.1 茜素红染色 茜素红染色后,孔板照肉眼观,mimics 组的显色度明显高于mimics-NC 组,inhibitor组显色明显低于inhibitor-NC 组;在倒置显微镜下观察,mimics 组的矿化结节明显多于mimics-NC 组,inhibitor组矿化结节明显少于inhibitor-NC组(图6)。
2.4.2 Western blot 检测成骨相关蛋白Runx2 成骨诱导7 d 后,通过Western blot 检测成骨相关蛋白Runx2 蛋白表达水平,mimics 组明显高于mimics-NC 组(t=12.798),而inhibitor 组的表达明显低于inhibitor-NC 组(t=-12.098),差异具有统计学意义(P<0.05)(图7)。

Figure 6 Images of mineralized nodules by alizarin red staining after overexpression or inhibition of miR-21 in the 4 groups图6 miR-21 过表达或抑制后4 组矿化结节茜素红染色图片
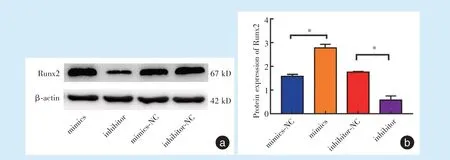
Figure 7 Protein expression of Runx2 after overexpression or inhibition of miR-21图7 miR-21 过表达或抑制后Runx2 的蛋白表达情况
3 讨 论
牙周炎是发生在牙齿支持组织、与免疫相关的一种慢性炎症破坏性疾病。目前对于牙周炎的治疗包括药物治疗[6]、手术治疗以及牙周基础治疗,但均只能控制炎症,不能对于已经缺损的牙周组织进行修复和再生[7]。因此,控制已有炎症恢复缺损的牙周组织成为牙周炎治疗的研究难点。牙周膜干细胞是牙周组织来源的间充质干细胞,具有自我更新、多向分化和免疫调节的特性,且在维持牙周内环境稳定方面具有重要作用。研究发现[8],在小型猪牙周炎模型中,使用小型猪自体PDLSCs 治疗牙周缺损,PDLSCs 能够成骨向分化,再生牙周组织。因此干细胞治疗作为一种新的、可行的临床治疗手段,为炎症破坏性疾病提供新的治疗思路[9]。
miRNAs 是一类在哺乳动物中高度保守的、非编码蛋白质的RNA,其能通过与靶基因的3`非编码区(3′UTR)碱基配对,引起mRNA 的直接降解或翻译受到抑制,从而参与细胞的基本生物学过程,如分化、增殖与凋亡[10]。此外,每一个miRNA 可能同时调控多个基因的表达。miR-21 位于17 号染色体,其全长22nt,由于其在多个肿瘤细胞中高表达,又被称为oncomiR[11-12]。近年研究发现,miR-21能通过多种信号途径参与调控干细胞的自我更新和分化[13-14]。Chen 等[15]发现阻断小鼠肉芽组织中皮肤干细胞miR-21 的表达,可以抑制细胞迁移和分化,但仍有部分细胞通过ROS 依赖途径促进增殖和自我更新;Trohatou 等[16]证实miR-21 通过调节Sox2 而参与间充质干细胞(mesenchymal stem cells,MSCs)的增殖和分化;Zhang 等[17]发现miR-21 促进人羊膜间充质干细胞(human amniotic membranemesenchymal stem cells,hAM-MSCs)的增殖;在去卵巢小鼠的骨质疏松模型中[18],miR-21 的表达、骨钙素浓度和碱性磷酸酶活性下降;杨楠[19]发现miR-21 靶向Sprouty 1 参与骨髓间充质干细胞的成骨分化。以上提示,miR-21 是参与细胞增殖和分化的关键miRNA。Runx2 是骨特异性转录因子,在促进成骨分化中发挥重要作用,其表达量可反映向成骨细胞转化的趋势。此外,Runx2 的蛋白水平又受miRNA 调控[20],miR-21 作为一种潜在的促成骨调节因子,参与调节Runx2 的转录活性[21]。本研究结果显示,miR-21 对Runx-2 有正向调控作用。Xing等[22]发现脂质体转染法对细胞损伤小、无免疫反应、操作简单、重复性高。因此,本实验采用脂质体转染法,使用Lipo 2000 转染pre-miR-21 及antimiR-21 至hPDLSCs,调高/降低hPDLSCs 中miR-21的表达。通过qRT-PCR 检测miR-21 的转染效率,排除转染试剂等对实验的干扰。通过CCK-8、流式细胞术检测细胞增殖、周期,发现miR-21 能够促进hPDLSCs 的增殖,与Zhang 等[17]研究一致;通过茜素红和Western blot 检测成骨分化能力,发现miR-21 正向调控hPDLSCs 的成骨向分化,这与杨楠[19]发现miR-21 参与MSCs 的成骨分化趋势一致。综上,本研究发现miR-21 能够显著调控hPDLSCs 的增殖和成骨向分化,但对于其作用的重要靶点及可能通路仍不明确,后续实验将进一步深入研究。
