鸡源乳酸菌的分离鉴定及其生物学特性分析
2020-08-28李宏伟慈百全侯明磊罗智文张瑶林连兵张棋麟
李宏伟 慈百全 侯明磊 罗智文 张瑶 林连兵 张棋麟

摘要:从健康鸡肠道中自行分离筛选出9株乳酸菌株为试验菌株,通过考察菌种的生长速度、耐酸、耐胆碱、耐肠胃液,并以抑菌性能作为主要指标。通过产酸能力测定、耐酸能力测定、耐受肠胃极端环境性能测定得到2株乳酸菌,2株乳酸菌上清液经牛津杯双层平板法对金黄色葡萄球菌、志贺氏菌、沙门氏菌、大肠杆菌、无乳链球菌等5株指示菌株进行抑菌试验,发现2株乳酸菌对5株指示菌株都具有非常明显的抑菌作用。采用16s rDNA分子标记对乳酸菌进行鉴定,并构建系统发育树。经分子生物学鉴定,L2为植物乳杆菌(Lactobacillus plantarum)、L4为短乳杆菌(Lactobacillus brevis)。
关键词:鸡源乳酸菌;耐受能力;菌株鉴定;抑菌
中图分类号: S182文献标志码: A文章编号:1002-1302(2020)13-0188-04
收稿日期:2019-08-24
基金项目:国家自然科学基金(编号:31760042、31960286);云南省教育厅科学研究基金(编号:2019J0050)。
作者简介:李宏伟(1993—),男,内蒙古赤峰人,硕士研究生,主要研究方向为肠道微生物及其高密度发酵。E-mail:lihongwei667@163.com。
通信作者:张棋麟,副教授,研究方向为生态基因组学。E-mail:zhangqilin88888@126.com。乳酸菌(lactic acid bacteria,LAB)是一类可以使碳水化合物发酵产生乳酸的革兰氏阳性细菌的总称[1];形态上常分为杆状和球状2类,为革兰氏阳性、兼性厌氧型细菌[2];被广泛应用于发酵食品生产中,被公认为安全的微生物,可应用于医疗、食品添加和畜牧等行业[3-5]。乳酸菌是工业上重要的细菌,这些细菌利用各种底物生产发酵食品和饮料,如牛奶、蔬菜、谷物、肉类、可可豆等。酸奶、奶酪和发酵乳制品被广泛认为是益生菌的主要来源[6-7]。益生菌被定义为“活的微生物”,在摄入一定数量的益生菌后,除固有的基本营养外,还能发挥健康益处[8-9]。益生菌的有益作用包括预防和治疗腹泻病、预防感染、管理炎症性肠病、免疫调节等疾病[2,10-11]。本研究从健康鸡肠道十二指肠黏膜中分离出优质的乳酸菌,通过对乳酸菌的耐酸、耐胆碱、耐肠胃液能力、产酸能力以及乳酸菌对大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella)、志贺氏菌(Shigella)等革兰氏阴性菌及金黄色葡萄球菌(Staphylococcus aureus)、无乳链球菌(Streptococcus agalactiae)等革兰氏阳性菌抑菌效果等指标测试评价,获得生长速率快、耐受极端环境强、抑菌作用强、抑菌谱广的优良菌株。
1材料与方法
1.1试验地点及时间
本试验于2019年3—7月在昆明理工大学生命科学与技术学院肠道微生物课题组内完成。
1.2材料与试剂
1.2.1菌种乳酸菌从云南特有品种无量山乌骨鸡(Gallus gallus)健康成年鸡肠道内分离获得。沙门氏菌、大肠杆菌、金黄色葡萄球菌、志贺氏菌、无乳链球菌为昆明理工大学生命科学与技术学院噬菌体与肠道微生物课题组实验室保存。
供试鸡,购自云南南涧无量山乌骨鸡养殖场。
1.2.2培养基与试剂MRS培养基:胰蛋白胨 10.00 g、牛肉粉8.00 g、酵母粉4.00 g、葡萄糖 20.00 g、硫酸锰0.04 g、磷酸氢二钾2.00 g、柠檬酸氢二铵2.00 g、乙酸钠5.00 g、硫酸镁0.20 g、吐温-80 1.00 g、琼脂15.00 g,加水至1 L,采用 1 mol/L 盐酸将培养基pH值调至5.8,121 ℃下灭菌 20 min。
LB培养基:胰蛋白胨10 g、酵母粉5 g、氯化钠 10 g、琼脂15 g,加水至1 L,121 ℃下灭菌 20 min。
其他生化试剂:结晶紫、碘液、乙醇、盐酸、胰蛋白酶、胃蛋白酶、猪胆盐等所有生化试剂,均购置于上海源叶生物科技有限公司。
1.3主要设备仪器
落地式超净工作台[邦西仪器科技(上海)有限公司]、酸碱度pH测定计(上海佑科仪器表有限公司)、紫外分光光度计(上海佑科仪器表有限公司)、立式高压蒸汽灭菌锅(上海申安医疗器械有限公司)、台式高速离心机(四川蜀科仪器有限公司)、恒温培养箱(上海一恒科学仪器有限公司)、恒温摇床(上海一恒科学仪器有限公司)、电热鼓风干燥箱(天津市泰斯特仪器有限公司)、超低温冰箱(日本三洋电器股份有限公司)。
1.4方法
1.4.1鸡肠道中乳酸菌的分离和纯化取健康鸡肠道,采用无菌生理盐水清洗鸡肠道并刮去肠道内容物,在肠黏膜表层不同位置刮取黏液,置于液体MRS培养基中,37 ℃下培养12 h[12]。将菌液取 100 μL 涂布于MRS固体培养基平板上(含5% CaCO3),37 ℃下培养24 h[13]。挑取生长最为旺盛且具有透明溶钙圈的单菌落继续在MRS固体培养基上进行分离纯化,将产生溶钙圈的菌落进行革兰氏染色试验,革兰氏染色阳性菌株初步定为乳酸菌,将上述菌株用含有15%甘油的MRS培养基保存于-80 ℃。
1.4.2菌株产酸分析将上述纯化后的菌株,取200 μL接种于5 mL MRS培養基中,37 ℃、150 r/min 下培养24 h,使用分光光度计检测乳酸菌在600 nm处的吸光度,并使用pH计检测其pH值。
1.4.3强酸耐受性试验选取产酸能力强的菌株,37 ℃下培养24 h,4 ℃、8 000 r/min离心10 min,取沉淀,将沉淀重悬于pH值为2.5的MRS液体培养基中,37 ℃、150r/min恒温培养3h,分别在0、3 h取样,以稀释涂布平板法测定菌株浓度[14]。
1.4.4胆盐耐受性试验将耐酸菌株接种于含0.3%猪胆盐的MRS中,37 ℃、150 r/min恒温培养,于0、4、8 h各取样1次,采用酶标仪检测其吸光度D值[15-16]。
1.4.5人工胃肠液耐受性试验将磷酸盐缓冲液(PBS)灭菌后,调至pH值为2.5,加入0.3%过滤除菌后的胃蛋白酶,制成模拟人工胃液;将PBS灭菌后,调至pH值为6.8,加入0.1%的胰蛋白酶和0.3%的猪胆盐,制成模拟人工肠液[16]。
将活化3代的菌液在4 ℃、8 000 r/min下离心10 min,收集菌体,用上述模拟人工胃液将菌体重新震荡悬浮,在37 ℃、150 r/min下培养3 h。然后将处理后的乳酸菌按照2%接种量接入至人工肠液中,在37 ℃、150 r/min下培养,分别于0、4、8 h取样,利用酶标仪检测其吸光度D值。
1.4.6抑菌试验将耐酸、耐胆汁的供试菌株接种于MRS液体培养基中培养24 h,离心取上清液,并用0.2 μm的过滤膜除菌,制得供试菌株无细胞培养液。
采用牛津杯法测定供试菌株的抑菌效果,利用牛津杯双层平板法将5株指示菌株分别混合于上层MRS软琼脂培养基中。待凝固后,采用镊子将无菌牛津杯置于无菌培养皿中,吸取供试菌株无细胞培养液200 μL于牛津杯中,先于4 ℃下放置4~5 h,使培养液完全扩散,在37 ℃下培养24 h,用游标卡尺测量抑菌圈直径[17],试验独立重复3次。
1.4.7数据统计分析每个试验独立重复3次,取其平均值并计算标准差。采用Microsoft Excel 2007及IBM SPSS 22.0软件对数据进行分析作图。
2乳酸菌菌株的鉴定
2.1乳酸菌基因组总DNA提取
采用十六烷基三甲基溴化铵(CTAB)法提取乳酸菌的基因组总DNA。
2.2乳酸菌16S rDNA的PCR扩增、测序与同源性分析
以乳酸菌菌株基因组DNA为模板,利用扩增细菌16S rDNA的通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGATACCTTGTTACGACTT-3′),对乳酸菌的16S rDNA进行PCR扩增。PCR扩增程序:94 ℃预变性5 min;然后 94 ℃ 变性30 s、52 ℃退火30 s、72 ℃延伸50 s,35个循环;72 ℃延伸10 min。PCR产物大小经过琼脂糖凝胶电泳检测验证后,将目标条带进行纯化,然后送至生工生物工程(上海)股份有限公司进行PCR产物的Sanger测序[18-19]。
将乳酸菌序列提交至美国国立生物技术信息中心(National Center for Biotechnology Informmion,NCBI)网站的GenBank数据库,采用BLAST在线服务器(https://blast.ncbi.nlm.nih.gov/Blast.cgi)将其与细菌数据库进行比对,通过比对得分最高的已知乳酸菌种类确定种名。
3结果与分析
3.1分离菌株的生长曲线及产酸能力比较
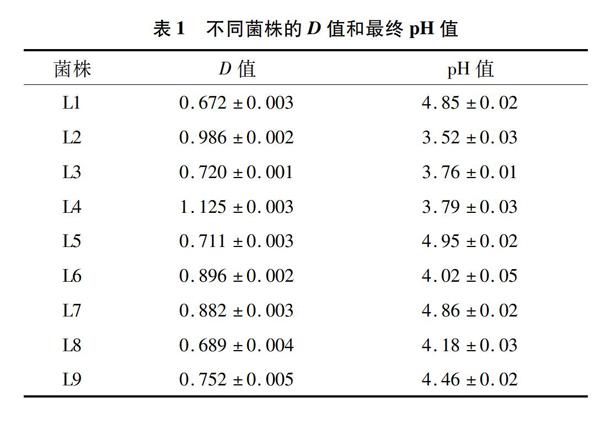
通过含有碳酸钙的MRS培养基对鸡肠道中的乳酸菌进行筛选,经37 ℃恒温培养箱培养24 h,挑选生长旺盛、溶钙圈明显的菌落。将上述菌落继续在MRS固体培养基平板上进行平板划线分离,得到纯化后具有溶钙圈的革兰氏阳性菌疑似乳酸菌9株,对9株疑似乳酸菌菌株编号为L1~L9(表1)。
3.2强酸耐受性比较
选取产酸能力最强的菌株,进行强酸耐受性试验,得到4株产酸能力强的菌株,于pH值为2.5的强酸MRS培养基中37 ℃恒温摇床培养3 h,使用稀释涂布平板法检测活菌数,见表2。
由表2可知,4株产酸能力比较强的菌株对酸的耐受能力不同,其中L2、L4对酸的耐受能力达到100%,L3耐受力为24.5%,L6耐受力为19%。选择L2、L4进行下步试验。
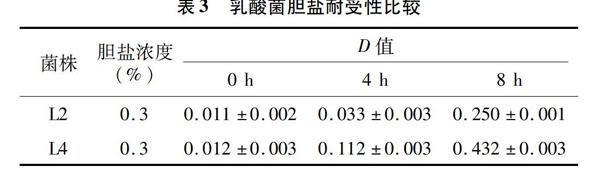
3.3胆盐耐受性比较
将产酸能力较强的2株乳酸菌L2、L4取 200 μL 接种于5 mL含有0.3%猪胆盐的MRS液体培养基中,于37 ℃、150 r/min下培养8 h,吸光度檢测结果见表3。由表3可知,2株乳酸菌受0.3%胆盐胁迫,仍能够保持良好的生长状态,L2的胆盐耐受能力显著低于L4的耐受力。
3.4乳酸菌抑菌试验
通过牛津杯平板法对2株乳酸菌进行抑菌能力检测,由表4可知,2株菌株对5株指示菌株的抑菌圈平均直径均在18 mm以上,说明2株乳酸菌对以金黄色葡萄球菌为代表的革兰氏阳性菌、以大肠杆菌为代表的革兰氏阴性菌都具有非常明显的抑菌效果。
乳酸菌对致病菌的最低抑菌浓度可以在一定程度上反映金黄色葡萄球菌对乳酸菌的敏感性,也反映了乳酸菌对金黄色葡萄球菌的抑制作用。抑制浓度越低,乳酸菌对金黄色葡萄球菌的抑制作用越明显。由图1、图2可知,虽然接种5%乳酸菌无细胞上清液对金黄色葡萄球菌有一定抑制作用,但效果不明显。而接种10%以上的乳酸菌无细胞上清液对金黄色葡萄球菌的抑制作用几乎达到100%。结果表明,一定量的乳酸菌无细胞培养物可以抑制金黄色葡萄球菌的生长。所得数据可为未来工业应用中添加乳酸菌质量浓度的选择提供直接参考。
3.5耐人工肠胃液比较
由表5可知,2株乳酸菌经人工胃液处理3 h后,活菌数无明显差异。将2株经人工胃液处理后的乳酸菌转接至人工肠液中,发现2株乳酸菌均不受人工肠液影响,能够正常生长,由此推断2株乳酸菌不但能够耐受人工胃液,而且能够在肠液中生长,具备良好的肠胃液耐受能力。
4菌种鉴定
结果表明,菌株L2 16S rDNA基因序列与植物乳杆菌(L. plantarum)均有高于99%的同源性,确定L2菌株为植物乳杆菌。L416SrDNA基因序列
5结论与讨论
乳杆菌广泛应用于发酵食品生产中,如发酵蔬菜、发酵肉类等。本研究从鸡十二指肠黏膜上分离得到的2株乳杆菌,较分离于自然环境下的乳杆菌更易于定殖在动物肠道内,维持肠道菌群平衡,经16S rDNA鉴定属于植物乳杆菌和短乳杆菌。本研究中的2株乳杆菌,产酸、耐酸性能较为突出,均能在pH值=2.5的培养基中生存,这说明2株乳杆菌能够通过胃达到肠道,这为其发挥益生性能起到了先决作用。2株乳酸菌在含0.3%胆碱培养基中能够生存并繁殖,满足了优良益生菌的特性。此外,2株乳杆菌对革兰氏阳性菌与革兰氏阴性菌都具有良好的抑菌效果。由此可知,2株乳酸菌对动物肠道及食品中的有害细菌具有广谱抑菌作用,这对发酵肉制品、蔬菜等食品生产和贮存具有重要意义。
参考文献:
[1]钱洋. 乳酸菌对食品中常见霉菌的抑制和黄曲霉素的去除[D]. 济南:山东大学,2012.
[2]温晓庆. 乳酸菌及有效成分抗肿瘤作用与机制探讨[J]. 北京农业,2008(12):41-43.
[3]Holzapfel W H,Schillinger U. Introduction to pre and probiotics[J]. Food Research International,2002,35(2):109-116.
[4]吕常江,胡升,黄俊,等. 用于功能性乳制品制备的可控性乳酸菌裂解系统构建[C]//2015年中国化工学会年会论文集. 北京:中国化工学会,2015.
[5]杨尚娇. 新疆地区干酪中产细菌素乳酸菌的筛选、系统发育及其抑菌活性研究[D]. 石河子:石河子大学,2015.
[6]周晓丹,张昊,郭慧媛,等. 发酵乳制品中益生菌生存能力影响因素的研究進展[J]. 中国乳业,2013(4):46-50.
[7]Martín R,Chain F,Miquel S,et al. Using murine colitis models to analyze probiotics-host interactions[J]. FEMS Microbiology Reviews,2017,41(Supp1):S49-S70.
[8]Doyle M P. Food microbiology:fundamentals and frontiers[M]. 3rd ed. Washington,D.C.:AMS Press,2007.
[9]Kovachev S. Defence factors of vaginal lactobacilli[J]. Critical Reviews in Microbiology,2017,44(1):31-39.
[10]卢丽莉. 益生菌治疗小儿抗生素相关性腹泻随机对照研究的meta分析[J]. 临床儿科杂志,2010,28(11):1083-1085.
[11]李龙,刘锁珠,王宏辉. 藏鸡源乳酸菌菌株的分离、鉴定与筛选[J]. 饲料研究,2013(8):13-15.
[12]刘国荣,周康,李平兰,等. 传统干酪中一株产Ⅱa类细菌素乳酸菌的分离与鉴定[J]. 食品科学,2007,28(5):185-190.
[13]张德珍,潘道东,戴传超. 一株降胆固醇乳酸菌的鉴定及其在模拟胃肠环境中抗性的研究[J]. 食品科学,2004(11):281-284.
[14]徐丽丹,邹积宏,袁杰利. 一株降血压功能乳酸菌在模拟胃肠环境中抗性的研究[J]. 中国微生态学杂志,2011,23(2):112-114.
[15]张明,李新胜,马超,等. 发酵黑木耳酱菜益生乳酸菌菌株的筛选[J]. 中国食品学报,2018,18(11):103-108.
[16]黄宝莹,佘之蕴,苏妙仪,等. 食品添加剂对两种乳酸菌的抑菌作用[J]. 中国乳品工业,2015,43(8):16-18.
[17]叶陵,李勇,王蓉蓉,等. 剁辣椒中优良乳酸菌的分离鉴定及其生物学特性分析[J]. 食品科学,2018,39(10):112-117.
[18]陈曦,周彤,许随根,等. 贵州酸肉中具有高亚硝酸盐降解和耐受能力乳酸菌的筛选与鉴定[J]. 中国食品学报,2018,18(2):256-264.
[19]Tamura K,Stecher G,Peterson D. MEGA6:molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution,2013,30(12):2725-2729.胡宗文,杨娟,苗春辉,等. 西方蜜蜂群势与气候的周年变化及相关性分析[J]. 江苏农业科学,2020,48(13):192-196.doi:10.15889/j.issn.1002-1302.2020.13.039
