解磷菌JL-1对磷矿粉降解性能的研究
2020-08-28李文王陶
李文 王陶
(徐州工程学院 江苏省食品资源开发与质量安全重点建设实验室,徐州 221018)
磷是细胞内磷脂、核酸、糖脂及含磷辅酶等的重要组成成分,是植物生长发育过程中重要的物质基础,对植物体内的碳水化合物代谢、氮代谢、能量代谢以及物质运转都起着非常重要的作用[1-5]。如果磷素缺乏时,细胞的形成和扩散会受到抑制,植物根系生长会被限制,因此,农作物缺磷轻则产量下降,重则颗粒无收。据统计,我国74%的耕地土壤缺磷[6],缺磷的主要原因是由于土壤中有效磷很少,绝大部分以无效磷的方式存在。目前,为了满足大量农作物生长的需求,需要人为添加磷肥。磷大量存在于矿物或岩石中,主要以羟磷灰石、磷灰石和氧磷灰石等矿质形式为主,它们构成了磷矿粉的主要成分,这些物质为磷肥生产提供了廉价的原料[7]。但磷肥的利用率却很低,施入土壤中的磷与Ca2+、Al3+和Fe3+等离子形成不溶性磷酸盐,很难被植物利用[8]。土壤中不能被植物吸收利用的磷元素会随着雨水的冲刷进入水中,进而造成了水源的污染;在磷肥的生产过程中会加入许多重金属离子,随着农用磷肥的施加这些重金属等危害元素也会在土壤里沉积,从而会导致土壤被重金属等危害元素污染[9]。如何提高土壤中磷的利用率以及制作出对环境友好的新型微生物磷肥是当务之急。
解磷菌是能将植物难以吸收利用的磷元素转化为可被吸收利用形态的一类微生物,解磷菌对农业生产与环境保护有重大意义,有助于农作物的生长发育,还会改善污染的土壤,是一种环境友好型微生物肥料。目前已报道的解磷菌有细菌、真菌、藻类、放线菌等[10-16]。解磷菌解磷是一个非常复杂的过程,不同的解磷微生物解磷的机理不同,因此解磷机制比较复杂与多样。解磷微生物降解难溶性磷的机理多数是关于生理生化方面,主要是通过微生物新陈代谢的产物来实现,如有机酸、多糖和质子等[17-20]。不同的微生物由于遗传及代谢的不同,对于难溶性磷的降解能力也存在差异,即使是同一种解磷菌的解磷能力也会受到环境因素如碳、氮源、pH、温度的影响[21-23],从而影响其解磷性能。因此,为更好地应用解磷菌,对其解磷性能、解磷条件的研究显得尤为重要。本实验室筛选到的一株高效解磷新菌株——不动杆菌JL-1[10]在磷矿粉的环境下进行解磷性能测定,磷矿粉的成分复杂,并含有Al、Fe等多种金属离子,更难被微生物利用,相较于以磷酸钙的纯品为磷源,磷矿粉更贴近于土壤环境,更具有现实意义。优化解磷菌JL-1降解磷矿粉磷的解磷条件,并通过磷矿粉中的磷素释放量、储存量和同化量全面评价其降解磷矿粉的能力,旨为通过生物途径开发利用磷矿粉研发新型微生物磷肥奠定一定基础。
1 材料与方法
1.1 材料
1.1.1 实验材料及培养基 不动杆菌(Acinetobacter indicus)JL-1(保存在徐州工程学院微生物遗传育种实验室)。黄麦岭磷矿粉:全磷含量(P2O5%)为20%。磷矿粉液体培养基:葡萄糖10.0 g、磷矿粉2 g、(NH4)2SO40.5 g、KCl 0.2 g、NaCl 0.2 g、MgSO4·7H2O 0.1 g、FeSO4·7H2O 0.03 g、MnSO4·4H2O 0.03 g、酵 母 粉0.5 g、蒸 馏 水1 000 mL,pH7.0,121℃高压蒸汽灭菌20 min。砂培实验培养基:葡萄糖 10.0 g、(NH4)2SO40.5 g、酵母膏0.4 g、蒸馏水1 000 mL,pH7.0,121℃灭菌25 min。LB液体培养基:NaCl 10 g、蛋白胨10 g、牛肉浸膏5 g、蒸馏水1 000 mL,pH7.0,121℃灭菌20 min。LB固体培养基:LB液体培养基中加入琼脂粉,使其浓度为18 g/L。
1.1.2 仪器 HYG 旋式恒温调速摇瓶柜,上海欣蕊自动化设备有限公司;TU-1810 紫外-可见分光度计,北京普析通用仪器有限责任公司;HH.B11.600-S-Ⅱ型电热恒温培养箱,上海跃进医疗器械厂;TGL-16G高速台式离心机,上海安亭科学仪器厂。
1.2 方法
1.2.1 种子液制备 斜面上刮取3环解磷菌JL-1,接入150 mL LB液体培养基中,将其放置于30℃,150 r/min的摇床中振荡培养24 h,24 h后再按3%的接种量重新接种到新鲜的LB培养基中,振荡培养24 h后即为种子液。
1.2.2 解磷菌JL-1降解磷矿粉能力测定 在超净工作台中,在装有100 mL磷矿粉培养基的锥形瓶中接入1%的种子液,以不接菌为对照,以接有菌液的磷矿粉培养液为实验组,设置3个平行,30℃,150 r/min振荡培养5 d,每隔24 h,取出培养液,于8 000 r/min离心15 min,检测上清的解磷量,通过钼蓝比色法测定解磷量[24]。
1.2.3 解磷菌JL-1对磷矿粉最适解磷性能研究
1.2.3.1 碳源种类及浓度对解磷菌降解磷矿粉性能的影响 分别选取羧甲基纤维素钠、葡萄糖、蔗糖、乳糖和淀粉作为碳源,其他条件都不变,对照组不接菌,接种量1%,30℃、150 r/min振荡培养3 d,测定解磷量。采用最佳碳源,改变培养基中碳源浓度为5-25 g/L,梯度为5 g/L,30℃,150 r/min恒温振荡培养3 d,测定解磷量。
1.2.3.2 氮源种类及浓度对解磷菌降解磷矿粉性能的影响 选取无机氮源草酸铵、硫酸铵、硝酸钾,有机氮源蛋白胨、牛肉膏及酵母粉,不接菌为对照,30℃,150 r/min振荡培养3 d,测定解磷量。
确定最佳无机氮源和最佳有机氮源后,按照质量比1∶1将有机氮源与无机氮源混合,加入磷矿粉培养基中,浓度与单一氮源保持一致,再设单一的最佳有机氮源与无机氮源各一组,30℃,150 r/min振荡培养3 d,测定解磷量。
在最佳氮源的基础上,将氮源浓度设成从0.5-2.5 g/L,梯度为0.5 g/L,30℃、150 r/min振荡培养3d,测定解磷量。
1.2.3.3 磷矿粉添加量对解磷菌降解磷矿粉性能的影响 改变培养基中的磷矿粉添加量,将其设为按磷矿粉全磷含量0.2、0.4、0.8、1.2和1.6 g/L,即磷矿粉添加量为1、2、4、6、8 g/L,30℃,150 r/min振荡培养3 d,测定解磷量。
1.2.3.4 接种量对解磷菌降解磷矿粉性能的影响 确定最佳培养基配方后,将接种量设置为0.5、1.0、1.5、2.0和2.5%,培养基的组分及培养条件保持不变,30℃、150 r/min振荡培养3 d,离心,取上清测定解磷量。
1.2.3.5 温度对解磷菌降解磷矿粉性能的影响 改变磷矿粉培养液的培养温度分别为26、28、30、37、40℃,培养基的组分及培养条件保持不变,分别在不同温度,150 r/min,振荡培养3 d,离心,取上清测定解磷量。
1.2.3.6 响应面法优化解磷菌降解磷矿粉条件 以单因素实验的结果为参考,选取3个较为显著的影响因素碳源浓度、氮源浓度、接种量,进行响应面试验,以此来研究3个因素的交互作用对解磷细菌降解磷矿粉的影响,响应面因素水平表见表1。
1.2.4 解磷菌JL-1最适条件下的解磷矿粉时间曲线
1.2.4.1 解磷菌JL-1活菌数变化 在响应面实验的基础上得到最优解磷矿粉培养条件,在此条件下培养84 h,从0 h起,每12 h在超净工作台中取样,用无菌水将样品稀释至10-7,涂布于LB固体培养基表面,置于28℃的恒温培养箱中,静置48 h,记录每个时间点的菌落数,观测菌落数随时间变化趋势。
1.2.4.2 培养液pH变化的时间曲线 在最佳降解磷矿粉条件下,每隔12 h取样测定培养液的pH,记录每个时间点的pH,观测pH随时间变化趋势。

表1 响应面试验设计因素与水平表
1.2.4.3 培养液磷含量变化曲线 在最佳降解磷矿粉的条件下,每隔12 h取样,测定上清的磷含量,观测磷含量随时间变化趋势。
1.2.5 解磷菌JL-1对磷矿粉中磷素的释放量、储存量及同化量测定
1.2.5.1 细砂处理 用10目筛细细地筛出砂子,水洗以除去附着土壤,直至水变得澄清后,将筛出的砂子用1%的稀盐酸浸泡24 h后,用蒸馏水洗至中性,晾干后,准确称取6 g 磷矿粉与晒干后的砂子600 g搅拌混合均匀,在150 mL的锥形瓶中准确称量50 g混合物,共分装12瓶,121℃灭菌30 min。
1.2.5.2 砂培 将种子液2 mL分别接入灭菌的细砂中,并加入8 mL砂培培养基,将12瓶锥形瓶分为3组,每组4瓶,3瓶为平行实验,1组为不接菌液的空白对照,在28℃的恒温培养箱中静置培养6周。
1.2.5.3 砂培后处理 将培养6周的培养物取出,进行下列处理:(1)直接浸提:将4瓶砂土培养物,在锥形瓶中加入0.5 mol/L的NaHCO350 mL振荡,转速为170 r/min培养30 min,4 000 r/min离心15 min,取上清液测定磷含量;(2)熏蒸处理:将8瓶砂土培养物、50 mL氯仿及50 mL的1 mol/L NaOH放入真空干燥器用泵抽至氯仿沸腾并保持5 min,后密封25℃熏蒸24 h,空泵反复抽至没有氯仿味,在锥形瓶中各加入0.5 mol/L的NaHCO350 mL,在转速为170 r/min的条件下振荡30 min,4 000 r/min离心15 min,取其中1瓶空白对照,3瓶接菌的上清液测定磷含量;(3)消煮处理:取剩下4瓶的上清液各5 mL,在上清液中慢慢加入8 mL浓H2SO4,消煮至棕黑色,加30% H2O2数滴,继续消煮至清亮。消煮液转入50 mL容量瓶定容后,测定消煮液中磷含量[19]。
1.2.5.4 计算 溶解量以及解磷率按公式(1)、(2)进行计算。

式中,CP:溶解量,μgP/g磷矿粉;M1:实验组含磷量,μg;M2:对照组含磷量,μg;m:磷矿粉的质量,g;50:提取液的总体积,mL;V:测量吸光度用的提取液体积,mL;22.8%:KH2PO4中P所占的百分比。
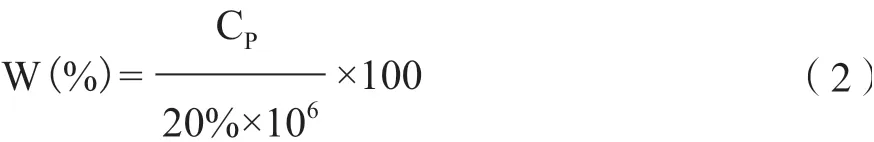
式中,CP:溶解量,μgP/g磷矿粉;20%:磷矿粉的全磷含量;106:μg到g的换算。
1.2.6 数据分析方法 每个试验3次重复,结果表示成平均值±标准偏差。采用Excel 2010、SPSS 19.0对数据进行统计分析,采用Origin8.5作图。
2 结果
2.1 碳源对解磷菌JL-1解磷能力的影响
2.1.1 碳源种类对解磷菌JL-1解磷矿粉能力的影响 碳源是构成生物细胞的主要元素,也是产生各种代谢产物和细胞内储藏物质的主要原料。如图1可知,相较于其他碳源,当碳源为蔗糖、葡萄糖时,解磷量较高,说明解磷菌能更好地利用葡萄糖或者蔗糖来降解磷矿粉,而以葡萄糖为碳源比蔗糖为碳源的解磷量最高,3.78 μg/mL,由此可以确定解磷菌降解磷矿粉的最优碳源为葡萄糖。
2.1.2 碳源浓度对解磷菌JL-1解磷矿粉能力的影响 选取最优碳源葡萄糖,考察其浓度对解磷细菌降解磷矿粉能力的影响,其结果如图2所示,在5-10 g/L的葡萄糖浓度的范围内,解磷量增加缓慢;在10-15 g/L的浓度范围内,解磷量增长幅度大,在浓度为15 g/L时,解磷量达到最高值,为3.83 μg/mL,在15-25 g/L范围内,解磷量逐渐减少。因此,解磷矿粉的最优碳源浓度为15 g/L。
2.2 氮源对解磷菌JL-1解磷能力的影响
2.2.1 不同氮源对解磷菌JL-1解磷矿粉能力的影响 培养基中的氮源能为微生物生长所必须的核苷酸、维生素以及矿物质等营养成分提供N元素,根据微生物其生长代谢特点选择合适的氮源,会增强解磷细菌降解磷矿粉的能力。
图3显示使用单一氮源时,有机氮源要高于无
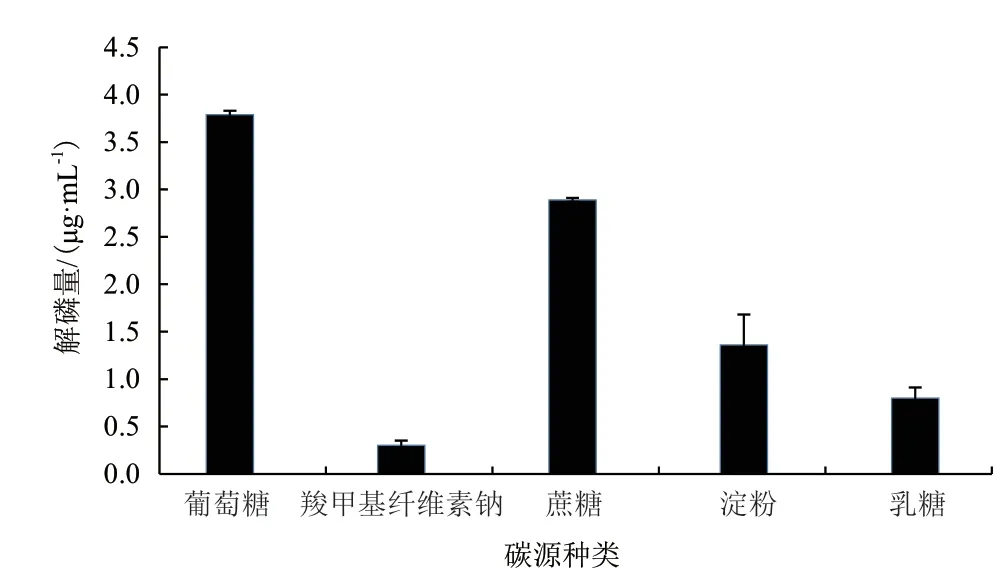
图1 碳源种类对解磷量的影响
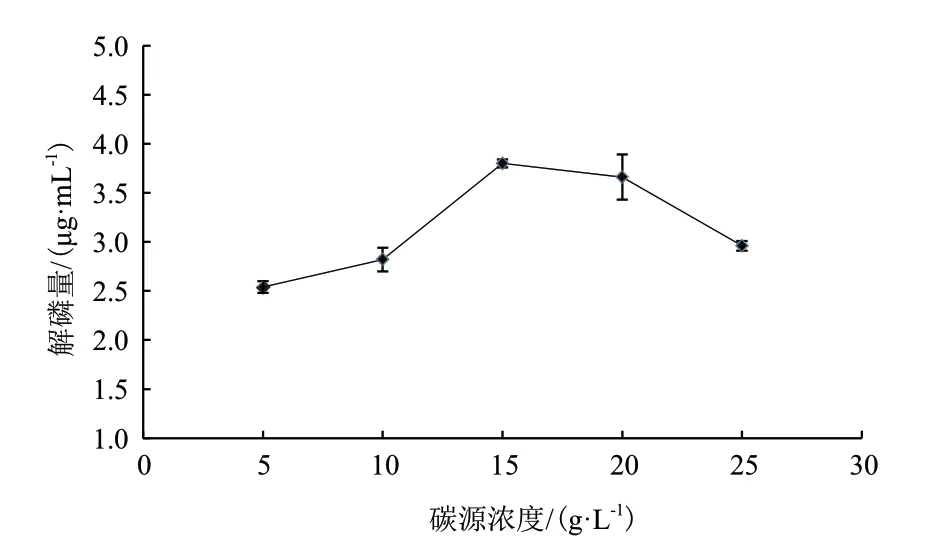
图2 碳源浓度对解磷量的影响
机氮源的解磷量,而在有机氮源的种类中,酵母粉的解磷效果最好,解磷量为3.086 μg/mL,无机氮源硫酸铵最佳,而在无机氮源中,硫酸铵的解磷效果最好,但低于有机氮源的解磷量,仅为1.43 μg/mL,将单一氮源变为有机无机复合氮源时,从图4可知,按质量比1∶1混合硫酸铵与酵母粉时,解磷量为3.87 μg/mL,明显高于单一氮源中的解磷量。因此,解磷菌JL-1最优氮源为酵母粉和硫酸铵组成的复合氮源。
2.2.2 氮源浓度对解磷菌JL-1解磷矿粉能力的影响 影响微生物代谢的一个重要因素是碳氮比,因此不同的氮源浓度对菌株解磷能力有很大影响[19]。由图5可知,解磷量在复合氮源浓度0.5-1.0 g/L的范围内解磷显著增加,在氮源浓度为1.0 g/L时达到最高,为4.08 μg/mL,而在1.0-2.5 g/L范围内逐渐降低,因此,解磷菌JL-1的最适氮源浓度为1.0 g/L。
2.3 磷矿粉添加量对解磷菌JL-1降解磷矿粉能力的影响
磷矿粉添加量对解磷量影响如图6所示,当磷
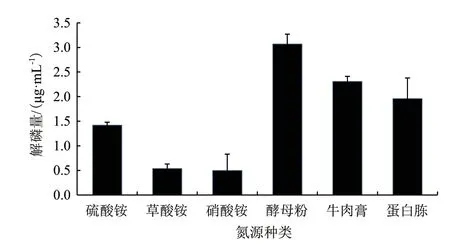
图3 单一氮源对解磷量的影响
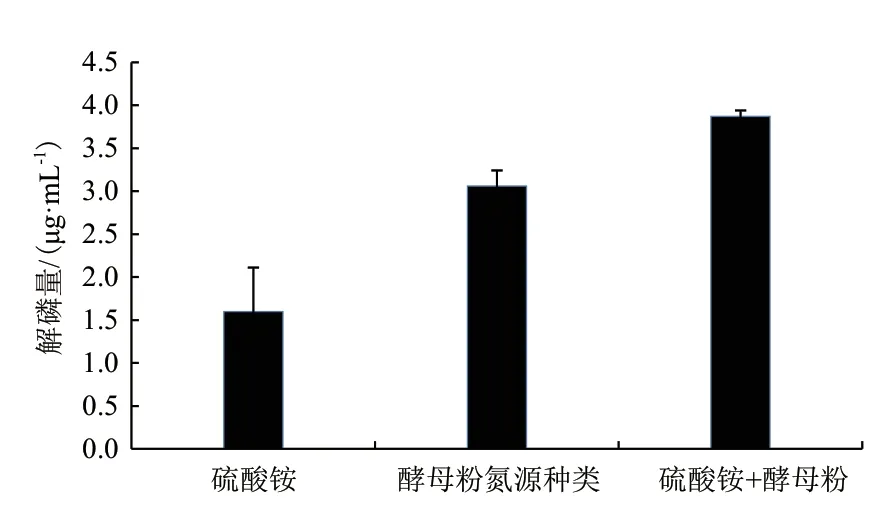
图4 复合氮源对解磷量的影响

图5 氮源浓度对解磷量的影响
矿粉的添加量在1-2 g/L时,解磷量在增加,而添加量在2-8 g/L时,解磷量稳定在4.0 μg/mL左右,这表明解磷菌JL-1在降解磷矿粉时,所释放的有机酸与酶有限,只能降解一定量的磷矿粉,所以当添加量大于2 g/L时,解磷量变得稳定。
2.4 接种量对解磷菌JL-1解磷能力的影响
接种量的大小决定于菌种的生产繁殖速度,若用较大的接种量,可以缩短菌种繁殖达到最高峰的时间,并且解磷细菌能够迅速成为培养环境中的优势菌种,从而减少杂菌生长的可能性。如果接种量过多,菌种生长过快,培养环境中的养分以及氧气供给不足,会造成菌种过快死亡,影响解磷菌降解磷矿粉的效果。
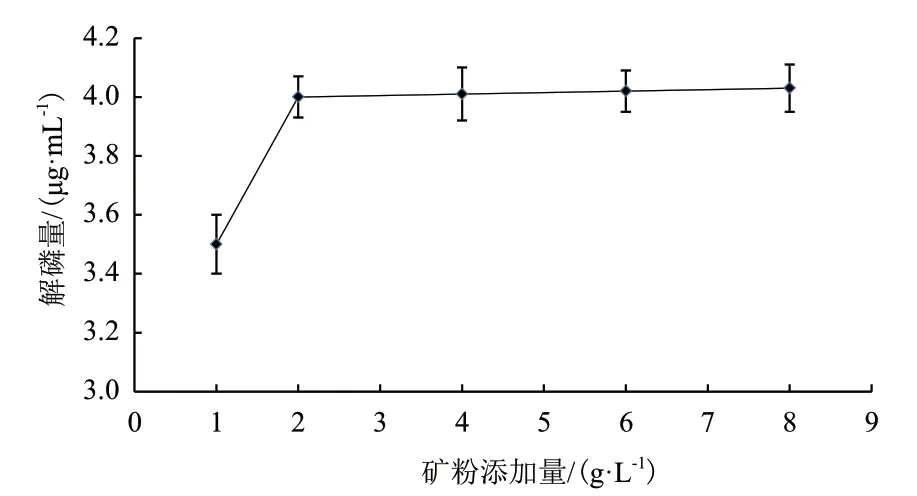
图6 磷矿粉添加量对解磷量的影响
从图7可以看出,解磷量在0.5%-1%接种量之间迅速上升,在接种量为1%时达到顶峰,为4.18 μg/mL,由此可以看出,当接种量为1%时,解磷细菌降解磷矿粉的效果比较好。
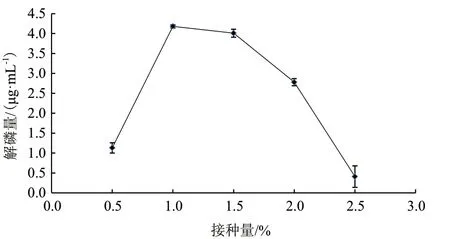
图7 接种量对解磷量的影响
2.5 pH值对解磷菌JL-1解磷能力的影响
微生物生长的最适pH值在6-8之间,不同的微生物都有其最适宜的pH,外界环境的pH会影响细胞膜上的蛋白以及释放到胞外的酶的活性,从而影响营养物质的转运与吸收,环境的pH还会影响培养基中的营养物质的分解。因此选择最佳的pH,有助于解磷细菌更好地降解磷矿粉,考察pH对解磷菌降解磷矿粉能力的影响。
从图8可以看出,当初始pH值在5.5-7.0时,解磷量在逐步升高,而当初始pH大于7.0时,解磷量逐渐降低,所以解磷菌JL-1最适pH为7.0,解磷量为4.20 μg/mL,由此可以看出在初始pH在中性是有利于解磷细菌降解磷矿粉。
2.6 温度对解磷菌JL-1解磷能力的影响
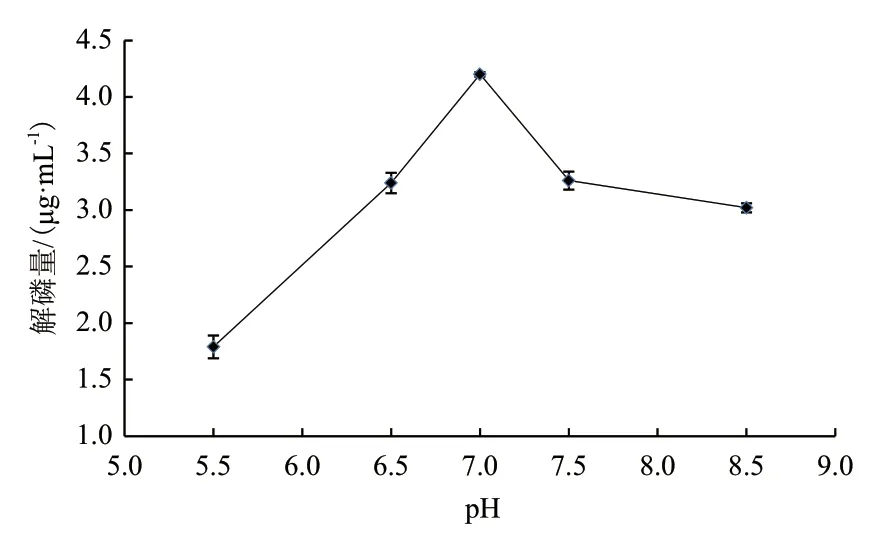
图8 pH对解磷量的影响
温度影响微生物生长和代谢的环境条件中的一个重要因素之一,温度过高会影响细胞内的酶的活性,进而影响细胞的正常生理代谢,过低的温度会使菌种进入休眠状态,会影响发酵的效果。所以适宜的温度会加快解磷菌降解磷矿粉的进程。
图9显示,在26-28℃之间,解磷量在上升,且上升幅度较大,而从28-40℃,解磷量逐步下降,在28℃最高达到最高,为4.45 μg/mL,由此可以确定在28℃时,解磷细菌降解磷矿粉的效果最好。

图9 温度对解磷量的影响
2.7 响应面优化解磷菌JL-1对磷矿粉的解磷条件
依据前面单因素实验结果,选取解磷菌JL-1解磷过程中影响较大的因素碳源浓度、氮源浓度、接种量来设计响应面试验。结果见表2。
根据表2,解磷量为响应值,经软件拟合,得到各因素对解磷量的回归方程。用编码表示:
解磷量=4.55+0.21A+0.12B+0.041C+0.093AB-0.089BC-0.37A2-0.23B2-0.30C2
利用Design-Expert 8.0.6软件对试验结果进行方差分析,结果如表3。
从表3可以看出,模型设计中,其F值为24.36,说明了该模型显著,试验数据可信;这个试验模型中AC对解磷量的影响显著(P<0.05)且A、B、A2、B2、C2对解磷量的影响极显著(P<0.01),说明了葡萄糖浓度、接种量以及氮源浓度三者之间存在交互作用,彼此之间互相影响。失拟项P=0.471 0>0.05,说明该模型失拟不显著,方程能够反映出解磷量与碳源浓度、氮源浓度以及接种量之间的关系,回归方程的校正系数R2adj=0.929 3(>0.90),表明了此方程的拟合度为92.93%,拟合度良好,较接近R2。因此,解磷量能够通过此模型进行分析与预测,从单个因素的F值大小可知,3个因素对解磷量的影响大小的顺序为:葡萄糖浓度>氮源浓度>接种量。

表2 响应面设计方案及结果
图10-A等高线近似椭圆形,所以葡萄糖浓度和接种量之间的相互作用较强,这一组合对解磷量的影响显著。图10-B显示了葡萄糖浓度与接种量之间的交互作用,可以看出响应面曲面的坡度比较陡峭,说明解磷量对葡萄糖浓度和接种量的变化比较敏感。
通过回归模型的预测,得到试验条件:葡萄糖浓度16.69 g/L、氮源浓度1.15 g/L、接种量1.05%,此时解磷量理论值为4.60 μg/mL。分析该方程得到最佳发酵条件为,为了方便实验,选取葡萄糖浓度17 g/L,氮源浓度1.2 g/L,接种量1%,进行验证试验,重复3次,测得解磷量的平均值为4.65 μg/mL,与预测值相近,证明了响应面模型的可靠性。
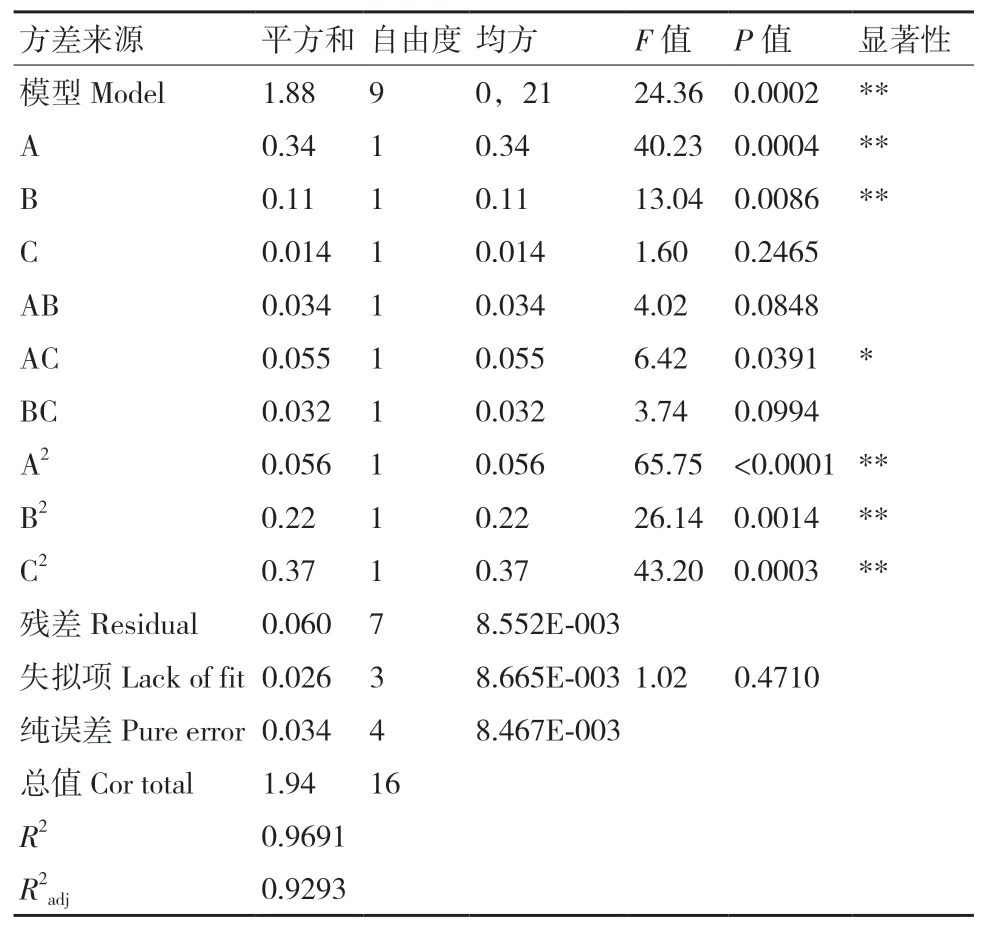
表3 方差分析表
2.8 解磷菌JL-1降解磷矿粉的时间曲线
在最佳发酵条件下,动态检测84 h内解磷菌发酵的磷含量、pH及解磷菌生长情况,了解解磷菌降解磷矿粉的发酵过程。图11显示,解磷菌在12 h后快速增长,在60 h时菌落数达到最高值,为10.65 log(CFU/mL),之后稍有下降,pH值在0-60 h持续降低,在60 h将至最低,而解磷量在0-60 h之间持续上涨,解磷量在60 h达到最大,为4.65 μg/mL,此时的溶磷率为2.34%,说明在60 h时,菌落数持续增长,菌的代谢产物使得发酵液的pH下降,可能同时在解磷菌所释放的酶的共同作用下,使磷矿粉降解,在60 h后菌落数开始下降,pH也稍有回升,同时解磷量也稍有下降,随发酵时间的延长,发酵液内的营养物质逐步减少,使得菌开始死亡,且此时解磷菌可能开始同化利用发酵液中的磷为维持生命活动活动所需,所以解磷量有所减少。
2.9 解磷菌JL-1对磷矿粉释放、储存及同化能力的测定
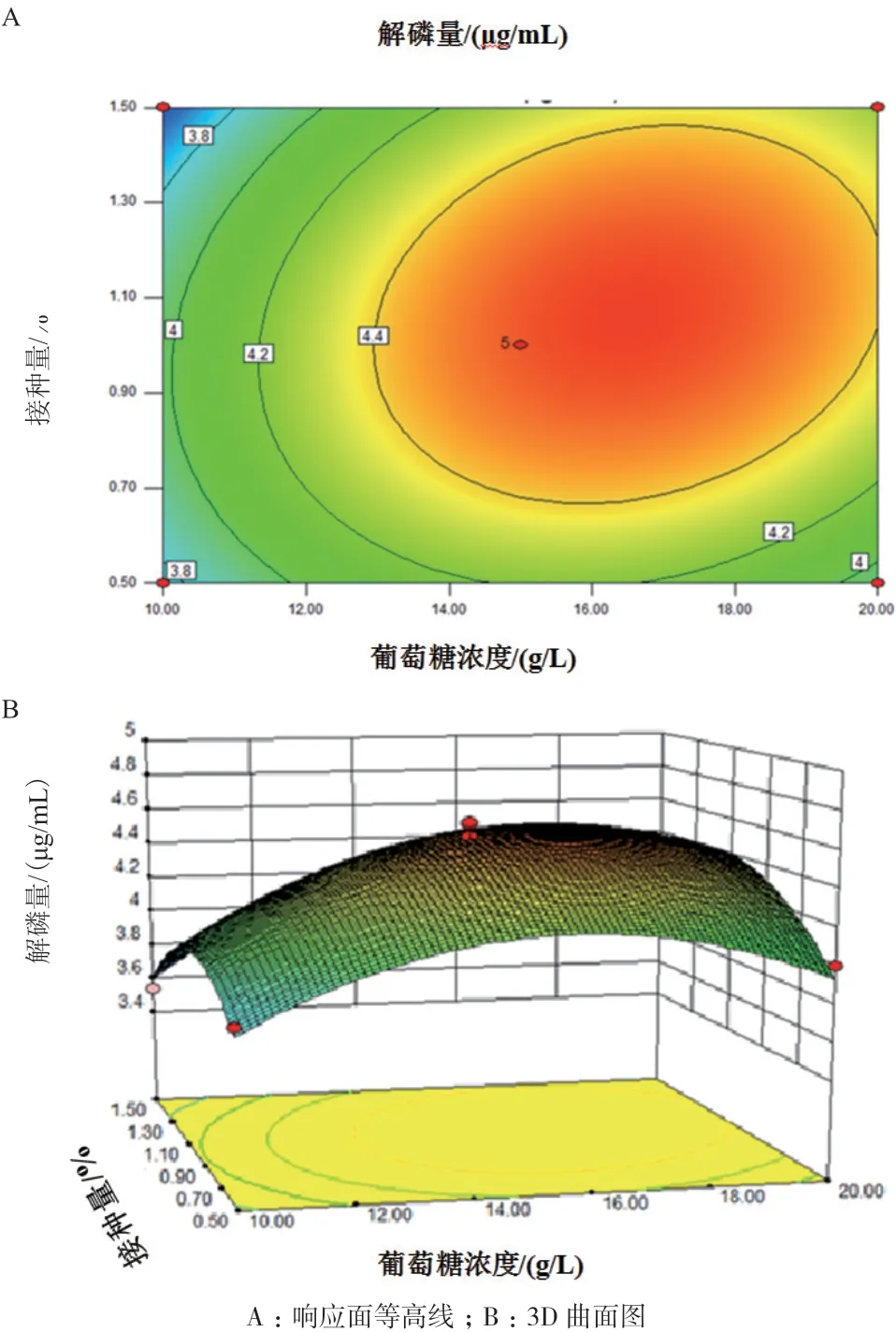
图10 降解参数交互作用对磷矿粉解磷特性的影响
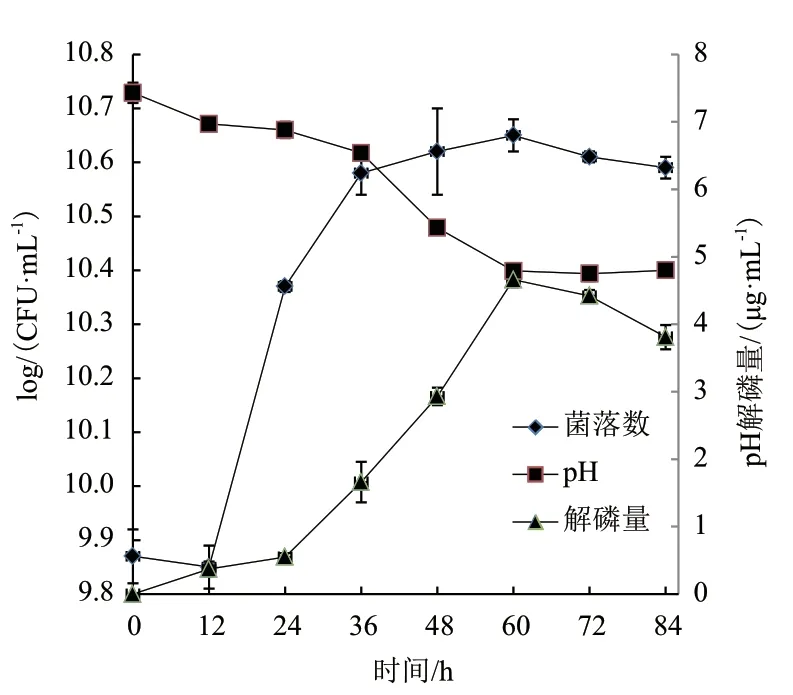
图11 解磷菌降解磷矿粉时间曲线
经过6周的砂土培养,将样品进行浸提、熏蒸、消煮处理后,结果见表4,可以看出3组样品在经过3个处理之后,直接浸提溶磷量最低,为115.33 μgP/g磷矿粉,直接浸提测得的是微生物溶解磷矿粉为有效磷后,直接释放到体外的解量;经过熏蒸处理后的溶磷量为127.54 μgP/g磷矿粉,大于直接浸提的含磷量,这说明解磷细菌在降解磷矿粉的过程中,并不是将所有的磷都是释放到体外,微生物会将一部分磷以可溶性磷酸盐的方式储存在体内,以满足微生物自身生长需要,熏蒸处理过后,细菌的细胞会破碎,储存在细胞体内的磷酸盐会释放出来,因此,熏蒸的含磷量包括直接释放的磷量以及储存在体内的磷量,比直接浸提的高;消煮处理过后的含磷量比熏蒸处理以及直接浸提的要高,为160.09 μgP/g磷矿粉,这说明解磷细菌在溶解磷矿粉的时候除了会释放到体外,以及在细胞内储存一部分外,还有一部分会被微生物同化,参与自身代谢,经过消煮处理后,这部分磷会释放出来,所以消煮处理的溶磷量最高。

表4 三个处理的解磷情况
释放量、储存量及同化量之间的关系见表5,释放量为115.33 μgP/g磷矿粉,占总解磷量的72.08%,可见,解磷菌JL-1溶解磷矿粉后会将大部分的磷直接释放出来;储存量较低,为12.21 μgP/g磷矿粉,占据总解磷量的7.63%,同化量为32.55μgP/g磷矿粉,占总解磷量的20.29%,总解磷量占磷矿粉全磷的0.08%。因此,解磷菌JL-1J将磷矿粉溶解为有效磷时,会将大部分磷直接释放到周围环境,少部分会被微生物同化,参与代谢,极小部分会以可溶性磷酸盐形式储存在体内。

表5 释放量、储存量、同化量的关系
3 讨论
我国磷矿粉资源较为丰富,20世纪四十年代即有施磷矿粉于田间的报道[25],而其中大部分为无效磷,解磷微生物可以活化难溶磷,来提高磷矿粉的田间使用效果,因此测定解磷菌对于磷矿粉的降解性能将更有利于确定该解磷菌的生产应用价值。已发现多种微生物如细菌、真菌、蓝细菌等对磷矿粉有溶解作用[26-30],但尚未见不动杆菌降解磷矿粉的报道,在最优条件下,不动杆菌JL-1在磷矿粉培养基中60 h达最大解磷量为4.65 μg/mL,溶磷率为2.34%,这与已报道的一些溶磷效果较好的细菌的溶磷率接近。如假单胞细菌2VCP1对6种不同磷矿粉的溶磷率为1.0%-2.73%;节细菌1TCRi7的溶磷率为0.55%-2.55%[30];东祁连山高寒草地的解磷细菌欧文氏菌Y2、假单胞杆菌Y3、沙雷氏菌Y4对3种磷矿粉的解磷率最低为0.03%,最高为4.74%,不同磷矿粉组成的差异及菌株代谢特征,如菌株产生的有机酸种类与浓度和体系最终pH值的差异等均可能导致解磷率的不同[31]。因此,该研究一定程度上丰富了降解磷矿粉的解磷菌资源。
对于特定的解磷菌而言,想要发挥其最大的解磷功效,有必要对其解磷条件进行优化,提高其解磷能力,从而促进微生物在磷矿中的应用,这方面的研究已成为开发利用解磷菌过程中的热点。碳源、氮源作为微生物必不可少的能源物质,其种类和浓度会对解磷菌的生长代谢以及溶解磷矿粉的能力产生影响[32]。柯春亮等[23]的研究结果表明,内生沙雷氏菌 M-3-01解磷矿粉能力受到碳源、氮源种类及质量浓度影响明显,降解磷矿粉时的最优碳源为葡萄糖,质量浓度 15 g/L;最优氮源为草酸铵,质量浓度 1.5 g/L。肖春桥等[33]研究巨大芽孢杆菌和多粘芽孢杆菌对磷矿中的磷的浸出能力时发现,碳源葡萄糖和氮源硫酸铵的质量分数在3%时磷的浸出率最高,质量分数过高或过低均抑制了磷的浸出。与上述研究相比,不动杆菌的最优碳源与其一致;最优无机氮源为硫酸铵,与芽孢杆菌的一致,一些研究认为铵态氮是解磷微生物的必须氮源,铵态氮作为氮源时,解磷菌对难溶性磷酸盐的溶解量高于硝态氮[34-35],这与本研究一致,且本研究发现有机氮源和无机氮源复合时,解磷能力高于单一无机氮源的作用,可能是由于有机氮存在时,能进一步促进菌的生长与代谢。虽然不同菌种间的最适氮源和氮源浓度存在差异,但氮源浓度和氮源浓度对菌株解磷矿粉的影响较为一致,都表现为在低浓度范围内,随培养液中质量分数的增加,解磷量增加,这可能是由于培养液中合适的碳氮源浓度有利于解磷菌的生产、代谢,质子和有机酸的产量提高,从而提高解磷量,但当碳源和氮源过量时,可能会提高培养液的渗透压,抑或反馈抑制相关酶的活性,使解磷率降低。
磷矿粉浓度对不动杆菌的解磷能力有一定的影响,实验表明,磷矿粉最优浓度为2 g/L,继续增大磷矿粉的浓度,解磷量基本保持不变,说明菌株对于磷矿粉的降解能力有一定限度,有研究表明,磷矿粉质量浓度达到一定值时,磷矿粉质量浓度与解磷菌菌株的解磷能力呈负相关关系[30],因此在降解磷矿粉时,应根据菌株对磷矿粉的敏感程度,选择适合的磷矿粉的浓度。此外,不动杆菌JL-1的解磷能力还与接菌量、pH、温度等因素相关,接菌量决定了能作用于磷矿粉的微生物数量,最适pH值、温度的确定可为选择磷矿粉施用地的土壤类型、酸碱度、环境温度提供一定的实践指导,在磷矿粉田间最佳施用条件下,巨大芽孢杆菌P17将发挥其最大的解磷功效,从而更有效地改善土壤磷素营养、提高磷矿粉的利用率。
为全面地反映不动杆菌JL-1解磷的实际能力,采用砂培实验,对砂培产物分别进行直接浸提、熏蒸、消煮的方法,依次测定JL-1菌体所释放、储存和同化的磷素,继而得到菌体对磷矿粉的转化能力、效率,及各种磷素形式所占其总解磷量的比例。结果表明菌株溶解磷矿粉后,会释放大部分磷(72.08%),并固定小部分磷(27.92%)。对于不同的微生物而言,释放部分和固定部分所占的比例不尽相同,如东祁连山的4株解磷细菌Y1-Y4对于黄麦岭磷矿粉的释放量占总解磷量的比例为10.16%-51.20%不等[31],皆低于不动杆菌JL-1的释放比例。此外,菌株固定磷的形式也会存在差异,有些细菌会将有效磷同化吸收为有机磷,用于自身的生长代谢,另一些则对分解出来的无机磷酸盐进行吸收,在细胞内贮藏大量的无机磷酸盐,而这两者的相对比例也会有所不同,不动杆菌JL-1对磷的固定主要采取同化的方式,这可能是由不同微生物的遗传特征不同,或是磷矿粉之间存在差异造成的。无论哪种形式,这部分固定的磷在菌体死亡后,大部分都会以有效磷的形式释放到环境中供植物利用,因此,微生物菌体可认为是暂时的磷库。总体看说,不动杆菌JL-1总解磷量占全磷量的比例为0.08%,高于叶震[31]所研究的4种细菌对3种不同磷矿粉的解磷效果,具有较好的应用潜力。
4 结论
不动杆菌JL-1对磷矿粉的降解能力与其遗传特性、生长条件、环境条件密切相关,在最优的解磷矿粉条件下,该菌株具备较好的解磷矿粉性能,砂培实验表明该菌株在解磷矿的过程中可以直接释放大部分磷素、固定少部分磷素。下一步可以在田间进行实验以测定其解磷性能及对于作物增产的作用。此外,探索解磷菌JL-1降解磷矿粉的分子、遗传机制,研究其与其他微生物的相互作用关系,为以后研发环保高效的微生物磷肥奠定一定理论基础。
