来源于Laceyella sp.的α-淀粉酶基因克隆、重组表达及酶学性质研究
2020-08-28赵海燕宋晨斌刘正亚马兴荣尚会会李安华关现军王建设
赵海燕 宋晨斌,2 刘正亚 马兴荣 尚会会 李安华 关现军 王建设
(1. 安阳工学院生物与食品工程学院 安阳市微生物工程重点实验室,安阳 455000;2. 天水师范学院生物工程与技术学院,天水 741001)
淀粉是普遍存在于植物体内,用于植物贮存能量的一种多糖[1]。目前生产淀粉的原料主要是玉米、小麦、薯类、稻谷等作物[2-3]。我国作为农业大国,根据中国农业统计资料显示截止到2017年,上述四类作物的产量已占我国粮食总产量的90%以上[4]。淀粉是以葡萄糖为单位通过α-1,4糖苷键连接的高分子碳水化合物。依据单糖连接方式,淀粉可分为直链淀粉和支链淀粉[5]。淀粉是人类的重要食物来源,也是多种工业生产的原料[6]。淀粉加工工艺主要有酸法、酶酸法、全酶法和双酶法等。其中,酶法在国内外加工淀粉中已广泛应用[7]。α-淀粉酶(EC 3.2.1.1)是指通过水解淀粉分子内部中的α-1,4-糖苷键,将淀粉水解为糊精、单糖、少量麦芽糖和葡萄糖的一类酶[8]。来源于细菌和真菌的α-淀粉酶被广泛应用于食品、生物燃料、造纸、医药、纺织、洗涤剂、动物饲料等行业,占整个酶制剂市场的25%-30%[9-10]。在面团发酵过程中,淀粉酶通过对淀粉的水解作用提高面团的糖含量,进而增大面包的体积,改善色泽[11-12]。在超声波作用下对织物进行酶退浆,不仅可以提高退浆效率,还缩短退浆时间[13]。在生物乙醇的生产过程中,淀粉酶发挥着将原料醪液液化的作用[14]。淀粉酶还可以将含淀粉的食物颗粒水解成小分子的水溶性寡糖,用水冲洗后可去除污渍。当前90%的液体除垢剂中含有α-淀粉酶[15]。将淀粉酶添加到动物饲料中,可有效提高饲料中淀粉的消化率,有利于动物的生长发育[16]。
在不同的应用领域,对淀粉酶性能的要求不同。特别是工业化生产中的高温、低温、高盐、碱性、酸性等苛刻条件制约着淀粉酶产业的发展[17-18]。因此,随着全球资源环境压力的持续增大和绿色合成产业的需求,酶的应用和需求量迅速增加,酶基因资源的挖掘和开发显得非常迫切。目前,热稳定性的α-淀粉酶主要来源于细菌(特别是芽孢杆菌),而放线菌和真菌来源的报道较少[19]。高温放线菌类群是一类能够在极端环境下生长代谢的革兰氏阳性、化能异养菌。微生物学界认为它是介于细菌和放线菌之间的一类微生物。高温放线菌具有代谢产物丰富,很多具有重要的工业价值,其中蛋白酶、淀粉酶、脂酶、纤维素酶等应用广泛[20]。2005年,Yoon等[21]报道高温放线菌-莱斯氏属(Laceyella)。其主要分布于大曲[22-23]、温泉[24]、海洋[25]、土壤[26]、堆肥[27]等。朱国东等[28]从云南腾冲热泉中筛选到一株嗜热放线菌Laceyellasp.RHA1,淀粉酶的最适温度为60℃。来源于Laceyella sacchari5-氨基乙酰丙酸合成酶LS-ALAS不仅具有良好的热稳定性,还有较高的酶活力[29]。研究还发现,高温放线菌Laceyella sacchari有一定的降解纤维素的能力[30]。Singh[31]研究了Laceyella sacchariB42的木聚糖酶活性,其研究表明,最适反应温度和pH分别为9.0和60℃。在60℃处理6 h后还保存90%的活性。Dolashki等[32]研究了Laceyella sacchari酪氨酸酶的性质。Laceyella sacchari嗜热蛋白酶在乳酸乳球菌表达系统中成功表达,且重组酶的热稳定性好,还在pH 6.0-11.0范围内具有较高的活性[33]。来源于Laceyella putida葡聚糖酶LpGluA的最适反应pH和最适反应温度分别为4.2和60℃[34]。Laceyella sacchari亮氨酸脱氢酶Ls-LeuDH也具有较好的热稳定性[25]。在50℃处理72 h时,Laceyella sacchariLP175菌株聚乙丙交酯降解酶的粗酶对PLLA的分解效率达到91%[26]。另外,其还具有高效的生淀粉降解能力,生物乙醇的产量高达90.9 g/L[35]。Laceyellasp. DS3 α-淀粉酶AmyLa最适反应温度和pH分别为55℃和7.0,其固定化酶的最适反应温度没有变化,但是提高了在pH4.0-7.0范围内的酶活性[36-37]。来源于Laceyella sacchariTSI-2的α-淀粉酶在70℃和pH7.0时表现出最高活性,能够高效去除棉布上的淀粉污渍,其固定化酶的稳定性增强[19,38]。四甲基吡嗪作为Laceyella sacchari产生的大量代谢物,还被认为是酱香白酒风味的主体成分之一[23]。因此,积极开展嗜热放线菌Laceyellasp.的相关研究十分重要。
本研究从安阳面粉厂附近土壤里分离筛选产α-淀粉酶的Laceyellasp.菌株,采用同源克隆技术获取α-淀粉酶基因。其次,在大肠杆菌表达系统中进行功能研究。最后,基于同源建模方法的蛋白质三维结构,分析差异氨基酸位点与酶学性质上的差异,为进一步的分子改良提供基础。
1 材料与方法
1.1 材料
1.1.1 样品、菌株及质粒 样品:采集自安阳市面粉厂附近的土壤。
菌株:E.coli Trans1-T1、E.coliBL21(DE3)购自北京全式金生物技术有限公司。
质粒:pET-22b(+)表达载体由本实验室保存。
1.1.2 培养基 固体淀粉筛选培养基(g/L):可溶性淀粉5 g,牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂20 g。
高氏一号培养基(g/L):可溶性淀粉20 g,KNO31 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g,NaCl 0.5 g,FeSO4·7H2O 0.01 g,琼脂20 g。
1.1.3 主要仪器设备 PCR仪:伯乐生命医学产品有限公司;HVE-50高压蒸汽灭菌锅:日本HIRAYAMA公司;SPECOOD S600分光光度计:德国耶拿分析仪器有限公司;HNY-ⅢB摇床:天津欧诺仪器股份有限公司;CF16RN高速离心机:株式会社日立制作所;电泳仪:伯乐生命医学产品(上海)有限公司;ÄKTA蛋白纯化仪:通用电气医疗集团。
1.2 方法
1.2.1 产淀粉酶菌株的筛选及鉴定 取适量土样加入到50 mL无菌水中制成土壤悬液,37℃,180 r/min培养20 min,作为原液。取原液进行梯度稀释,分别取10-4、10-5、10-6的稀释菌悬液100 μL涂布于固体淀粉筛选培养基上,37℃培养12 h。在固体淀粉筛选培养基上滴加碘液,选取能产生无色透明圈的菌落,且透明圈直径与菌落直径之比较大者进行菌株鉴定。
依据细菌基因组提取试剂盒说明书进行提取DNA操作。以细菌通用鉴定引物27F:5'-AGAGTTTGATCCTGGCTCAG-3'、1492R:5'-GGTTACCTTGTTACGACTT-3',扩增菌株的16S rDNA序列。PCR扩增完成后,取适量产物于1%琼脂糖凝胶进行电泳检测,以TAE缓冲液作为电泳缓冲液,电压150 V,20 min。条带大小验证正确后,取PCR扩增产物送至公司测序。在NCBI(https://www.ncbi.nlm.nih.gov/)网站上,选用BLASTn程序对菌株的16S rDNA序列与GenBank数据库进行比对分析。最后,依据LPSN(http://www.bacterio.net/)公布的Laceyellasp.属标准菌株,通过MEGA7.0软件[39]的邻位相连法[40],构建系统发育树。
1.2.2 α-淀粉酶基因AmyL的克隆 以Laceyellasp.DS3(GenBank号:LN901326)基因组序列中的α-淀粉酶基因序列为依据,设计正向引物MF-8-1 F:5'-GAAGTGACCCAGCTACGAGATGAGC-3'以 及反向引物MF-8-1 R:5'-GACCCCAACTATATCAAGC CAGAATTCGG-3',通过PCR扩增得到α-淀粉酶基因AmyL全长。
1.2.3 pET-22b-AmyL重组质粒的构建 以重叠延伸PCR[41](Overlap-PCR)构建重组表达载体。根据α-淀粉酶基因AmyL以及质粒pET-22b(+)的序列设计引物Amy MF-8-1 F1:5'-GGATATCGGAATT AATTCGGATCCGAATTCGCTTTCTCCTGCGGATTGGC AAG-3'、Amy MF-8-1 R1:5'-GTGGTGGTGGTGGTGC TCGAGTTTGGTGAATATCTTTACTTCTTTGGGGC-3'、Amy MF-8-1 F2:5'-GCCCCAAAGAAGTAAAGATAT TCACCAAACTCGAGCACCACCACCACCAC-3'、Amy MF-8-1 R2:5'-CTTGCCAATCCGCAGGAGAAAGCG AATTCGGATCCGAATTAATTCCGATATCC-3'。其中Amy MF-8-1 F1与Amy MF-8-1 R2反 向 互 补,Amy MF-8-1 R1与Amy MF-8-1 F2反向互补。
通过上述引物对基因以及质粒进行PCR扩增,引入同源臂。再以质粒扩增产物为模板、基因扩增产物为大引物,两者按照质量比为1∶10构建反应体系进行PCR扩增,吸取部分PCR产物进行琼脂糖凝胶电泳检测。将经由PCR扩增后构建成功的重组表达载体命名为pET22b-AmyL,并转化至E.coli Trans1-T1,同时选取菌液PCR验证正确的单克隆进行测序验证。
1.2.4 重组α-淀粉酶AmyL的表达及纯化 将测序正确的重组表达载体转化到E.coliBL21(DE3)中表达,然后以1%的接菌量转接于200 mL LB液体培养基(氨苄霉素浓度:100 μg/mL)中,37℃、180 r/min培养2 h至OD600达到0.6-0.8之间,加入400 μL 0.5 mol/L IPTG,30℃、180 r/min诱导4 h。
通过ÄKTA蛋白纯化系统纯化胞内总蛋白溶液[42]:(1)将胞内总蛋白溶液经0.22 μm滤膜过滤;(2)用结合缓冲液平衡层析柱;(3)取经过滤膜过滤的样品上样;(4)用洗脱缓冲液进行线性洗脱;(5)收集洗脱峰进行酶活性的测定。对纯化后的蛋白质进行SDS-PAGE以及HPLC-MS/MS质谱分析鉴定。
1.2.5 重组α-淀粉酶AmyL活性测定及性质研究 采用二硝基水杨酸(DNS)法[43]进行α-淀粉酶的酶活力测定。将900 μL 1%淀粉酶底物在45℃预热5 min,加入100 μL稀释的酶液反应10 min后,用DNS溶液终止反应,沸水浴5 min。反应液冷却至室温后,测定540 nm的吸光值。淀粉酶的酶活单位定义为:在最适温度和最适pH下,每毫升反应体系每分钟分解淀粉生成1 μmol还原糖所需的酶量为一个酶活单位。
1.2.5.1 最适反应温度的测定 在pH6.0反应体系下,分别测定温度在25-60℃时的酶活力,反应时间为10 min。酶活力最高点即为酶的最适反应温度,同时计算不同温度下的相对酶活力。
1.2.5.2 最适反应pH的测定 在45℃反应条件下,以柠檬酸缓冲液和磷酸缓冲液配制,分别测定pH为4.8、5.2、5.6、6.0、6.4、6.8、7.2、7.6、8.0时的酶活力,反应时间为10 min。酶活力最高点即为酶的最适反应pH,同时计算其他pH下的相对酶活力。
1.2.5.3 温度稳定性的测定 取适当酶液,分别放置在40、45、50、60℃下水浴保温10、20、30、50 min,测定残余的酶活力,以未处理的酶液作对照,计算处理不同时间后残余的相对酶活力。
1.2.5.4 pH稳定性的测定 取适当酶液在温度为45℃下,分 别 在pH为5.0、6.0、7.0、8.0、9.0、10.0下保温1 h后,以未处理的酶液作对照,测定不同pH下处理后残余的相对酶活力。
1.2.5.5 酶促反应动力学研究 以经过蛋白质纯化后的目的蛋白,对淀粉酶的动力学参数进行测定。配制不同浓度的淀粉底物,基于淀粉酶的最适反应温度、最适反应pH,测定酶的活力,同时测定蛋白浓度,计算出酶的比活力。比活力定义:每毫克酶蛋白所含的酶活力单位。以1/[S]为横坐标,1/比活为纵坐标,作Lineweaver-Burk双倒数图[44]。
1.2.5.6 金属离子及化学试剂对酶活力的影响 在酶学性质测定反应体系中加入终浓度分别为1、5和10 mmol/L的不同离子及化学试剂,测定酶活力,以不加化学试剂的反应体系作为对照。探究不同金属离子及化学试剂对淀粉酶活力的影响。
1.2.5.7 底物特异性研究 将可溶性淀粉、支链淀粉、马铃薯淀粉、普鲁兰多糖、α-环糊精、β-环糊精、γ-环糊精等底物分别溶解于0.1 mmol/L pH 6.0的柠檬酸-磷酸氢二钠缓冲溶液,终浓度为 5 mg/mL。加入适当稀释倍数的重组淀粉酶AmyL,在45℃下反应10 min。以可溶性淀粉为底物时的酶活力为100%,分别计算其他底物的相对酶活力。
1.2.6 重组酶的同源建模 从PDB数据库中检索与AmyL序列相似且功能已知的α-淀粉酶,以来源于Anoxybacillus的α-淀粉酶(PDB ID号:5A2B;序列一致性:56%)为模板,利用 Discovery Studio 2018软件对淀粉酶AmyL进行三维结构的建模。然后使用相关模块对构建好的模型进行能量最小化和结构优化,并采用Ramanchandran Plot和Profile-3D评估模型。Deepview软件也应用于部分结构功能分析。
2 结果
2.1 产淀粉酶菌株的筛选及鉴定
土壤样品经稀释涂布后,在固体淀粉筛选培养基上,选取具有较大透明圈的菌落作为候选菌株。在多次分离、纯化的基础上,获得目的菌株,编号为MF-8-1。菌株MF-8-1在固体淀粉筛选培养基上的菌落特征为纯白色、干燥、多皱、边缘不规则,能产生明显的透明圈。
提取MF-8-1的基因组,利用引物27F和1492R扩增其16S rDNA序列后进行测序。经序列比对后发现其与Laceyellasp.属的16S rDNA序列(GenBank号:EU430566.1)的一致性最高,序列相似性为99%。依据高温放线菌科及Laceyellasp.属的不同种16S rDNA序列,构建系统发育树(图1)。结果表明MF-8-1与Laceyella sediminis(GenBank号:FJ422144)的进化距离最小。
2.2 α-淀粉酶基因AmyL的克隆及序列分析
以MF-8-1基因组DNA为模板,MF-8-1 F、MF-8-1 R为引物,在KOD-Plus-Neo高保真聚合酶的作用下,扩增出一条2.2 Kb左右的片段,与预期DNA片段大小符合。测序结果表明该基因全长为1467 bp,编码488个氨基酸和一个终止密码子,将该基因命名为AmyL。利用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)对AmyL编 码 蛋 白 进行信号肽预测。结果表明AmyL编码蛋白具有一个由35个氨基酸残基组成的信号肽,剪切位点介于Leu35和Ser36之间。

图1 菌株MF-8-1的16S rDNA系统发育树
2.3 重组α-淀粉酶AmyL的诱导表达及纯化
将构建的重组表达载体转化到BL21,通过PCR方法验证,获得重组表达菌株。经IPTG诱导后,重组菌的细胞破碎液具有很高的淀粉酶活性,而空白对照无法检测出淀粉酶活性。同时,对培养两种重组菌的上清液进行淀粉酶活性的检测后,结果显示上清液均无活性,表明淀粉酶基因AmyL在周质中表达。

图2 重组α-淀粉酶AmyL的SDS-PAGE分析
对重组菌的胞内总蛋白进行蛋白纯化,并对纯化后蛋白进行SDS-PAGE电泳检测。结果表明AmyL基因在E.coliBL21(DE3)中得到了较好的表达(图2),在55 kD附近出现了较为明显的条带,且与预期大小相符。经质谱鉴定,有32个肽段与理论上的肽段相匹配,其肽段覆盖率为73%,说明重组子表达的蛋白质为AmyL。
2.4 重组α-淀粉酶AmyL的酶学性质
2.4.1 重组α-淀粉酶AmyL的最适反应温度及温度稳定性 重组α-淀粉酶AmyL的最适反应温度为45℃,在40-50℃下可保持较高酶活力,在60℃下酶活力全部损失(图3)。在40-50℃下,酶的稳定性较好,保温50 min后酶活力仍能维持在80%左右。但在60℃下处理50 min后,酶活力全部损失(图4)。

图3 温度对重组α-淀粉酶AmyL酶活力的影响

图4 重组α-淀粉酶AmyL的温度稳定性
2.4.2 重组α-淀粉酶AmyL的最适反应pH及pH稳定性 重组α-淀粉酶AmyL的最适反应pH值为6.0,在pH 5.6-6.8下具有较高的酶活性,其相对酶活在80%以上。pH<5.6后,酶活力急剧下降。在pH 4.8、8.0处,酶活力完全损失(图5)。在pH 6.0-10.0时,酶活力均无下降且有些许上升,说明该酶能耐受偏碱性环境(图6)。

图5 pH对重组α-淀粉酶AmyL酶活力的影响
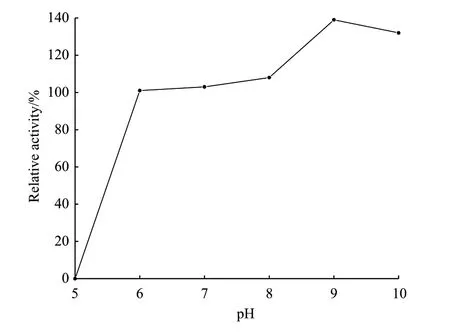
图6 重组α-淀粉酶AmyL的pH稳定性
2.4.3 重组α-淀粉酶AmyL的动力学参数 以0.1、0.4、0.7、1.0、2.0、3.0和5.0 mg/mL浓 度 的可溶性淀粉作底物,测定酶的活力;做Lineweaver-Burk双倒数图(图7),数据分析后得出酶的比活、Km和Vmax分别为185.39 U/mg、0.95 mg/mL、343.12 μmol/(min·mg)。进一步计算得出,AmyL的Kcat为315.28 s-1,催化效率Kcat/Km为331.13 mL/(s·mg)。

图7 重组α-淀粉酶AmyL的Lineweaver-Burk双倒数图
2.4.4 金属离子及化学试剂对重组α-淀粉酶AmyL的影响 以未加化学试剂的反应体系作为对照,得到不同浓度的金属离子及化学试剂对重组酶活力的影响如表1所示。当体系中Na+、K+、Ca2+浓度达到10 mmol/L浓度时,对酶活力有一定的保护作用,而较低浓度下会使酶活力损失;Mn2+、Mg2+、EDTA对重组α-淀粉酶AmyL均存在抑制作用,但Mn2+的抑制作用比Mg2+、EDTA略强;SDS对重组α-淀粉酶AmyL具有强抑制作用,即使只有1 mmol/L,也能使酶活力全部丧失,说明重组α-淀粉酶AmyL对SDS敏感。
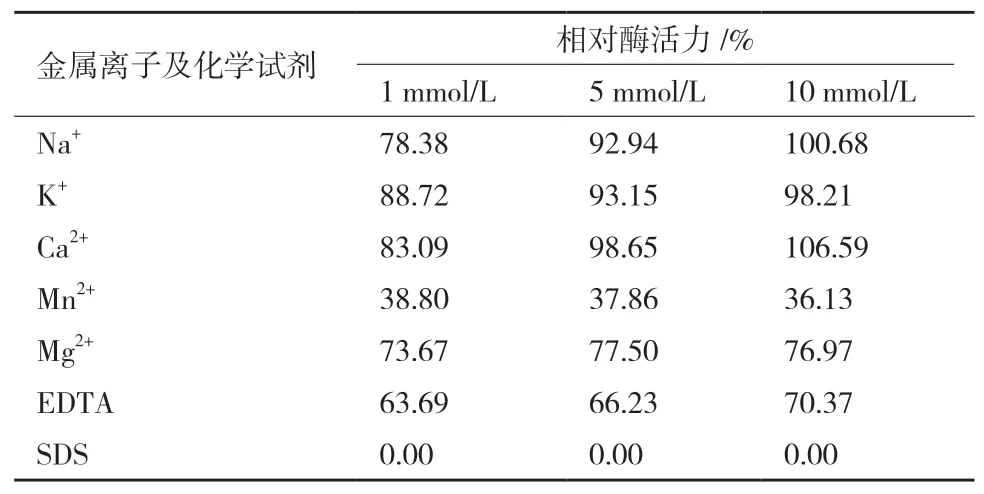
表1 金属离子及化学试剂对酶活力的影响
2.4.5 重组α-淀粉酶AmyL的底物特异性 重组α-淀粉酶AmyL不仅可以高效地催化可溶性淀粉的水解,对其他底物也表现出较高的水解活性。将重组α-淀粉酶AmyL对可溶性淀粉的酶活定义为100%时,AmyL对于支链淀粉和马铃薯淀粉的相对酶活力分别为180.3%和111.6%,对β-环糊精和普鲁兰多糖的相对酶活力分别为2.5%和0.8%,而以α-环糊精和γ-环糊精为底物时,未检测到活性。
2.5 α-淀粉酶AmyL同源建模及结构分析
AmyL与 来 源 于Laceyella sacchari的α-淀 粉酶(TCW41560)的序列一致性为99%,与晶体结构已知的Anoxybacillusα-淀粉酶5A2B的一致性为56%。以5A2B作为模板,对AmyL进行同源建模。从结构上可以看出(图8),AmyL由3个结构域组成,即结构域A、B、C。结构域A由8个α-螺旋和8个β-折叠交替组成的TIM桶构成;结构域B是TIM桶的第3个α-螺旋和β-折叠之间形成的不规则β-like结构;结构域C由位于蛋白质C端的8个反平行β-折叠以及一些无规则卷曲构成。通过分析发现,结构域A的β3、β4、β5和β7折叠C端附近存在GH13家族的4个CSR:CSR I(152DVVANH157)、CSR II(228DGLRVDTVKHVPKWFWREF246)、CSR III(256GEVFHG261)和CSR IV(317FIDNHD322)。

图8 AmyL的三维结构
3 讨论
淀粉酶广泛存在于动植物及微生物中,其中微生物来源的淀粉酶具有各种不同的性质,在淀粉酶的开发研究中具有相当重要的地位。国内外报道产淀粉酶的微生物[29-35]主要有:枯草芽孢杆菌(Bacillus subtilis)[45]、地衣芽孢杆菌(Bacillus licheniformis)[46]、蜡状芽孢杆菌(Bacillus cereus)[47]、巨大芽孢杆菌(Bacillus megaterium)[48]、多粘类芽孢杆菌(Bacillus polymyxa)[49]、高温放线菌(Thermoactinomyces)[50]等。
本研究根据Laceyellasp.DS3基因组序列中的α-淀粉酶基因序列,采用同源克隆从Laceyellasp.中克隆出α-淀粉酶基因AmyL并在大肠杆菌中表达。其最适反应温度为45℃,最适反应pH值为6.0,高浓度的Na+、K+、Ca2+能提高该淀粉酶的稳定性。朱国东等[28]从云南腾冲热泉中筛选到一株嗜热放线菌Laceyellasp.RHA1,经过硫酸铵沉淀和分子筛层析,获得低分子量的淀粉酶(11.2 kD)。其最适温度为60℃,最适pH值为6.0,Ca2+能够提高野生酶的最适反应温度。Lomthong等[35]利用发酵条件优化方法,研究了Laceyella sacchariLP175的分解酶对木薯生淀粉的降解能力;且生物乙醇的产量高达90.9 g/L(理论产量的88%)。来源于温泉的Laceyella sacchariTSI-2α-淀粉酶的最适反应温度为70℃,在37-100℃都具有酶活性,100℃处理1 h还保留70%以上的活性。其最适反应pH值为7.0,在pH 4.0-9.0内有酶活性;在pH 4.0条件下处理3 h,还保留60%以上的相对酶活力;在pH9.0条件下处理6 h,还保留70%以上的相对酶活力;固定化酶提高了在有机溶剂中的稳定性;表面活性剂还可提高相对酶活力;能够高效去除棉布上的淀粉污渍[19,38]。嗜热微生物Thermomyces dupontiiL18的TdAmy A的最适反应温度和pH值分别为50℃和6.5[51]。
Laceyellasp.DS3的α-淀粉酶的野生酶的最适温度为50℃,在E.coli中表达的重组AmyLa最适温度为55℃,最适pH为7.0;游离酶在pH3-5时的相对酶活力小于20%,在pH 6-7时的相对酶活力在80%以上;而固定化酶在pH3-8时相对酶活力保持在80%以上[36-37]。本研究的AmyL与α-淀粉酶AmyLa以及来源于Thermoactinomyces的α-淀粉酶AmyTV1[52]的酶学性质存在较大差异(表2)。但通过氨基酸序列比对发现三者的序列一致性极高,只存在4个位点的差异,分别是261、342、361、420位氨基酸。
为了从分子层面探究其酶学性质产生差异的原因,通过Discovery Studio 2018软件构建了AmyL、AmyLa、AmyTV1的三维结构,发现三者的整体三维结构基本保持一致,其中261、361位点位于结构域A的α-螺旋上、342位点位于结构域A的loop结构上、420位点位于结构域C的反平行β-折叠上(图8)。以AmyL作为参照,利用Deepview软件分析AmyLa、AmyTV1在上述4个氨基酸位点的氢键数目变化。结果显示,当361位氨基酸由组氨酸(AmyL)变 为 酪 氨 酸(AmyLa、AmyTV1)时,Tyr361与Thr365之间会形成一个新的氢键,该位点的氢键由4个变为5个。在蛋白质内部形成一个氢键所获得平均能量约为0.6 kcal/mol[53]。Suvd等[54]通过比较来源于嗜中温微生物Bacillus licheniformis的α-淀粉酶(Bacillus licheniformisα-amylase,BLA)以及来源于嗜热微生物Bacillus stearothermophilus的α-淀粉酶(Bacillus stearothermophilusα-amylase,BSTA)的 结构发现,BSTA较BLA在三维结构上增加了9个氢键,使得BSTA获得了更好的热稳定性。因此,氢键数量是重组酶AmyL的最适反应温度低于AmyLa、AmyTV1的最适反应温度的因素之一。此外,α-淀粉酶AmyL具有典型的(α/β)8桶状结构(TIM桶),该结构是α-淀粉酶具有催化活性的关键因素[55]。α-淀粉酶AmyL的361位点位于TIM桶的第8个α-螺旋C端上,氢键数量的增加使其在折叠成螺旋结构时易产生较大的构象张力[56],进而引起熵变的增加使得AmyL的最适温度较AmyLa、AmyTV1有所下降。因此,361位点对AmyL的最适反应温度及最适反应pH具有重要影响。

表2 α-淀粉酶AmyL、AmyLa、AmyTV1的最适反应温度及pH比较
4 结论
本研究从安阳面粉厂附近土壤中筛选到一株具有淀粉酶活性的菌株,经过分子生物学鉴定,确定为Laceyellasp.。将其α-淀粉酶基因克隆,并在E.coliBL21(DE3)中成功表达。α-淀粉酶基因AmyL全长1 467 bp,编码488个氨基酸和一个终止密码子,在Leu35和Ser36之间存在信号肽酶切割位点。重组酶AmyL的最适反应温度为45℃,最适反应pH值为6.0,在温度为40-50℃、pH值为6.0-10.0的范围内具有较稳定的酶活力,其Km和Vmax分别为0.95 mg/mL和343.12 μmol/(min·mg),高 浓 度 的Na+、K+、Ca2+对重组酶AmyL酶活力有保护作用。
