DCE-CT鉴别诊断胃异位胰腺和间质瘤的价值
2020-08-28陈馨陈晓刘永康王雅杰崔灿王中秋
陈馨,陈晓,刘永康,王雅杰,崔灿,王中秋
异位胰腺(heterotopicpancreas,HP)又称迷走胰腺、胰腺异位或副胰腺,是指在胰腺正常解剖位置以外生长且与正常胰腺组织无解剖及血管联系,拥有独立的血液供应和神经支配的孤立的胰腺组织[1]。异位胰腺是一种较少见的先天性发育异常的肿瘤样病变[2]。由于缺乏特异的临床表现,过去多由内镜检查或尸检时偶然发现,发现率为0.5%~3.7%[3],可发生于胃肠道任何部位,其中以胃、十二指肠、空肠黏膜下最多见。此外,在回肠、胆囊、胆管、脾脏、网膜及迈克尔憩室等全身多个部位均有异位胰腺的报道[4]。胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是最常见的胃肠道间叶源性肿瘤,且具有潜在恶性倾向[5]。据文献报道,50%~70%的GIST发生于胃部,占胃部肿瘤的1%~4%[6]。胃部异位胰腺和间质瘤均为黏膜下实体病变,患者的临床表现均无特异性,且两者的影像学表现有一定重叠。由于异位胰腺的发病率相对较低,导致在临床诊断中对其误诊率较高。异位胰腺与间质瘤在管理原则、治疗手段及预后等方面均有较大的差异。胃肠道间质瘤具有恶变潜能,一旦发现即需要手术干预[7]。异位胰腺则是胰腺组织解剖位置异常的一种先天变异,临床上更倾向于定期随访观察[8]。尽管近年来对异位胰腺的报道增多,但对胃部的异位胰腺及间质瘤的鉴别诊断依然有一定难度,也较少有研究总结胃部这两种疾病的临床特征及影像学表现。本文回顾性分析17例胃部异位胰腺和40例胃部间质瘤的临床及动态增强CT(DCE-CT)表现,评估DCE-CT对这两种病变的鉴别诊断价值,旨在提高对异位胰腺的诊断准确性。
材料与方法
1.病例资料
搜集本院2014年7月-2019年4月经手术病理证实的17例胃异位胰腺患者及40例胃间质瘤患者的病例资料。17例异位胰腺患者中女6例,男11例,年龄29~73岁,平均(50.1±11.5)岁;40例胃间质瘤患者中女23例,男24例,年龄46~81岁,平均(59.7±8.2)岁。主要临床症状:胃异位胰腺患者中,腹部不适5例,腹痛3例,腹痛伴呕吐1例,反酸嗳气1例,腹痛、腹胀1例,黑便1例,腹痛伴反酸2例,3例为体检发现;胃间质瘤患者中,腹胀7例,腹痛、腹胀5例,腹痛8例,腹部不适3例,腹痛伴进食哽咽感2例,腹痛、腹胀伴反酸2例,黑便2例,呕血1例,消瘦伴大便性状改变1例,9例无明显不适。
2.检查方法
使用Philips Brilliance 64排128层螺旋CT扫描仪,所有患行CT平扫及三期增强扫描。检查前患者禁食4 h,扫描前嘱患者口服500~1000 mL水充盈胃腔。扫描参数:120 kV,160~251 mA,层厚3.5 mm,层隔3.5 mm,螺距0.8,0.5 s/r,扫描范围自膈顶至耻骨联合水平。CT增强扫描使用非离子型对比剂碘海醇,总量为80~100 mL。延迟时间:动脉期35~40 s,门脉期75~80 s,延迟期175~180 s。
3.图像分析
所有患者的图像资料由两位具有丰富腹部影像诊断经验的高年资医师进行回顾性分析,意见一致时通过协商达成一致意见。分析并记录病灶的位置、大小、钙化、形态、边界、囊实性、密度、生长方式、包膜连续性强化、有无“导管征”等特征。 此外,分别测量两组中病灶及正常胰腺各期扫描的CT值。病灶位置分为胃体、胃窦和胃底。测量病灶的长径(long diameter,LD)和短径(short diameter,SD),并计算两者的比值(LD/SD)。病灶形态分为卵圆形、类圆形和不规则形。将生长方式分为外生性、内生性及混合性。外生性生长指病灶仅突向胃壁外,内生性生长定义为病灶仅凸向胃腔内,混合性生长指病灶同时侵犯胃腔内及胃壁外。CT值测量时在肿瘤实质部分勾画感兴趣区,尽量避开肿瘤的囊性及钙化部分。测量患者腰5水平腰大肌在各期增强图像上的CT值,计算病灶的相对CT值(病灶CT值/腰大肌CT值)。计算病灶的动脉期强化程度(degree of on enhancement in arterial phase,DEAP)及静脉期强化程度(degree of on enhancement in portal venous phase,DEPP):
DEAP=病灶动脉期CT值-病灶平扫期CT值
(1)
DEPP=病灶门脉期CT值-病灶平扫期CT值
(2)
4.统计学分析
使用SPSS 24.0软件进行统计学分析。计量资料以均值±标准差表示,组间比较采用独立样本t检验;计数数据的组间比较采用卡方检验或Fisher精确检验。采用Logistic回归分析筛选可用于异位胰腺与间质瘤鉴别诊断的临床及影像指标。采用受试者工作特征曲线(receiver operating characteristic,ROC)评估影像指标的诊断价值,计算曲线下面积(AUC)及敏感度、特异度。以P<0.05为差异具有统计学意义。
结 果
1.临床资料分析
两组患者基本临床资料的比较见表1。胃间质瘤患者的发病年龄大于异位胰腺患者,两组间差异具有统计学意义(P=0.001)。间质瘤组中以女性患者较多见(57.9%),两组间性别构成的差异具有统计学意义(P=0.024)。两组患者临床症状间的差异无统计学意义(P>0.05)。

表1 两组的基本临床资料及影像学特点的比较
2.影像学分析
本研究中间质瘤及异位胰腺均为单发病灶,两组患者影像学表现的比较见表1。胃间质瘤多呈类圆形(52.5%),多位于胃底部(67.5%),多呈内生性生长(47.5%)及混合性生长(45.0%)方式(图1)。异位胰腺病灶多呈卵圆形(47.1%),发病部位多位于胃窦部(70.6%),且多为内生性生长(76.5%)(图2);两组间发病部位的差异有统计学意义(P<0.001)。
异位胰腺及间质瘤在病灶边界、强化模式、病灶成分等方面的差异均具有统计学意义(P<0.05)。而两组间胃黏膜的连续性强化及病灶钙化这2个影像特征的差异无统计学差异(P>0.05)。典型的异位胰腺病灶内可见细管状扩张的结构,称“导管征”,该征象可作为诊断异位胰腺的特异性征象。本研究中17例异位胰腺患者中有9例(52.9%)出现此征象(图3)。
异位胰腺与间质瘤之间长径及短径的差异均无统计学意义(P>0.05)。但两组间LD/SD的差异有统计学意义(P=0.015)。
两组病变在CT平扫及三期增强扫描图像上的相对CT值及组间比较结果见表2。两组病变间平扫及延迟期相对CT值的差异无统计学意义(P>0.05);两组病变间动脉期和静脉期的相对CT值、DEAP及DEPP的差异均具有统计学意义(P<0.05)。
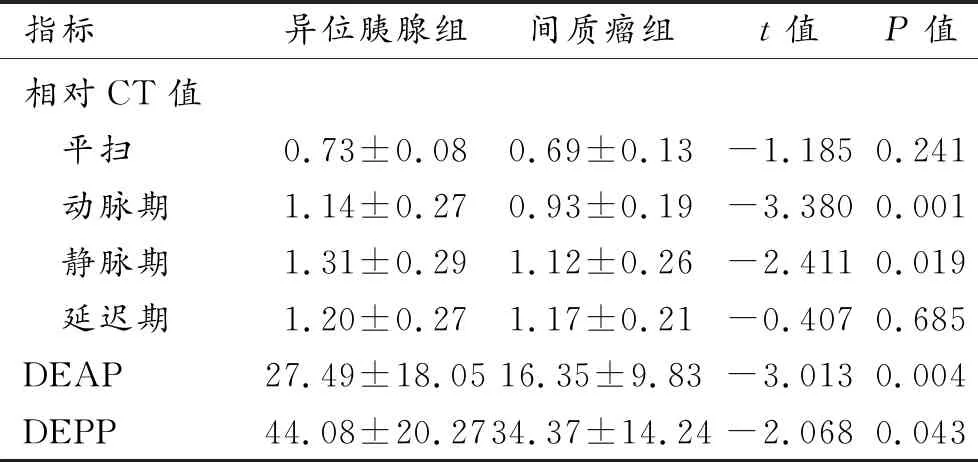
表2 平扫及三期增强扫描时两组病变CT值的比较
3.二元多因素logistic回归分析
ROC曲线分析显示,以LD/SD>1.30作为异位胰腺与间质瘤的鉴别诊断阈值时,敏感度为81.3%,特异度为60.9%,曲线下面积为0.762(图4)。
Logistic回归分析显示年龄、囊实性病灶、LD/SD、发病部位(胃窦/胃底+胃体)是独立鉴别指标。联合这些指标进行ROC曲线分析时,其ROC曲线下面积为0.941,诊断敏感度和特异度分别为100%和88.2%(图5)。
讨 论
异位胰腺是一种先天性胰腺迷走畸形,其发生的确切机制目前尚不清楚。多数学者认为是由于胚胎时期的胰腺原基与原肠粘连或穿透原肠壁,并随原肠的旋转及纵行生长而分布于各个异常部位;也有学者认为本病是内胚层异向分化所致[9]。异位胰腺可发生于消化道的任何部位,最常见于胃、十二指肠、Meckel憩室及空肠等处,也有位于胆囊、纵隔、膀胱和肠系膜等少见部位的报道[10]。病理学上按照修改后的Heinrich分型HP可分为4型:Ⅰ型,与正常胰腺结构相似,由腺泡、胰管和胰岛细胞组成并出现在非正常部位;Ⅱ型,仅由胰管构成;Ⅲ型,主要由腺泡组织构成(外分泌型);Ⅳ型,主要由胰岛细胞构成(内分泌型)[3]。间质瘤(Stromal tumor)是最常见的胃肠道间叶源性肿瘤,除了常发生于胃部以外,还可发生于小肠、结直肠、食管及其它部位[11]。胃部异位胰腺及间质瘤均为胃肠道壁的隆起性病变,可发生于胃壁黏膜下各层,且二者均可引起腹痛、腹胀、胃部不适等非特异性临床症状。但两者的临床处理手段却大不相同。间质瘤具有潜在侵袭性,其恶变的风险随瘤体大小的增加而增高[12-13],临床上对其采用早期发现早期切除的原则。而异位胰腺则是一种正常组织的异位性病变,恶变率极低,对于无明显症状及并发症的异位胰腺患者,临床上倾向于定期随访监测。因此,术前准确鉴别两种病变对患者治疗方式的选择具有重要意义。
文献报道异位胰腺好发于40~60岁男性,而胃间质瘤好发于40岁以上中老年人[14]。Li等[15]研究显示异位胰腺患者的发病年龄低于间质瘤患者(41.22 vs. 59.18岁,P<0.001)。本研究中胃异位胰腺也好发于男性,(占64.7%),平均年龄为(50.12±11.54)岁,显著低于间质瘤患者的平均年龄[(59.70±8.18)岁]。本研究的结果与文献报道一致。
Jang等[16]研究认为与异位胰腺相比,其它黏膜下病变更倾向于呈类圆形的形态(6.7% vs. 46.2%,P=0.021)。而本研究中并未观察到类似结果。笔者认为造成这种差异的原因可能与患者入组标准不同及胃腔充盈状态不一致密切相关。本研究中异位胰腺好发于胃窦部,而间质瘤则以胃底部多发(67.5%),与Kim等[1]研究报道一致。两组病变均以内生性生长方式为主,两组间病灶生长方式的差异无统计学意义,也与Kim等[1]及Li等[15]报道的结果基本一致。而魏赟等[17]认为异位胰腺的病灶多向腔内生长,而间质瘤多为腔内外混合性生长。对病变生长方式的评估与胃的充盈程度有一定相关性,不同的胃腔充盈程度可能会影响对此征象的准确评估。
本研究中显示间质瘤的边界较异位胰腺病灶更为清晰,该结论与Li等[15]及Wei等[18]的报道基本一致。有学者认为异位胰腺边界不清是由于其具有分泌功能,所分泌的胰液可腐蚀邻近胃黏膜,导致黏膜发生炎症,甚至出血[19]。也有学者提出异位胰腺的边界不清与其内部含有腺泡成分相关,当腺泡组织分布于病灶的周边时,病灶表现出边界不清的征象[15]。
间质瘤具有非定向分化和潜在恶性分化倾向,且常伴溃疡、出血和坏死,易导致邻近的胃黏膜不连续[20]。本研究中,增强扫描时7例(41.2%)异位胰腺及20例(50.0%)间质瘤可见邻近胃黏膜呈连续性强化,两组间此征象的差异无统计学意义(P>0.05),与魏赟等[17]报道的结果不相符。笔者推测可能与本研究中纳入的间质瘤病灶均偏小有关。
“导管征”主要表现为异位胰腺病灶内呈细管状无强化的囊性成分,病理提示其主要为明显囊状扩张的导管构成,部分病灶内含有少许腺泡成分[19]。本研究中17例异位胰腺中有9例(52.9%)在增强扫描及多平面重组(multiplanar reformation,MPR)图像上可见“导管征”,此征象在异位胰腺及间质瘤的鉴别诊断中具有重要意义。
胃间质瘤体积较小时多呈均匀的等或稍低密度,增强扫描时强化较均质;随着体积增大,肿瘤内部发生坏死、液化的概率增加,增强扫描时多呈不均匀强化,病灶内可见无强化的液化坏死区[20]。本研究中47.1%的异位胰腺病灶呈均匀强化,75%的间质瘤病灶呈均匀强化,两组间差异有统计学意义(P<0.05)。本研究中间质瘤的强化较均质可能与所纳入的病灶体积均较小(平均长径约21.56mm)相关。
Kim等[1]指出当病灶的LD/SD>1.4时更偏向于为异位胰腺,这可能与两种病变的组织胚胎学特点相关。胃异位胰腺不是真正的肿瘤,而是异位的伴有胰腺腺泡形成及导管发育的扁平腺体组织,故其更倾向于呈扁圆形外观。本研究结果显示当LD/SD>1.3时,诊断效能最高,与文献报道较为接近。
本研究中采用Logistic回归分析筛选出囊实性、年龄、LD/SD和位置(胃窦/胃底+胃体)等指标可用于两种病变的鉴别。联合这些指标建立的模型具有良好的鉴别诊断价值,其ROC曲线下面积为0.941,具有较高的诊断敏感度(100%)和特异度(88.2%)。
由于胃部异位胰腺患者大多无明显临床表现,多数缺乏影像学资料,且在影像学诊断中易受到胃部充盈状态的影响,故本研究中此组患者的样本量偏小。另外,本研究为回顾性分析,仅纳入胃部病变而排除了其它部位异位胰腺及间质瘤患者,存在一定的选择偏倚。MR成像具有较高的软组织分辨率且可进行多方向成像,对胃充盈状态的要求稍低,能较好地显示和观察病灶的形态[21]。此外,MR成像对于异位胰腺和间质瘤的鉴别诊断具有重要价值,异位胰腺在T1WI上与正常胰腺组织的信号特点相似,呈等或稍高信号,“导管征”在T2WI上显示更加清晰,呈细管状高信号;而较小的间质瘤病灶内部较均质,在T1WI上呈稍低信号。
总之,增强CT扫描图像中,胃异位胰腺病灶多发于胃窦部,具有内生性生长、卵圆形、可见“导管征”和不均匀明显强化等特点;胃间质瘤则多发于胃底及胃体部,具有以内生性生长及混合性生长、类圆形、以实性为主和明显均匀强化等特点。联合多个影像学特征,如囊实性、LD/SD比值、位置及临床指标可用于两种病变的鉴别。
