阔叶杨桐衍生胎座的发育特征(五列木科)
2020-08-26张瑞菊周长路史冬燕何启平尚宏芹
张瑞菊 周长路 史冬燕 何启平 尚宏芹
摘 要:为观察五列木科阔叶杨桐子房中衍生胎座的发育过程,探明衍生胎座与心皮源胎座及特立中央胎座的关系,该研究采用扫描电子显微镜和体视显微镜相结合的方法,详细观察了阔叶杨桐的花芽和成熟果实。花芽采集后经FAA固定、酒精-乙酸异戊酯梯度脱水、液体CO2干燥、扫描电子显微镜下观察;将成熟果实直接在体视显微镜下解剖观察。结果表明:阔叶杨桐花芽发育过程中,雄蕊原基发生后,5心皮快速发生,先愈合形成上部具有中轴胎座、下部是空腔的子房;接着心皮上长出胎座(心皮源胎座),在其下部空腔内与心皮相对的位置,花托頂端出现多个凸起,并逐渐愈合成半球形的衍生胎座,心皮源胎座和衍生胎座上出现多枚可育胚珠。成熟果实中,心皮源胎座和衍生胎座上均有种子,二者之间没有维管束联系。因此,衍生胎座与心皮源胎座独立发生,且晚于心皮源胎座;阔叶杨桐衍生胎座的发育过程不同于石竹科和商陆科的特立中央胎座(中轴胎座隔膜消失形成),而与杜鹃花目报春花科、假轮叶科、杜茎山科和紫金牛科的特立中央胎座类似(在花托顶端直接形成)。
关键词:阔叶杨桐,五列木科,衍生胎座,特立中央胎座,扫描电镜
中图分类号:Q944
文献标识码:A
文章编号:1000-3142(2020)07-0901-08
Abstract:In order to reveal the developmental process of the deuterogenic placenta of Adinandra latifolia from the family Pentaphylacaceae,and the relationship between deuterogenic placenta,carpellary placenta and free central placenta, the flower buds and mature fruits of A. latifolia were observed in detail by scanning electron microscope (SEM) and stereoscopic microscope. Floral buds at different stages of development were collected and fixed in formalin-aceticacid-alcohol, and then dehydrated through an ethanol/amylacetate series,critical point dried with CO2,Au/Pt sputter coated,prepared samples were examined with SEM. Mature fruits were dissected under a stereoscopic microscope directly without preparation. The results showed that during the floral development,5 carpel primordia were growth rapidly after the stamens initiation,and then ovary was combined with the axial placenta on the upper part and cavity on the bottom part. After the placenta grew on the carpels (named carpellary placenta),several mounds appear at the top of the receptacle within the position opposite to the carpel in the lower cavity. The mounds combined gradually into a hemispherical deuterogenic placentation. And some fertile ovules appeared on the surface of both the carpellary placenta and deuterogenic placenta. Finally,in mature fruits the fertile ovules turn to seeds on both types of placenta in which vascular bundles are discrete. Therefore,deuterogenic placenta appeared independently and was later than the carpellary placenta. The development of deuterogenic placenta in A. latifolia was different from that of the free central placenta in both Caryophyllaceae and Phytolaccaceae (the axial placenta turned into a free central placenta by the septa disappear),but it is basically identical to that of Primulaceae,Theophrastaceae,Maesaceae,Myrsinaceae from Ericales (the free central placenta formed on top of the receptacle directly).
Key words:Adinandra latifolia,Pentaphylacaceae,deuterogenic placenta,free central placenta,SEM
阔叶杨桐(Adinandra latifolia)原隶属于杜鹃花目(Ericales)山茶科(Theaceae)杨桐属植物(林来官,1998),在APG III分类系统(APG,2009)中被划分到五列木科(Pentaphylacaceae)。其主要分布于云南贡山的山地密林和沟边疏林中,对维持中国南方森林生态系统的稳定性有一定作用,是人工造林中常用到的乡土树种之一,也是南方常见的庭院观赏植物(张瑞菊,2011)。阔叶杨桐为乔木,一年生枝条、顶芽、叶片、叶柄及整个子房均密生黄褐色柔毛。花期6月—7月,花单生于当年生枝条的叶腋内,稀2 朵,萼片5枚紫色宿存,覆瓦状排列;花瓣5枚浅紫色,基部相互愈合;雄蕊30~35枚,花丝基部与花瓣愈合,花谢时雄蕊与花瓣同时脱落;子房由5~6心皮组成,胚珠多枚,花柱单一,柱头不裂;果期9月—10 月,成熟时为紫色浆果;种子肾形,褐色有光泽(林来官,1998;张瑞菊等,2008)。
目前,对阔叶杨桐的研究较少,除《中国植物志》外,只能查阅到阔叶杨桐花器官发生(张瑞菊等,2008)、种子萌发(张瑞菊,2011)、花粉离体萌发(张瑞菊,2017)3篇文献。张瑞菊等(2008)研究发现阔叶杨桐的子房结构比较特殊,其子房上部为5心皮形成的中轴胎座,在子房下部则为5心皮围成的一个空腔,空腔内花托顶端有一衍生胎座,这种特殊胎座与五列木科其他植物的中柱胎座不同。阔叶杨桐两部分胎座的胚珠均可以受精发育成种子,种子都能萌发(张瑞菊,2011)。但是,阔叶杨桐子房中衍生胎座的发育过程至今未见报道。利用掃描电子显微镜观察花器官发生和发育过程,能更准确地掌握其发育过程的动态变化,为研究花的结构和被子植物演化提供更加可靠的证据。通过查阅杜鹃花目利用扫描电镜研究有关心皮和胎座发生的文献,发现其胎座发生大致分为两种类型:一种类型是中轴胎座,多心皮愈合形成中轴,多室有隔膜,如山茶科(Teaceae)(Tsou,1998)、凤仙花科(Balsaminaceae)(Pieter et al.,2006)、福桂花科(Fouquieriaceae)(Schonenberger & Grenhagen,2005)、五列木科(张瑞菊和Schonenberger,2014)等;另一种类型为特立中央胎座,雄蕊出现后,花顶先发生环形雌蕊原基,并逐渐向上扩展形成子房,在环形原基中间发生一团组织形成中央胎座,如杜茎山科(Maesaceae)(Caris et al.,2000;Grainger & Becker,2001)、紫金牛科(Myrsinaceae)(Ma & Saunders,2003)、报春花科(Primulaceae)和假轮叶科(Theophrastaceae)(Pieterl & Erik,2004)等。阔叶杨桐心皮源胎座属于前一种类型,而衍生胎座是否属于后一种类型还有待于进一步研究。
在植物学界对植物起源和演化一直存在各种理论和假说,如Lam(1950)把被子植物中的孢子分为两种类型,即轴生孢子和叶生孢子。生长在心皮上的孢子是叶生孢子,生长在花轴上的孢子称为轴生孢子。这两种类型的孢子代表了被子植物两种不同的起源类型,表明被子植物是二元起源的。对应于心皮的本质,植物学界一直存在两种截然不同的观点:一种观点认为心皮相当于一个叶片;另一种观点认为心皮相当于一个变态枝,即真花学说和假花学说,前者占主导地位。近年来,王鑫(2015)提出了另外一种理论,即一统理论,认为传统意义上的“心皮”不是一个独立不可分的植物器官,而是由不可育的子房壁和可育的胎座(长胚珠的枝)共同组成的复合器官,并利用该理论合理地解释了植物界多种类型子房形成的过程。按照以上观点,阔叶杨桐同一子房中存在心皮源胎座和衍生胎座的现象。为了解释这种现象,本研究拟借助扫描电镜和体视显微镜,对阔叶杨桐的花芽和果实进行详细观察,探明衍生胎座的发生发育过程,与杜鹃花目和其他植物类群的胎座类型相比较,并试图利用心皮和孢子起源的假说解释衍生胎座的归属,为今后研究衍生胎座出现的分子机制提供参考。
1 材料与方法
1.1 花发育材料及处理
4月初至7月期间,在昆明植物园采集阔叶杨桐的花芽,经FAA固定48 h后,先转入70%酒精处理2~5 h,再转入90%酒精脱水过夜,在体视显微镜下解剖,暴露所要观察的部分。剥离后的材料经100%酒精、乙醇-乙酸异戊酯体积比1∶3、2∶2、3∶1、100%乙酸异戊酯5个梯度系列脱水,每个处理30 min,经CO2临界点干燥、粘台、喷金,在Hitachi s-800扫描电镜(日本产)下观察并拍照。
1.2 成熟果实结构观察
9月—10月份采集成熟果实,在体视显微镜下观察两部分胎座及其种子的发育状况。
2 结果与分析
2.1 阔叶杨桐的胎座发育过程
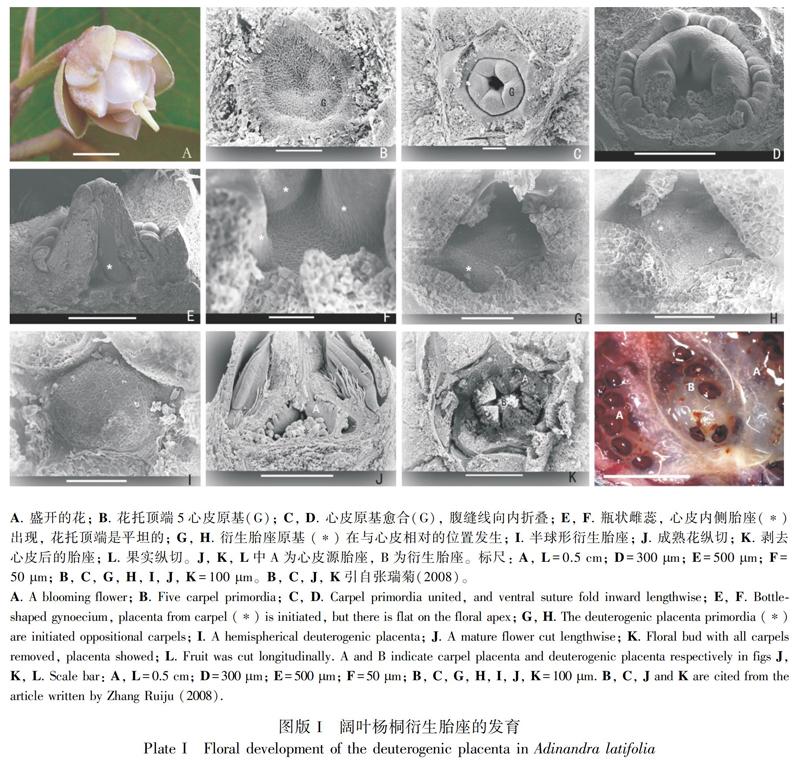
2.1.1 心皮发生 阔叶杨桐的花发育时,先以2/5螺旋顺时针或逆时针先后出现5个萼片原基和5个花瓣原基。当第5片花瓣原基出现时,花托顶端(5个花瓣的中间)区域呈平的五角形(图版I:A)。随着花的发育,花托顶端区域几乎同时出现5个扇形的心皮原基,同时其周围也出现一个环形雄蕊原基(图版I:B)。随着心皮原基的生长,其基部沿腹缝线逐渐愈合(图版I:C);当环形原基上逐渐出现雄蕊原基时,心皮愈合程度增加,背缝线处向内折叠(图版I:D,E),此时5心皮中间的花托顶端是平坦的(图版I:E)。
2.1.2 胎座发生 当雄蕊原基发育成指形凸起时,5心皮几乎全部愈合形成圆锥形子房,此时心皮腹缝线处的组织形成胎座,且与子房壁局部分离处形成凹陷,此时子房底部中央仍然为平的多边形(图版I:F)。随着雄蕊原基的生长及花药花丝的分化,在子房底部与心皮相对的位置出现多个凸起(图版I:G,H),这些凸起逐渐愈合成一个半球形衍生胎座(图版I:I)。当子房壁上长出纤毛时,来源心皮的胎座和衍生胎座上均生长有多个胚珠,且两部分胚珠的大小基本一致(图版I:J,K)。在成熟子房中,上半部分是5心皮愈合形成的中柱胎座结构,下半部分无中柱,形成5心皮胎座围绕着衍生胎座的特殊复合胎座结构(图版I:J,K)。两部分胎座从形成到长出胚珠始终是分离的,没有维管束联系。
2.2 闊叶杨桐成熟果实的观察
阔叶杨桐成熟果实为紫黑色浆果,果肉浅紫红色,种子肾型红褐色具光泽(图版I:L)。同一果实中,心皮源胎座上胚珠发育成种子的比率高于衍生胎座。相邻2心皮的腹缝线从上到下完全愈合,形成隔膜,组成封闭的子房室,5心皮共形成5室,上部有中柱,下部不形成中柱,衍生胎座始终独立存在于5子房室之间的空隙中(图版I:L),不与周围组织形成维管联系。
3 讨论
3.1 阔叶杨桐子房发育的特殊性
在APG分类系统(2009,2016)中,五列木科共有植物约340种、12个属,被划分为3个族,即Pentaphylaceae,Ternstroemieae和Freziereae。Pentaphylaceae仅包括1个属,即五列木属(Pentaphylax);Ternstroemieae包括2个属即厚皮香属(Ternstroemia)和茶梨属(Anneslea);Freziereae包含其余的9个属。中国共分布有7属,即五列木属、茶梨属、厚皮香属、杨桐属(Adinandra)、红淡比属(Cleyera)、柃木属(Eurya)和猪血木属(Euryodendron)(张瑞菊和 Schonenberger,2014)。五列木科都为中轴胎座(郑勉和闵天禄,1980;张瑞菊等,2006,2007,2008,2014),且中柱贯穿整个子房。从阔叶杨桐子房发育过程的电镜扫描图片来看,其与五列木科其他属的子房结构明显不同。其子房发育具有以下特点:(1)快速发生5心皮,基部愈合形成子房;(2)在5心皮围成的空腔基部出现衍生胎座;(3)子房上部形成中柱,下部没有中柱出现;(4)心皮胎座和衍生胎座上都能形成正常胚珠;(5)心皮胎座的发生早于衍生胎座。阔叶杨桐的子房虽然具有特殊结构,但其他性状与五列木科植物的基本一致,如萼片和花瓣的发生都是2/5螺旋向心连续发生,花被片基部稍愈合;雄蕊原基是2/5螺旋发生;雄蕊发育早期呈现5束(张瑞菊,2006)。由此可见,阔叶杨桐的衍生胎座是五列木科的变异类型。
3.2 阔叶杨桐衍生胎座与特立中央胎座的关系
特立中央胎座是多室复子房的隔膜消失后,胚珠着生在由中轴残留的中央短柱周围,中央短柱可以是心皮基部向子房中央伸长形成(马炜梁等,2009)。随着扫描电镜的应用,对特立中央胎座形成过程的观察越来越详细,有关报道主要集中在石竹目和杜鹃花目 。
石竹目特立中央胎座的研究主要集中在商陆科(Phytolaccaceae)和石竹科(Caryophyllaceae)。商陆科特立中央胎座形成过程在雄蕊发生后,花托顶端为半球形结构,多心皮在半球形的边缘发生,且基部愈合逐渐形成多室子房,早期为中轴胎座,后来隔膜消失而转化为特立中央胎座(陈丹和王青锋,2004;郑宏春等,2004,2018)。从文献中的扫描图片可以看出,红蕊商陆(Phytolacca esculenta)的胚珠不是来源于心皮,而是从花托顶端半球形组织上与心皮相对的位置分化出来的(郑宏春等,2018)。同样,石竹科植物繁缕(Stellaria media)和马齿苋(Portulaca oleracea)的胎座在个体发育早期也为中轴胎座类型,至成熟时隔膜消失才变成特立中央胎座,其子房发育过程与商陆科基本相同(刘雪飞,2009)。很显然,阔叶杨桐的衍生胎座是由花托顶端组织直接发育而成,根本没有隔膜出现,不属于这种类型。
杜鹃花目特立中央胎座的发育具有高度一致性,其研究主要集中在报春花科、假轮叶科(Pieterl & Erik,2004)、杜茎山科(Caris et al.,2000;Grainger & Becker,2001)、紫金牛科(Myrsinaceae)(Ma & Saunders,2003)等。Eames(1961)提出报春类多数植物子房发育中都没有隔膜出现,这一观点被Pieterl & Erik(2004)所证实,后者对假轮叶科(Theophrastaceae)4属6种和报春花科(Primulaceae)水茴草属(Samolus)1种植物的雌蕊发育过程进行了详细报道。其发育过程基本一致,即当雄蕊原基发生后,在花顶中间位置,先形成环形的雌蕊原基,然后生长成瓶状子房,子房中间空腔内逐渐出现锥形胎座且由顶向基发生胚珠,形成特立中央胎座,心皮与胎座之间始终没有隔膜出现(Pieterl & Erik,2004)。特立中央胎座的这种发育模式在杜茎山科杜茎山属(Maesa)(Caris et al.,2000; Grainger & Becker,2001;Ma & Saunders,2003)、紫金牛科羊角木属(Aegiceras)和酸藤子属(Embelia)(Ma & Saunders,2003)同样存在,都没有隔膜出现,且胎座是从花顶直接凸起形成多心皮1室的特立中央胎座,与心皮之间无维管束联系。阔叶杨桐的衍生胎座是在平坦的花托顶端先由几个小突起扩大愈合形成半球状,由于受到周围组织的挤压变成五棱锥形,胚珠着生在胎座的表面。由此可见,阔叶杨桐的衍生胎座直接发生于花托顶端,明显不同于商陆科和石竹科的特立中央胎座,与杜鹃花目植物的特立中央胎座类似,整个发育过程始终没有隔膜出现,心皮与胎座没有维管束联系。但是,阔叶杨桐衍生胎座形成早期是在与心皮相对的位置先形成几个凸起,然后才形成一个特立中央胎座,而上述4个科中特立中央胎座是直接在花顶形成的,二者存在一定区别。
3.3 阔叶杨桐衍生胎座在雌蕊起源和演化中的理论解释
阔叶杨桐子房中心皮源胎座和衍生胎座上都有胚珠发生,二者都可育,种子都能正常萌发(张瑞菊,2011)。根据Lam(1950)的观点,生长在心皮上的孢子为叶生孢子,生长在花轴上的孢子是轴生孢子,这两类孢子代表了被子植物两种不同的起源类型。阔叶杨桐心皮源胎座上的孢子是叶性的,衍生胎座的孢子是花顶组织直接发育而成,与心皮没有维管联系,应该属于轴生孢子。在同一个子房中叶生孢子和轴生孢子同时存在,与Lam(1950)的被子植物二元起源的理论相矛盾,同样真花学说和假花学说也很难解释这种现象。王鑫(2015)的一统理论认为心皮由两部分组成,即一个相当于叶的片状结构和一个长胚珠的胎座。根据统一理论的观点,笔者认为阔叶杨桐心皮的片状结构组成子房壁,在片状结构上有心皮源胎座,在花顶部分片状结构没有发生而只有胎座出现形成衍生胎座,这样解释避免了关于心皮是变态叶还是变态枝的争端。
4 前景与展望
植物发育要受到基因的控制,花发育的基因假说由最初的ABC模型发展为ABCDE模型和四因子模型。阔叶杨桐子房发育的基因调控机制是下一步研究的方向。
被子植物两性花一般排列5轮,由外往内依次是花萼、花瓣、雄蕊、心皮和胚珠,其发育受到ABCDE五类花器官决定基因的控制,CE两组基因决定心皮,DE两组基因决定胚珠(孟雨婷等,2017)。五类花器官决定基因,在拟南芥中C类功能基因为AG(AGAMOUS)、SPT、CRC;D类基因是STK、SHP1、SHP2;E类基因为SEP1、SEP2、SEP3和SEP4,其中决定心皮和胚珠发育的是SEP3(孟雨婷等,2017)。
ABCDE五类花器官功能基因均编码转录因子,其控制的同源异形蛋白形成5种不同的四聚体转录因子复合物来决定花器官的发育。如决定心皮发育的四聚体复合物为AG-AG-SEP-SEP,决定胚珠形成的是AG-STK-STK-SEP。ABCDE五类基因中,任何基因发生突变,都会影响相应四聚体复合物的变化,从而影响花器官的发育。如C组基因发生突变,花变成花萼、花瓣、花瓣、花萼、花萼的5轮结构(景丹龙等,2018)。D组基因STK、SHP1、SHP2单独或同时发生突变,第5轮胚珠将部分转变成叶状或心皮状结构。当E组基因发生突变时,5轮花器官都会受到影响。SEP1、SEP2、SEP3发生三重突变时,5轮器官全部为花萼,没有心皮和胚珠。在sep1、sep2和sep4纯合突变、sep3杂合突变的花中,花萼和花瓣异常,雄蕊畸形,心皮内有胚珠,且其内仍包含心皮和雄蕊(丛楠等,2007)。
影响CDE三类基因表达的因素都会造成心皮和胚珠的发育异常。如WUS(WUSCHEL)基因编码的转录因子可促进茎端分生组织SAM中干细胞库的增加(吴笑女等,2009),CLV基因(CLV1,CLV2,CLV3)与WUS之间形成一个反馈通道,二者共同控制SAM干细胞数量的稳定和茎端分生组织的大小。此外,CRN(COPYNE)基因还参与干细胞调控,当CLV1,CLV2,CLV3和CRN的任何基因突变时,都会促进WUS表达,造成拟南芥SAM和花分生组织中干细胞增多,出现顶端、花和其他器官膨大(Muller et al.,2008)。WUS的缺失影响心皮决定基因AG的表达,因此wus-1突变体缺失心皮(李梅等,2017)。WUS的负调控因子ULTRAPETALA1(ULT1)的突变体ult1各轮花器官增多,且雌蕊中部有未分化的组织(Carles et al.,2004)。另外,与雌蕊发育相关的调控基因还有KNOX Ⅰ和KNOX Ⅱ两类,KNOX Ⅰ包括STM、BP、KNAT2和KNAT6四个基因,其中STM与KNAT2基因协同作用启动心皮的发育。拟南芥心皮发育基因突变体ms1522和突变体clv1-1均出现第5轮雌蕊(雌蕊内部还有较小的雌蕊),其比例在80%以上,后来证明ms1522和clv1-1互为等位突变体(成志鹏,2012)。
阔叶杨桐的花与ABCDE五类基因的突变型不同,与拟南芥突变体wus-1、ult1、ms1522、clv1-1也不同。ABCDE五类基因突变使5轮花器官的排列不同,但仍然是5轮结构。拟南芥ms1522和clv1-1两种突变体不仅使心皮数目增多,而且还使花器官轮数增多。阔叶杨桐的花萼、花瓣、雄蕊、心皮和胚珠均表现正常,只是多了第6轮結构即衍生胎座。阔叶杨桐胎座形成时,心皮先出现,然后在心皮的近轴面直接形成胎座,第6轮衍生胎座发生比心皮胎座发育的晚,按照花器官向心发育的顺序,越靠近中心发育越晚。衍生胎座刚发生时,在与心皮相对应的位置先出现凸起,然后愈合成半球形。衍生胎座最早的凸起与心皮相对且数目相同,因此阔叶杨桐的衍生胎座形成可能是CLV基因发生突变,产生第6轮雌蕊,也可能受WUS及相关基因的负调控作用,使第6轮心皮发育没有启动,而胚珠发育的D类基因表达未受到影响,因而没有心皮出现,胎座在原心皮相对的位置发生而生长在花托顶端,从而形成第六轮衍生胎座。由于心皮和胚珠发育受多种因素的影响,阔叶杨桐衍生胎座出现的机制需要今后通过分子方面的研究来证实。
参考文献:
APG,2009. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants:APG III[J]. Bot J Linn Soc,161:105-121.
APG,2016. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants:APG IV[J]. Bot J Linn Soc,181:1-20.
CARIS P,DECRAENE LPR,SMETS E,et al.,2000. Floral development of three Maesa species,with special emphasis on the position of the genus within Primulales[J]. Ann Bot,86:87-97.
CARLES CC,LERTPIRIYAPONG K,REVILLE K,et al.,2004. The ULTRAPETALAI gene functions early inArabidopsis development to restrict shoot apical meristem activity and acts through WUSCHEL to regulate floral meristem determinacy[J]. Genetics,167(4):1893-1903.
CHEN D,WANG QF,2004. Pentamerous flowers in the genus Phytolacca have been derived from trimerous flowers—New evidence from the floral organogenesis of Phytolacca dodecandra[J]. Acta Phytotax Sin,42(4):345-351.[陈丹,王青锋,2004. 商陆属中五基数花起源于三基数花的新证据—非洲商陆的花器官发生[J]. 植物分类学报,42(4): 345-351.]
CHENG ZP,2012. Function analysis of MS1522 gene involved in Arabidopsis carpel development and genetic mapping of Arabidopsis male sterile mutant ems1227[D]. Shanghai:Shanghai Normal University.[成志鹏,2012. 拟南芥心皮发育基因MS1522的功能分析及雄性不育突变体ems1227的基因定位[D]. 上海:上海师范大学.]
CONG N,CHENG ZJ,WAN JM,2007. The ABCDE model of floral organ development[J]. Chin Agric Sci Bull,23(7):124-128.[丛楠,程治军,万建民,2007. 控制花器官发育的ABCDE模型[J]. 中国农学通报,23(7):124-128.]
EAMES AJ,1961. Morphology of the angiosperms[M]. New York:Mc Graw-Hill:185-289.
GRAINGER J,BECKER P,2001. Sexual dimorphism and functional dioecy in Maesa perlarius and M. japonica (Maesaceae/Myrsinaceae)[J]. Biotropica,33(2):368-374.
JING DL,GUO QG,CHEN WW,et al.,2018. Model evolution and molecular mechanism of angiosperm flower development[J]. Plant Physiol J,54(3):355-362.[景丹龍,郭启高,陈薇薇,等,2018. 被子植物花器官发育的模型演变和分子调控[J]. 植物生理学报,54(3):355-362.]
LAM HJ,1950. Stachyospory and phylospory as factors in the natural system of the cormophyta[J]. Svensk Botanisk Tidsrift,44 (4):517-534.
LI M,CHEN LB,TIAN YP,et al.,2017.Digital gene expression analysis of tea flowers without pistil at three development stages[J]. J Tea Sci,37(1):97-107.[李梅,陈林波,田易萍,等,2017. 雌蕊缺失茶树花3个发育期的数字基因表达谱分析[J]. 茶叶科学,37(1):97-107.]
LIN LG,1998. Floral Reipublicae Popularis Sinicae (50th volume 1st fascicule)[M]. Beijing:Science Press:1-68.[林来官,1998. 中国植物志 (50卷1分册)[M]. 北京:科学出版社:1-68.]
LIU XF,2009. Morphological study on the early floral development of 10 species in Caryophyllidae[D]. Xian:Shaanxi Normal University:13-42.[刘雪飞,2009. 石竹亚纲(Caryophyllidae)10种植物花发育形态学研究[D]. 西安:陕西师范大学:13-42.]
MA OSW,SAUNDERS RMK,2003. Comparative floral ontogeny of Maesa (Maesaceae),Aegiceras (Myrsinaceae) and Embelia (Myrsinaceae):Taxonomic and phylogenetic implications[J]. Plant Sys Evol,243:39-58.
MA WL,WANG YF,LI HQ,2009. Botany[M]. Beijing:Higher Education Press:242.[馬炜梁,王幼芳,李宏庆,2009. 植物学[M]. 北京:高等教育出版社:242.]
MENG YT,HUANG XC,HOU YT,et al.,2017.The floral morphology and the ABCDE model of floral organ development[J]. J Biol,34(6):105-107.[孟雨婷,黄晓晨,侯元同,等,2017. 花的形态与花发育的ABCDE模型[J]. 生物学杂志,34(6):105-107.]
MULLER R,BLECKMANN A,SIMON R,2008. The receptor kinase CORYNE of Arabidopsis transmits the stem cell-limiting signal CLAVATA3 independently of clavata1[J]. Plant Cell,20:934-946.
PIETERL,CARIS KP,GEUTEN SBJ,et al.,2006. Floral development in three species of Impatiens (Balsaminaceae)[J]. Am J Bot,93:1-14.
PIETER LC,ERIK FS,2004. Afloral ontogenetic study on the sister group relationship between the genus Samolus (Primulaceae) and the Theophrastsceae[J]. Am J Bot,91(5):627-643.
SCHONENBERGER J,GRENHAGEN A,2005. Early floral development and androecium organization in Fouquieriaceae (Ericales)[J]. Plant Syst Evol,254:233-249.
TSOU CH,1998. Early floral development of Camellioideae (Theaceae)[J]. Am J Bot,85:1531-1547.
WANG X,LIU ZJ,LIU WZ,et al.,2015. Breaking the stasis of current plant systematics[J]. Sci Technol Rev,33(22):97-105.[王鑫,刘仲健,刘文哲,等,2015. 突破当代植物系统学的困境[J]. 科技导报,33(22):97-105.]
WU XN,XU QJ,2009. Floral organ development and the function gene activity mode in angiosperms[J]. Plant Physiol Comm,45(1):89-96.[吳笑女,徐启江,2009. 被子植物的花器官发育和功能基因活性模式的建立[J]. 植物生理学通讯,45(1):89-96.]
ZHANG RJ,2006. Early floral development of Ternstroemiaceae and its systematic implications[D]. Kunming:Yunnan University: 2-60.[张瑞菊,2006. 厚皮香科植物的花器官发生及其系统学意义[D]. 昆明:云南大学:2-60.]
ZHANG RJ,2011. Effect of exogenous growth regulators on seed germination Adinandra latifolia (Theaceae)[J]. Seed,30(2):49-5.[张瑞菊,2011. 外源生长调节物质对阔叶杨桐种子萌发的影响[J]. 种子, 30(2):49-5.]
ZHANG RJ,2017. Characteristics of pollen germination and pollen tube growth of Adinandra latifolia in vitro[J]. Seed,36(7):40-44.[张瑞菊,2017. 阔叶杨桐花粉离体萌发和花粉管生长特性的研究[J]. 种子, 36(7):40-44.]
ZHANG RJ,SCHONENBERGER J,2014. Early floral deve-lopmnt of Pentaphylacaceae (Ericales) and its systematic implications[J]. Plant Sys Evol,300:1547-1560.
ZHANG RJ,MA HY,WANG YH,2007. Early floral development of endangered Euryodendron excelsum (Ternstroemioideae:Theaceae)[J]. Acta Bot Yunnan,29(6):648-654.[张瑞菊,马海英,王跃华,2007. 山茶科濒危植物猪血木的花器官发生[J]. 云南植物研究,29(6):648-654.]
ZHANG RJ,MA HY,WANG YH,2008. Early floral development of Adinandra latifolia (Ternstroemioideae:Theaceae)[J]. Guihaia,28(2):160-163.[张瑞菊,马海英,王跃华,2008. 阔叶杨桐的花器官发生[J]. 广西植物,28(2): 160-163.]
ZHENG HC,LU AM,HU ZH,2004. Floral organogenesis in Phytolacca (Phytolaccaceae)[J]. Acta Phytotax Sin,42(4):352-364.[郑宏春,路安民,胡正海,2004. 商陆属植物的花器官发生[J]. 植物分类学报,42(4):352-364.]
ZHENG HC,TUO XH,MA CL,et al.,2018. Observation on flower organs initiation process of 2 species of Phytolacca[J]. Acta Bot Boreal-Occident Sin,38(5):858-866.[郑宏春,拓向辉,马春兰,等,2018. 商陆属2种植物花器官发生过程观察[J]. 西北植物学报,38(5):858-866.]
ZHENG M,MIN TL,1980. Floral Reipublicae Popularis Sinicae (45th volume 1st fascicule)[M]. Beijing:Science Press:135.[郑勉,闵天禄,1980. 中国植物志(45卷1分册)[M]. 北京:科学出版社:135.]
(责任编辑 蒋巧媛)
