钾离子通道与骨肉瘤研究进展*
2020-08-26吴进陈云萍陈志达
吴进,陈云萍,陈志达
363000 福建 漳州,联勤保障部队第909医院暨厦门大学附属东南医院 骨科(吴进、陈志达);362000 福建 泉州,联勤保障部队第910医院 肿瘤科(陈云萍)
骨肉瘤是青少年最常见的恶性骨肿瘤,严重影响青少年生命健康[1]。即使采用外科手术联合新辅助化疗的标准治疗方案,患者预后已进入相对稳定的停滞期:无肺转移患者 5 年生存率仅为 65%,发生肺转移患者预后更差[2-3]。因此深入研究与骨肉瘤发生、发展和治疗相关的分子机制,是骨肉瘤目前研究最为关注的疑难问题,也是突破骨肉瘤生存预后瓶颈的关键。
钾离子通道是迄今为止发现的分布最广、亚型最多、作用最复杂的一类蛋白分子。它们广泛存在于各组织的细胞膜表面,在所有可兴奋性和非可兴奋性细胞的重要信号传导过程中扮演着重要的角色。此外,其家族成员在调节神经递质释放、心率、胰岛素分泌、神经细胞分泌、上皮细胞电传导、骨骼肌收缩及细胞容积等过程中发挥了重要作用。近年来研究表明,钾离子通道不仅参与离子转运、维持细胞膜电位、细胞间信号传递等生理活动,而且与包括骨肉瘤在内的多种肿瘤发生、发展密切相关,提示该通道可能成为潜在的肿瘤诊断标志和治疗靶点[4]。由此,骨肉瘤细胞膜上钾离子通道的研究成为热点之一。
1 钾离子通道结构和分类
1.1 钾离子通道结构
包含6个跨膜的α螺旋(功能区段,分别命名为S1-S6区)、一个保守的离子选择性的离子区P-domian(P区)以及留在胞浆内的自由氨基(N)末端和自由羧基(C)末端,是由4个重复亚基连接在一起的多肽组成(图1)。

图1 钾离子通道的结构示意图
1.2 钾离子通道分类
根据拓扑结构,可将钾离子通道划分为四大类:
1.2.1 电压门控型离子通道(voltage-gated potassium channel,Kv) 主要由α亚基超家族和β辅助亚基两部分组成的复合体[5],具有6个跨膜结构和1个孔区,是成员最多的钾离子通道家族。一直以来没有一个全面准确的Kv通道分类方法。研究者们曾经广泛使用跨膜结构域和KCN分类法,但都存在一定的缺陷。较新的分类方法根据通道蛋白的种系和发生特点,可将Kv家族分为三类12个亚族[6](图2)。
1.2.2 钙激活型钾离子通道(Ca2+activated potassium channel,BK) 与Kv通道的组成类似,也是由α亚基超家族和β辅助亚基两部分组成。α亚基超家族相应位点的突变能改变膜上钙激活的钾电流,因此BK通道又被称为dSlo。
1.2.3 内向整流型钾离子通道(inwardly rectifying potassium channel,Kir) 具有2个跨膜段和1个孔区的钾离子通道亚型,因其内向电流显著大于外向电流而得名。ATP敏感型钾离子通道 (adenosine triphosphate-sensitive potassium channel,KATP) 在结构及电生理特点属于Kir,其本质即为Kir和磺脲酸受体共同组装而成。
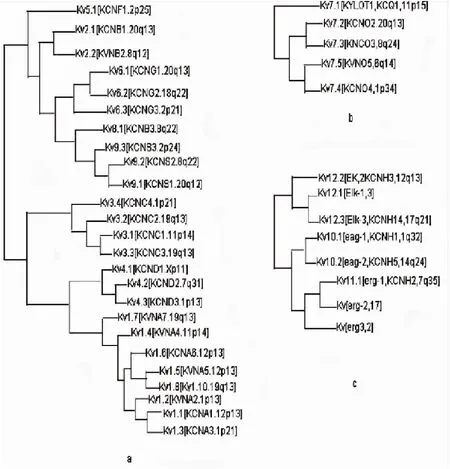
图2 Kv 家族树状图
1.2.4 双孔型钾离子通道(tandem-pore-domain potassium channels,K2p) 具有4个跨膜结构和2个孔区,该通道无电压依赖性,但对细胞膜外的机械力、PH值变化非常敏感,以此调控通道的活性[7]。根据其结构和功能的性质可分为6个亚族[8]:1)TWIK-1、TWIK-2和KCNK7;2)TAKS-1、TAKS-3、TAKS-5;3)TREK-1、TREK-2和TRAAK;4)TASK-2、TALK-1和TALK-2;5)THIK-1和THIK-2;6)TRESK。
2 钾离子通道与骨肉瘤研究进展
2.1 Kv通道与骨肉瘤研究进展
Kv通道是目前与骨肉瘤关系研究最多的亚族。吴进等[9-10]应用逆转录聚合酶链反应 (reverse transcription polymerase chain reaction,RT-PCR)对人骨肉瘤MG63、Saos-2和SOSP-9607细胞中相关Kv通道,包括Kv1.1、Kv1.3、Kv1.5、Kv2.1、Kv3.3/3.4、Kv4.1、Kv5.1、Kv9.3、Kv10.1(ether à go-go1,Eag1)和Kv11.1(human related ether à go-go gene1,Erg1)的基因表达情况进行检测。结果发现:Kv1.3、Kv1.5、Kv2.1、Kv3.3/3.4、Kv4.1、Kv5.1、Kv9.3、Kv10.1和Kv11.1通道基因在3株骨肉瘤细胞中均有表达,而Kv5.1通道基因只在MG63细胞中表达。非特异性的电压门控性钾离子通道抑制剂4-氨基吡啶(4-aminopyridine,4-AP)在3 mM和5 mM时对三株细胞增殖影响明显,并可阻滞细胞周期于G0/G1期。而另一种非特异性抑制剂氯化铯在5 mM时对细胞增殖及周期也有影响,但与4-AP相比,影响程度较小。陈志达等[11]应用实时荧光定量PCR(quantitative real-time PCR,qPCR)、蛋白免疫印迹法(Western blotting)和免疫组化检测人骨肉瘤MG-63细胞中Kv1.3表达,分别采用CCK-8法、裸鼠骨肉瘤异种移植模型和流式细胞仪检测特异性干扰RNA(small interfering RNA,siRNA)沉默Kv1.3表达前后MG-63细胞增殖、生长和凋亡的变化,采用Western blotting检测MG-63细胞中多聚ADP核糖聚合酶[Poly(ADP-ribose)polymerase-1,PARP]和半胱氨酸蛋白酶-3(Caspase-3)的表达水平。结果发现:抑制Kv1.3表达能从体内外水平有效地抑制MG-63细胞增殖并促进其早期凋亡,可能机制为诱导Caspase-3表达和PARP裂解。陈志达等[12]构建了特异性沉默Kv1.5的siRNA,并分别采用CCK-8法、克隆形成率、流式细胞仪和Tunel法检测沉默前后人骨肉瘤MG-63细胞增殖、生长、周期和凋亡的变化,采用qRT-PCR和Western blotting检测骨肉瘤细胞中周期和凋亡相关基因的表达水平。结果发现,沉默Kv1.5表达可明显抑制骨肉瘤细胞增殖和生长,阻滞细胞周期于G0/G1期,促进细胞凋亡。机制研究结果显示:沉默Kv1.5表达可下调骨肉瘤中Cyclin A、Cyclin D1、Cyclin E、B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)和Bik的表达,同时上调p21、p27、Bax、Bcl-XL和Caspase-3基因的表达。Lee等[13]研究发现Kv7.5在犬骨肉瘤CCL-183细胞中呈高表达,采用Kv7.5通道开放剂可以抑制CCL-183细胞增殖,阻滞细胞周期于G0/G1期,而Kv7.5通道的抑制剂则可通过下调转录因子Sp1的表达抑制Kv7.5活性,实现促CCL-183细胞增殖的效果。
Eag1及其编码的Eag1通道是第一个被证明与肿瘤密切相关的钾离子通道[14]。2014年Pardo等[15]在《Nature Reviews Cancer》杂志上发表文章,将Eag1视为确定的癌基因和有效的肿瘤治疗靶点(图3)。近年来,Eag1已成为肿瘤领域研究的热点并不断有新进展[16-17]。Wu等[18-23]对于Eag1与骨肉瘤关系进行了系列研究,结果显示:1)Eag1在人骨肉瘤组织和细胞中的表达与其在良性骨肿瘤和正常成骨细胞中的表达有显著差异性;2)Eag1可分别作用于下游靶点丝分裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)、CyclinD1/E和血管内皮生长因子(vascular endothelial growth factor,VEGF)/磷脂酰肌醇3-激酶(phosphatidylinositide 3-kinases,PI3K)/蛋白激酶B(protein kinase B/AKT)信号通路调节骨肉瘤增殖、周期、血管生成和侵袭;3)miR-34a在人骨肉瘤中表达下调,过表达miR-34a可抑制人骨肉瘤增殖和Eag1表达,而抑制miR-34a表达可诱导Eag1表达,提示Eag1可能是miR-34a的靶分子并受其负反馈调节;4)Eag1具有成为新的有效的骨肉瘤治疗靶点的潜能。全反式维甲酸(all-trans retinoic acid,ATRA)可激活骨肉瘤中的miR-34a-E2F1/3-Eag1信号通路抑制Eag1表达,从而达到治疗Eag1高表达的骨肉瘤的目的(图4)。而Eag1与肿瘤坏死因子相关凋亡诱导配体联合抑制或可产生协同效应。

图3 Eag1具有致癌潜能并可作为潜在的肿瘤标志物
Erg1基因及其编码的Erg1通道是肿瘤研究领域的另一个热点。Erg1选择性表达于多种组织来源的肿瘤细胞系及原代肿瘤细胞,调节肿瘤细胞增殖、分化、凋亡,与肿瘤的侵袭力和化疗敏感性密切相关[24-25]。甘璐[26]研究发现,Erg1的表达水平随着骨肿瘤的起源不同、恶性程度不同而存在差异。在良性或低度恶性的骨肿瘤中,Erg1不表达或者低度表达,而在高度恶性的骨肿瘤包括骨肉瘤中,Erg1多数呈高表达。在人骨肉瘤MG63、SOSP-9607、和Saos-2细胞中Erg1均有较高水平的表达,而部分钾离子通道抑制剂可明显抑制此三株肿瘤细胞系的增殖。贠喆等[27]进一步研究证实:在人骨肉瘤SOSP-9607和MG-63细胞中,Erg1在蛋白水平阳性表达,通过干扰RNA抑制Erg1在两株骨肉瘤细胞中的表达后,骨肉瘤细胞的增殖和侵袭能力明显减弱。Zeng等[28]研究发现:Erg1通过调控核因子κB(Nuclear factor kappa-B,NF-κB)信号通路中的细胞凋亡抑制蛋白-1(cellular inhibitor of apoptosis protein 1,cIAP-1)、X染色体连锁凋亡抑制蛋白(X-linked inhibitor-of-apoptosis protein,XIAP)、Bcl-2、Survivin、磷酸化NF-κB抑制因子(inhibitor of NF-κB, IκBα)和NF-κB p65的活性和表达水平参与了骨肉瘤细胞增殖和凋亡的过程并有望成为骨肉瘤治疗和诊断的新靶点。陈志达等[29]研究发现:Erg1可能通过调控Hippo信号通路中的大肿瘤抑制因-1(large tumor suppressor gene 1,LATS1)和Yes激酶相关蛋白(yes-associated protein,YAP)的活性参与骨肉瘤的侵袭过程。
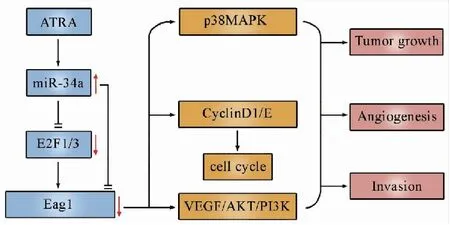
图4 ATRA调控miR-34a-E2F1/3-Eag1信号通路抑制骨肉瘤恶性表型的模式图
2.2 BK通道与骨肉瘤研究进展
Rezzonico等[30]研究发现BK通道人骨肉瘤MG63细胞中异常高表达。应用前列腺素E2(prostaglandin E2,PGE2)可以诱导BK通道开放,机制为募集α亚基超家族hSlo通道上的多种磷酸化蛋白激酶。而hSlo又可与Syk酪氨酸激酶形成复合体,成为PGE2调控骨重塑和改造过程的中间转导蛋白。Rezzonico等[31]后续研究发现:在人骨肉瘤MG-3和Cal72细胞及人正常成骨细胞中,机械压力的改变如低渗环境等可诱导粘着斑激酶(focal adhesion kinase,FAK)与细胞内的部分hSlo通道相结合形成复合体,从而持续性地激活BK通道。Cambiem等[32]设计了4对针对hSlo通道的特异性干扰RNA(small interfering RNA,siRNA)—hSlo370、hSlo734、hSlo3106和hSlo3301,并检测了其沉默效能。之后的研究发现特异性沉默hSlo通道可以促裸鼠骨肉瘤生长(人骨肉瘤Cal72细胞),可能的机制为BK通道通过调控趋化因子CCL2和CCL20表达及白细胞的浸润来实现促骨肉瘤发生的效果。
2.3 Kir通道与骨肉瘤研究进展
Kawase等[33]研究发现在人骨肉瘤UMR 106细胞和人成骨RCOB-3细胞中,降钙素基因相关肽(calcitonin gene-related peptide,CGRP)可通过诱导超极化激活细胞膜上的KATP通道,导致地尔硫卓敏感型钙离子通道关闭和钙的吸收抑制。该研究团队后续研究发现:在人骨肉瘤UMR 106细胞中,CGRP通过激活KATP通道打开导致钾离子外流,从而出现细胞膜的超极化、部分钙离子通道关闭和钙的吸收抑制等一系列过程。此过程可能诱导细胞形态改变,进而诱导细胞增殖、分化等过程[34]。Pangalos等[35]应用膜片钳技术检测发现超极化可激活人成骨细胞和人骨肉瘤MG63细胞中Kir通道电流,而去极化则可激活部分电压门控型钠离子(voltage-gated sodium channel,Nav)和钾离子通道。进一步的RT-PCR检测发现上述两株细胞中,多种通道包括Nav1.3、Nav1.4、Nav1.5、Nav1.6、Nav1.7、Kir2.1、Kir2.3、Kir2.4和Kv2.1均有表达。近年来在线粒体膜上发现了一种新型的KATP通道-线粒体KATP通道(mitochondria KATP,mitoKATP)。该通道是线粒体内膜上的跨膜蛋白,主要是由Kir通道和ATP结合蛋白超家族(SUR)组成的异构八聚体,因其能偶联细胞内的能量代谢状态与钾离子跨膜流动和膜兴奋性,mitoKATP通道受到越来越多的关注[36]。Butler等[37]应用免疫组化和光学显微镜发现在人骨肉瘤Saos-2细胞中mitoKATP的亚型Kir6.2在线粒体中呈低表达,而另一种亚型Kir6.1却没有表达。
2.4 K2p通道与骨肉瘤研究进展
董学海[38]和Li等[39]研究了双孔钾离子通道亚型TASK-1、TASK-2和TASK-3在人骨肉瘤MG63细胞中的表达及分布情况,结果发现TASK-1、TASK-2和TASK-3离子通道定位于细胞膜及细胞核周围。进一步的研究发现在酸中毒条件下,MG63细胞增殖能力较PH 7.4环境明显降低。同时,这种酸中毒对细胞增殖的影响没有时间依赖性。上述结果提示TASK通道可能与人骨肉瘤细胞增殖有密切关系。
3 总结与展望
钾离子通道对细胞跨膜电位的影响不仅引起Ca2+内流的变化,还和Na+依赖性营养物质转运、细胞内PH等有关。更让研究人员感兴趣的是即使利用某些药物阻断部分钾离子通道电流(废除钾离子通道如Kv10.1的离子通道特性)并不影响其促肿瘤发生的能力,所以部分钾离子通道在促肿瘤发生中并不仅仅表现为离子通道的特性[14]。因此,随着研究的深入,钾离子通道必将应用于骨肉瘤的诊断和治疗,成为诊断骨肉瘤早期发生和恶性转移的标志蛋白,还可以通过抑制离子通道来抑制骨肉瘤的增殖和转移,开发出一批针对钾离子通道的治疗骨肉瘤的新型药物。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
