基于新课标背景氧化还原复习课堂的设计
2020-08-25邹玉金
邹玉金
氧化还原反应贯穿着高中化学的始终,是高中化学学习的重难点之一,也是高考热门考点之一.氧化还原反应包括了元素和化合物化合价变化的反应、金属的腐蚀反应以及电化学发生的反应,涉及的范围比较广.在强调核心素养的教育背景下,教师应以化学实验为主线,按巩固基础知识、明确反应本质、提升理解含义的路线帮助学生深刻认识氧化还原反应,科学构建复习知识网络.
一、基础实验,巩固复习知识
《普通高中化学课程标准》曾明确氧化还原反应的学习要求:学生要清楚地认识“化合价改变的反应是氧化还原反应”,了解“氧化还原的本质是得失电子”,利用氧化还原反应推理并判断物质的化学性质和变化.高三学生对氧化还原反应的基础知识已经具有大致的印象和概念,主要以巩固基础为主.
在高三复习课堂中,教师可以借助一个最基础的氧化还原反应作为课堂的导入.例如,将Fe放入装有CuSO4溶液的试管中,最后出现蓝色溶液变为棕黄色的FeSO4溶液,试管中Fe逐渐溶解生成新物质Cu.在实验的导入下,使学生主动回忆起氧化还原的基础知识:①基本离子反应式Fe+Cu2+=Fe2++Cu;②氧化剂、还原剂、氧化反应、还原反应、氧化产物、还原产物分别是哪些;③氧化还原反应中电子转移的方向和数目;④氧化还原反应氧化性和还原性的强弱关系和规律;⑤生活学习中一些比较常见的氧化物.通过一些简单基础的氧化还原实验,引导学生构建完善的知识网络,带动学生的复习热情,帮助学生唤起之前的学习基础,帮助学生构建知识网络检查和完善自身的缺陷和不足.
二、延伸实验,明确复习本质
氧化还原反应的本质即“一定数目电子的转移”,对于比较抽象的化学理论概念,学生一般很难熟练地掌握.为了能让学生更加清晰地了解氧化还原反应的本质,教师可以通过实验的拓展达到教学的目的.
以原电池实验为例,在实验的初始阶段,教师把Cu片和Zn片同时放进稀H2SO4溶液中,观察实验现象;其次,教师把Cu片和Zn片用金属线连接,再同时放进稀H2SO4溶液中,观察实验现象;最后,教师在连接Cu片和Zn片的电线中接入双向电流计,观察实验现象.教师可以在课堂上要求学生进行分组讨论,通过小组合作共同探讨实验现象,发现结论.基础薄弱的学生可能会感到迷惑:为什么一根电线能够开启一个原电池的反应?电流计的指向代表了电子的方向?为什么实验过程中,Zn片表面没有明显的气泡,但在Cu片表面却出现明显的气泡?基础好的同学就可以利用已有知识解答这些问题.通过小组讨论的方式,可以凸显学生作为“主体”地位的有效性,教师能够把教学重点放在“刀刃”上,塑造一个有效课堂.
三、验证实验,提升复习内涵
在完成构建完整的氧化还原反应知识体系之后,教师还要针对复习效率的提高,在原有的实验基础上加入验证实验,讓学生通过氧化还原的本质推理实验反应的方程式并尝试解释实验原理.例如,FeCl3与KI反应,为了验证实验产物是否为I2,在反应后的试管中加入适量的H2SO3溶液使蓝色溶液完全褪色,要求学生思考、观察写出试管中发生的反应式,解释褪色的原因.学生首先应该确定I2和H2SO3哪一种物质是氧化剂、还原剂,再根据反应现象和可能出现的元素化合价进行反应式的配平,最后得到反应式I2+H2SO3+H2O=HI+H2SO4,属于学生的提升阶段.
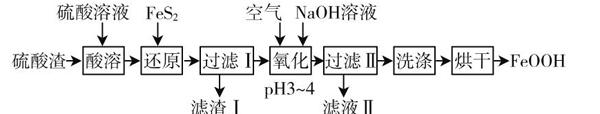
教师深化复习教学内容,还可以联系生活事件和常见的化工流程(如下图).
图中所示的化工流程中的每一步都值得教师指导学生进行推敲.在还原步骤中加入FeS2,其目的是为了把溶液中Fe3+还原成Fe2+,则元素S会被氧化成SO2-4,那么具体的氧化还原反应的反应式是什么?在学生思考的同时,教师要适时强调氧化还原的本质是电子的转移,再让学生进行推理.通过联系实际化工流程和生活现象,学生对氧化还原反应的认识会更加深刻.
总之,氧化还原反应依旧是学生需要花费大量精力的学习内容,教学课堂可以与合作探究教学模式结合,提高学生学习的主动性.教师的课堂设计还可以考虑以实验为主线,以基础实验、拓展实验和验证实验为主要教学模块帮助学生构建知识网络体系,加强学生的复习效率,深化学生学习氧化还原反应的体会和感悟.
