湖南省首例猪链球菌14型人源分离株鉴定及毒力基因分析
2020-08-25贺子翔覃玉芳向星宇胡俊忠湛志飞
贺子翔,夏 昕,覃玉芳,杨 浩,覃 迪,向星宇,胡俊忠,湛志飞
猪链球菌病(streptococcus suis disease)是由多种致病性猪链球菌(Streptococcus suis,S.suis)感染引起的一种人兽共患病[1]。猪链球菌是猪身上的一种常见的重要病原体,也可引起人的脑膜炎、败血症、心内膜炎、关节炎和肺炎[1-2],严重者还可导致永久性耳聋、中毒性休克综合征(toxic shock syndro me,TSS),甚至导致死亡[3-4]。猪链球菌根据荚膜多糖抗原的不同,共分为35个血清型,即1~34型和1/2型,最常见的致病性血清型为2型[5-6]。2006年,湖南省报道了首例人感染猪链球菌病例,为猪链球菌2型[7]。此后,湖南省人感染猪链球菌病时有发生,人源分离株经实验室鉴定也均为猪链球菌2型菌株。目前,国内关于猪链球菌14型人源分离株的报道少见。本研究对2019年就诊于湖南某医院的1例疑似人感染猪链球菌病患者的关节液进行了菌株分离鉴定与毒力分析,现将结果报告如下。
1 材料与方法
1.1 病例信息 患者,男,61岁,为某屠宰厂门卫。发病前7 d内均有接触外表健康猪,接触手有1处结痂封闭的深度伤口,且接触后未及时洗手。发病前7 d未接触猪肉,接触过猪肉熟食。2019年5月29日患者右膝肿痛并于同日入院。病发后最高体温38℃,右膝肿胀明显,浮髌试验阳性。
1.2 菌株来源 患者关节液。
1.3 试剂 血琼脂平板(广东环凯微生物科技有限公司),VITEK 2革兰氏阳性细菌鉴定卡和药敏卡(法国生物梅里埃公司),猪链球菌2型和14型诊断血清(郑州万泰生物科技有限公司),DNA提取试剂盒(QIAGEN DNeasy)PCR引物均购自宝生物工程有限公司,PCR试剂为Ex Taq酶(宝生物工程有限公司)。
1.4 仪器 VITEK 2 compact全自动微生物分析系统(法国生物梅里埃),9700型PCR仪(Applied Biosystems公司),全自动核酸分析仪QIAxcel Advanced(Qiagen公司)。
1.5 细菌分离培养 将关节液接种于血琼脂平板分区划线培养,置37℃,烛缸培养24 h,观察菌落形态特征。
1.6 革兰氏染色镜检 挑取单个可疑菌落进行革兰氏染色镜检,并挑取符合猪链球菌镜下特征的单个菌落转种至血琼脂平板纯培养,置37℃,烛缸培养24 h。
1.7 生化鉴定和药物敏感实验 挑取适量新鲜的纯培养菌落,配制菌悬液;填充VITEK 2革兰氏阳性细菌鉴定卡和药敏卡,用VITEK 2 compact全自动微生物分析系统鉴定分析。
1.8 血清凝集试验 挑取新鲜纯培养菌落分别与猪链球菌2型和14型诊断血清做玻片凝集试验,同时做生理盐水对照。
1.9 菌株DNA模板提取 用生理盐水制备浊度7-10 Ma F的菌悬液,用DNA提取试剂盒制备DNA模板,-80℃保存备用。
1.10 猪链球菌分子生物学检测 参考文献[5,7-10]合成引物,检测猪链球菌种特异性基因(16S r RNA),主要毒力因子基因:溶菌酶释放相关蛋白(muramidase-released protein,mr p)、纤粘连蛋白结合蛋白(fibronectin-binding proteins,f bps)、溶血素(suislysin,sl y)、细胞外因子(extracellular factor,ef)、谷氨酸脱氢酶(gl uta mate dehydrogenase,gdh)、毒力相关序列第二开放读码框(open reading fra me 2,or f 2)和甘油醛-3-磷酸脱氢酶的编码基因(glyceraldehyde-3-phosphate dehydrogenase,gapdh),引物序列见表1。PCR反应体系[8],20μL:Ex Taq HS 0.1μL,10×Ex Taq buffer(Mg2+plus)2 μL,d NTP Mixt ure 1.6μL,上、下游引物各1μL,dd H2O 13.3μL,DNA模板1μL。PCR反应条件:95℃预变性10 min;95℃变性30 s,退火(温度见表1)30 s,72℃延伸1 min,共35个循环;72℃延伸7 min。扩增产物用全自动核酸分析仪电泳得出结果。
2 结 果
2.1 菌落特征 培养24 h后,可疑菌株在血琼脂平板上出现灰白色、光滑湿润、凸起的小菌落,菌落周围有较明显的α溶血。见图1。
2.2 革兰氏染色镜检结果 油镜下,细菌为革兰氏阳性球菌,单个散在或短链状排列。见图2。
2.3 生化鉴定 VITEK2 compact全自动微生物分析系统报告生化鉴定结果为猪链球菌2型(可能性99%)。
2.4 药物敏感实验 VITEK2 compact全自动微生物分析系统报告药敏实验见表2。分离株除对红霉素、克林霉素、四环素耐药外,其余药物均为敏感,且头孢西丁耐药机制筛选阴性。
2.5 血清凝集试验 分离菌株与猪链球菌14型诊断血清发生凝集反应,与猪链球菌2型诊断血清不发生凝集反应,生理盐水对照不发生凝集反应。

表1 猪链球菌及相关毒力因子基因引物序列Tab.1 Primer sequences of Streptococcus suis and related Virulence genes
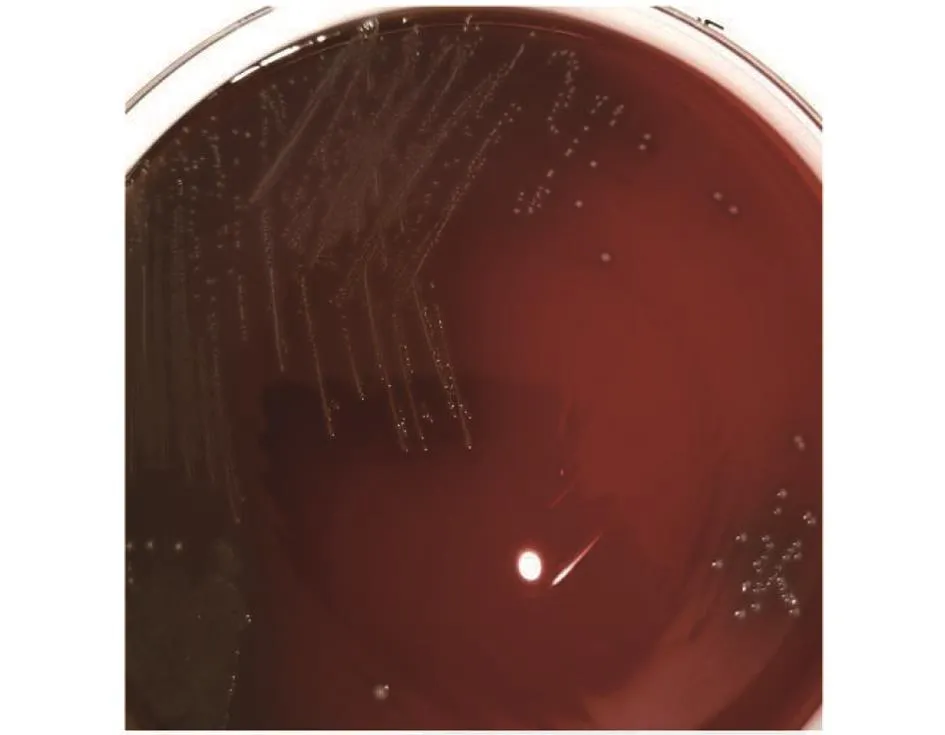
图1 猪链球菌14型菌落形态Fig.1 Colony mor phology of Streptococcus suis type 14
2.6 PCR结果 猪链球菌种特异性基因(16S r RNA)阳性,2型荚膜多糖基因(cps 2J)阴性、14型荚膜多糖基因(cps 14J)阳性,毒力基因:溶血素(sl y)、纤粘连蛋白结合蛋白(f bps)、胞外因子(ef)、谷氨酸脱氢酶(gdh)、毒力相关基因(or f 2)和甘油醛-3-磷酸脱氢酶的编码基因(gap dh)均为阳性,溶菌酶释放相关蛋白(mr p)为阴性。结果见图3。
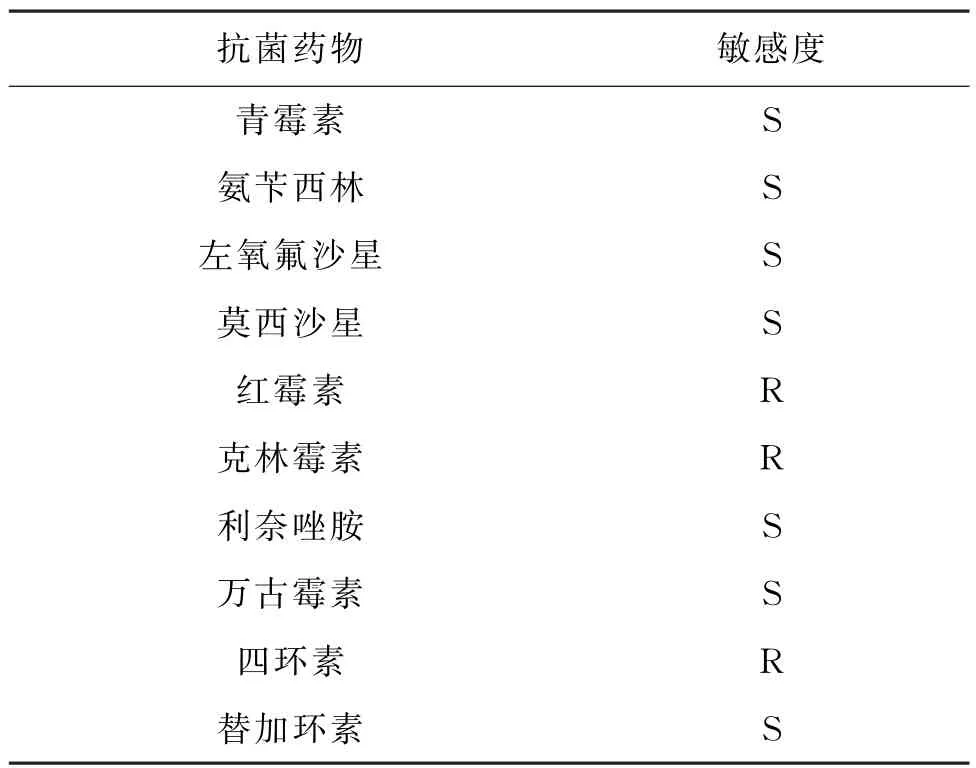
表2 猪链球菌14型药物敏感实验结果Tab.2 Drug sensitivity test results of Streptococcus suis type 14
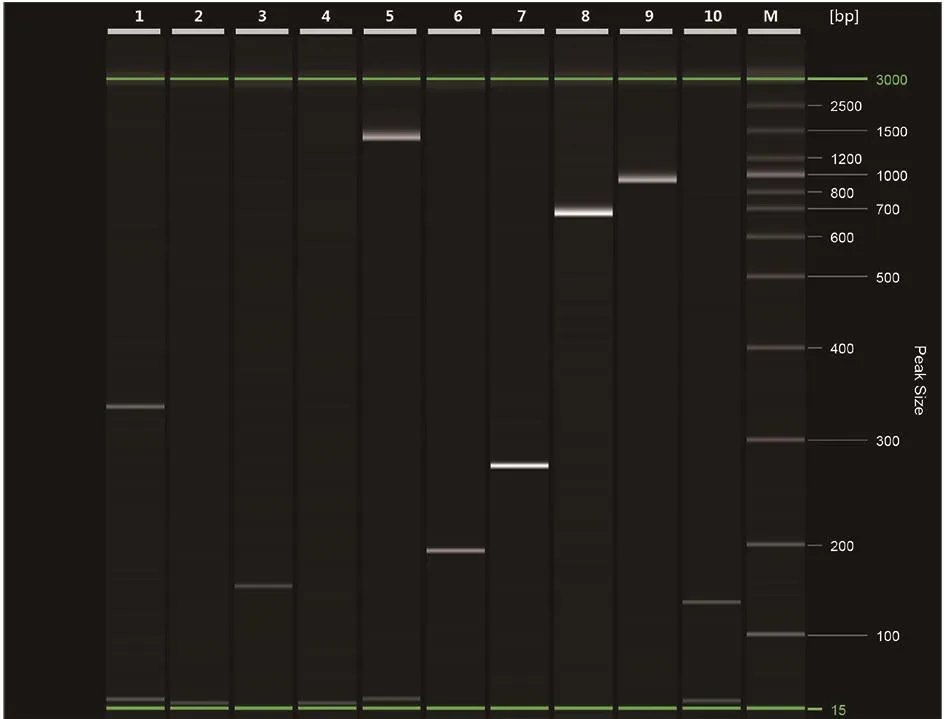
图3 猪链球菌14型PCR电泳结果Fig.3 PCR electrophoresis results of Streptococcus suis type 14
3 讨 论
1968 年丹麦学者首次报道了3例人感染猪链球菌导致脑膜炎并发败血症病例,1975年荷兰也出现了散发病例的报道[11]。1999年,董德平等[12]首次在国内报道了人感染猪链球菌病病例,为猪链球菌2型。2005年,四川省发生大规模人感染猪链球菌病,204例病例,死亡39例,此次疫情由猪链球菌2型引起[13]。其他各省也有猪链球菌病散在病例报道。因此,对该菌的快速鉴定和分型以及毒力分析对患者的诊治以及疫情的分析处置都尤为重要。此次为湖南省自2006年报道人感染猪链球菌2型病例后,首次检出猪链球菌14型病例,表明了新型猪链球菌已在湖南省出现,在未来的疫情处置和患者诊治中都需引起重视。
VITEK 2 compact全自动微生物分析系统是微生物快速检测分析系统,马丽梅等[14]应用此系统对111株猪链球菌进行了鉴定,110株被准确鉴定为猪链球菌2型,还有1株被准确鉴定为猪链球菌1型,认为VITEK 2 compact全自动微生物分析系统能够快速准确检测和鉴定猪链球菌2型,结果可靠。但是此系统也存在局限性,鉴定库只有猪链球菌1型和猪链球菌2型两种鉴定结果。本研究应用此系统对可疑菌株进行了试验,结果也显示高鉴定度:猪链球菌2型(可能性99%)。可见对于非1型/2型猪链球菌,仅依靠此系统进行鉴定可能会存在不准确的情况。也正因为这种情况的存在,我们通过血清学试验和荚膜多糖基因检测,分离株2型血清和2型荚膜多糖基因均阴性,14型血清和14型荚膜多糖基因均阳性,确认分离到的病原菌为猪链球菌14型。
药物敏感性实验对患者的治疗有重要指导意义,分离株对多数抗菌药物敏感,对猪链球菌的主要抗菌药物如青霉素、氨苄西林、头孢菌素类[1]均敏感。患者按药敏指导用药后痊愈出院。四川省48例患者分离的猪链球菌2型均对四环素耐药,对青霉素、阿莫西林、头孢噻肟、红霉素、克林霉素等多种抗菌药物敏感[15]。湖南1例人源猪链球菌2型菌株对四环素耐药,对青霉素G、氨苄西林、红霉素等多种抗菌药物敏感[7]。许晓燕等[16]研究表明我国的猪链球菌对四环素的耐药机制主要是由tet(M)基因介导的核糖体保护作用,且tet基因在猪源与人源及其他动物源不同种属细菌间存在广泛的交换。此次分离株除对四环素耐药外,还出现了对红霉素、克林霉素的耐药,提示我们新的耐药情况的发生。刘荻萩等[17]研究表明er mB基因介导的腺嘌呤甲基化阻断大环内酯类抗生素与核糖体结合是细菌对大环内酯类的主要耐药机制。此次分离株对红霉素和克林霉素的新耐药,可能与获得er mB基因有关,有待进一步研究。此次分离株虽然对目前主要治疗用抗菌药物显示敏感,但仍应引起我们注意,在治疗中需要根据药敏结果选择药物,避免新的耐药的发生,同时也需关注兽医用药对耐药的影响。
作为猪链球菌的种特异性基因(16S r RNA)一直比较稳定,在生化和血清学试剂不全或者诊断不明的情形下,可以更快速有效的鉴定猪链球菌的存在,本次分离到的猪链球菌14型菌株经PCR扩增,16S r RNA结果为阳性,可以作为猪链快速鉴定的检测方法之一。
本次分离株的毒力基因型为mr p-/sl y+/f bps+/ef+/gdh+/or f 2+/gap dh+。在猪链球菌2型菌株的研究中,一般认为sl y、mr p及ef 3个毒力因子可用来区分高致病、低致病与非致病菌株,sl y、ef、mr p阳性常被认为是与菌株的高致病性相关的[5]。孙珂等[18]对10株猪源猪链球菌4型菌株小鼠致病性试验,ep-、mr p-、sl y-菌株致病性高于ep-、mr p-、sl y+菌株,证明猪链球菌4型与猪链球菌2型毒力因子的分布有差异。张振江等[19]研究的1株猪链球菌9型菌株,虽然缺失致病性最强的ef、mr p、sl y毒力基因,但在小鼠致病性试验中亦表现很强的致病力,且该菌株还能引起猪的脑膜炎。王淑杰等[20]对1株猪链球菌31型菌株的研究显示,菌株毒力基因型为gdh+、mr p-、ef-、sl y-及89PaI-,但小鼠致病性试验呈现明显的化脓性脑炎现象。综上所述,我们可以认为,与猪链球菌2型菌株相比,其他型别的毒力基因分布可能存在差异,部分或全部2型菌株中强毒力基因的缺失并不会导致其他型别的菌株致病力的降低。mr p是细胞壁结合蛋白,含有mr p的菌株能逃避吞噬细胞的吞噬,进而选择性地在上皮细胞中繁殖[21]。在本研究中,患者虽然主要表现关节炎症状,但在随后的血液培养中同样检出猪链球菌14型菌株,证实进一步血流感染的存在。因此,此次的14型分离株虽然缺失致病性强的mr p基因,但仍有较强毒性。其致病机理,有待进一步的研究。
