食用菌中硫酸链霉素残留的免疫快速检测
2020-08-24柳双王敏思谢春花周永斌柳桃宋洋
柳双,王敏思,谢春花,周永斌,柳桃,宋洋,*
(1.天津师范大学生命科学学院天津市动植物抗性重点实验室,天津300387;2.天津市林业果树研究所,天津300384;3.中延菌菇业(天津)有限公司,天津301600)
硫酸链霉素(Streptomycin)是一种氨基酸糖苷类抗生素药物[1],结构式如图1所示,分子量为728.7,是链霉素的硫酸盐形式。链霉素对结核杆菌具有强大的抗菌作用[2],对多数革兰阳性球菌和杆菌的抗菌作用不强,对许多革兰阴性杆菌有较强的抗菌作用,曾被广泛用于结核病的治疗。在农业方面,硫酸链霉素可作为一种广谱抗菌素药剂[3],应用于食用菌栽培及果蔬病害防治,可用于促进木耳菌丝生长[4-5];抑制食用菌培养基中杂菌的生长[6];防控食用菌栽培中的软腐病[7]、细菌性腐烂以及治疗平菇锈斑病[8]、红银耳病、大白菜软腐病、水稻白叶枯病、棉花立枯病、瓜类霜霉病等[9]。随着硫酸链霉素在农业中的大量使用,农产品中的硫酸链霉素药物滞留和蓄积,并以食物链方式进入人体,危害人类健康[10]。硫酸链霉素及其衍生物有严重的肾毒性和耳毒性,长期摄入有链霉素残留的食物会造成肾脏及前庭功能和耳蜗神经永久性损伤[3];食物中残留的硫酸链霉素可能会造成过敏反应甚至引起休克[11];研究表明硫酸链霉素还具有潜在的致畸作用[12]。因此在临床上逐渐被其他效果类似的药物所取代,但在农药方面仍在继续利用[13]。

图1 硫酸链霉素结构式Fig.1 The structure of streptomycin
目前,硫酸链霉素在我国及日本等多个国家(地区)均允许使用,但由于其对人体的危害性,我国及世界各国对其残留限量作出规定,其中我国农业部及欧盟国家仅规定了动物源食品中硫酸链霉素的最高残留限量[14-15];仅日本肯定列表中规定了植物源食品中的硫酸链霉素残留限量,如白菜/大蒜和茄科蔬菜中硫酸链霉素的最高残留限量分别为50 μg/kg和300 μg/kg。国内外针对于动物源性食品中硫酸链霉素残留检测的研究较多,且以色谱方法为主。但仪器方法存在成本高,自动化程度低等问题[16]。近年来,免疫分析方法因其简单、快速等特点被建立并广泛应用。2011年N.A.Byzova等[17]建立了胶体金免疫层析试纸条的方法检测牛奶和酸奶中硫酸链霉素残留,其检测范围在16 ng/mL~250 ng/mL,样品无需处理即可稀释用于检测,与传统酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA) 相关性为 0.935;2013 年奚茜等[18]建立了直接竞争ELISA检测牛奶和蜂蜜中硫酸链霉素残留的方法,该方法IC50值为3.60 ng/mL,样品经提取、净化、干燥等处理后稀释用于检测,与液相色谱(liquid chromatography,LC)方法的相关系数分别为0.99和0.97;2019年Wei等[19]建立了视觉双点免疫分析法同时检测牛奶中硫酸链霉素和卡那霉素残留的方法,样品经简单除脂后稀释用以检测,该方法肉眼检测限为12.5 ng/mL,回收率为93.3%~124.5%,并可进行现场检测。
随着食用菌产业不断发展,食用菌的安全问题得到重视。由于硫酸链霉素可应用于食用菌软腐病和细菌感染等疾病的防控,因此建立针对食用菌中硫酸链霉素残留建立快速准确的检测技术至关重要。本试验基于硫酸链霉素单克隆抗体,经简单快速的样品前处理及反应条件优化,建立食用菌中硫酸链霉素残留间接竞争ELISA检测方法,并对25个样品进行实际样品检测,对于实现食用菌中硫酸链霉素的高效、快速检测具有重要的意义,为针对食用菌的硫酸链霉素检测试剂盒的研发奠定了良好的基础。
1 材料与方法
1.1 材料与试剂
硫酸链霉素:河北百灵威超精细材料有限公司;酶标二抗(羊抗鼠):中国上海斯信生物技术有限公司;牛血清蛋白(bovine serum albumin,BSA):生工生物工程上海股份有限公司;β-环糊精:德国Merck公司;过氧化氢脲:美国 Sigma公司;3,3’,5,5’—四甲基联苯胺(3.3.5.5Tetramethylbenzidine,TMB):美国 Sigma公司;二甲基亚砜(dimethyl sulfoxide,DMSO):中国 J&K公司;NaH2PO4·2H2O:天津金海华兴科技发展有限公司;Na2HPO4·12H2O:天津市大茂化学试剂厂;NaCl、乙酸钠、硫酸(分析纯):中国天津市化学试剂供销公司;柠檬酸:成都格雷西亚化学技术有限公司;三氯乙酸:天津市津科精细化工研究所;样品:市售。
pH 9.6碳酸钠缓冲液(包被缓冲液);0.01 mol/L磷酸钠缓冲液,pH 7.4(phosphate buffer,PBS);1L PBS 加0.5 g吐温(PBS-tween-20,PBST);100 mLPBS+0.1 g BSA(PBS-BSA,PBSB);6 mg/mL硫酸链霉素单克隆抗体:天津师范大学天津市动植物抗性重点实验室合成。
1.2 仪器与设备
Infinite 200全波长酶标仪:英国雷勃公司;96孔酶标板:丹麦Nunc公司;GHP-9050恒温培养箱:上海一恒科学仪器有限公司;RH-KT加热磁力搅拌器、MTS2/4数显型酶标板振荡器:德国IKA公司;H1650离心机:湖南湘仪实验室仪器开发有限公司;XH-C涡旋仪:上海联广认证有限公司;XBLL-23A多功能食品加工机:中国帅佳电子科技有限公司。
1.3 硫酸链霉素间接竞争ELISA方法的建立
利用间接竞争ELISA法,具体方法参考自Song等[20],酶标二抗稀释5 000倍,分别将包被原用包被液配制成 0.01、0.05、0.1 μg/L;将缓冲液离子浓度调为:10、20、30、40、50 mmol/L 用以稀释抗体、酶标二抗及硫酸链霉素标品;将缓冲液的pH值分别调成:4.5、5.5、6.5、7.4、8.5、9.5,用以稀释抗体、酶标二抗及硫酸链霉素标品;将竞争反应时间分别设置为 25、40、55、70 min。反应在96孔酶标滴定板中进行,用酶标仪读取A450 nm和A650 nm值,最后根据结果中IC50值的大小和吸光度的变化选择最佳反应条件。
利用以上优化条件,将硫酸链霉素配制成浓度为0.07、0.22、0.67、2.00、6.00、18.00 μg/kg 的溶液,进行间接竞争ELISA试验。试验结果以硫酸链霉素标准品的浓度(μg/kg)为横坐标,以抑制率(%)为纵坐标绘制标准曲线。
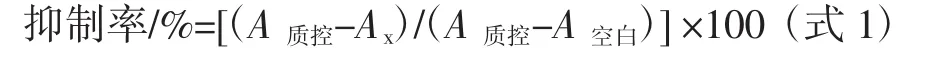
式中:A质控为硫酸链霉素标品浓度为零时的吸光度;Ax为硫酸链霉素标品浓度为x时的吸光度;A空白为空白孔的吸光度。
1.4 抗体特异性的评估
通过抗原以及其他抗原结构类似物与抗体的交叉反应率来判断抗体的特异性[21]。

式中:IC50(硫酸链霉素)为硫酸链霉素的抑制率为 50%时所对应的硫酸链霉素浓度;IC50(其他标准品)为其他标准品的抑制率为50%时所对应的标准品浓度。
1.5 样品的测定
1.5.1 样品的准备与处理
分别选择5种食用菌(平菇、杏鲍菇、双孢菇、猴头菇、香菇)作为样品去评估间接竞争ELISA方法的各项性能指标。样品经HPLC-MS检测确保其不含硫酸链霉素和双氢链霉素。将样品的子实体部分用食品加工机切碎,储存在-20℃备用。
1.5.2 基质影响的消除
称取1g经粉碎的样品,加入2mLPBS,涡旋5min,离心(5 000 r/min),取1 mL上清液加入1 mL 5%三氯乙酸溶液,涡旋5 min,离心,取上清液。处理后的样品液体储存于棕色小瓶中-20℃备用,用缓冲液稀释即可进行ELISA检测。
1.5.3 添加回收试验
本研究利用添加回收试验评估了方法的准确度。具体步骤如下:利用5种食用菌样品进行加标回收试验,每种样品分别添加 3 个浓度(15、65、150 μg/kg),每个浓度重复3次,样品提取液经间接竞争ELISA法分别检测后,计算其回收率,根据回收率接近100%的程度来检验方法的准确度。

1.5.4 实际样品的检测
对平菇、杏鲍菇、香菇、双孢菇及猴头菇进行抽样调查,每种抽取5个样品进行检测。
1.6 与HPLC-MS比对试验
检测条件及方法参考标准方法:GB/T 22995-2008《蜂蜜中链霉素、双氢链霉素和卡那霉素残留量的测定液相色谱-串联质谱法》[22]。
样品提取与净化方法同1.5.2,处理后的样品液体过0.22 μm水系滤膜后即可进行HPLC-MS检测。
2 结果与分析
2.1 间接竞争ELISA法的建立
经优化了包被原包被量、缓冲液液离子浓度、pH值以及竞争反应时间,最终确定的的最优条件为:抗体稀释108 000倍;包被原包被量为0.5 μg/well;缓冲液为10 mmol/L,pH 7.4的磷酸缓冲液;抗原抗体竞争反应时间为55 min。绘制缓冲液标准曲线如图2所示,IC15=(0.20 ±0.05)μg/L,IC50=(0.87±0.15)μg/L,线性范围为 0.25 μg/L~4.25 μg/L(抑制率为 20%~90%所对应的硫酸链霉素浓度)。

图2 硫酸链霉素抑制曲线Fig.2 Streptomycin sulfate inhibition curve
2.2 抗体特异性
利用间接竞争ELISA测定抗体与硫酸链霉素及其他结构类似物的交叉反应来评价抗体的特异性见表1。

表1 各化合物与抗体的交叉反应率和IC50值Table 1 The IC50and coefficient of variation of compounds
由表1可知,该抗体可以特异性的识别硫酸链霉素,且对其类似物双氢链霉素有极高的交叉反应(98.9%),而与其他抗生素如庆大霉素、卡那霉素、氯霉素等的交叉反应率均小于0.01%。
2.3 硫酸链霉素间接竞争ELISA的校正曲线及基质曲线
取5种食用菌样品进行处理,将获得的样品提取液经PBS稀释20倍后的溶液作为硫酸链霉素标品的稀释液,经间接竞争ELISA检测获得的抑制率曲线即为样品的基质曲线,结果如图3、表2所示,5种样品的基质曲线与校正曲线几乎重合。

图3 硫酸链霉素间接竞争ELISA校正曲线(以杏鲍菇为例)Fig.3 Indirect competitive ELISA calibration curve of streptomycin sulfate(taking pleurotus eryngium as an example)

表2 硫酸链霉素间接竞争ELISA法校正曲线与各样品的基质曲线的比较Table 2 Comparison of indirect competitive ELISA calibration curves of streptomycin with matrix curves of each sample
由表2可知,样品的前处理方法完全可以达到消除基质影响的目的,且该校正曲线至少可以用于这5种样品的硫酸链霉素残留检测。
2.4 添加回收试验
将5种食用菌样品匀浆分别添加3个水平(15、65、150 μg/kg)的硫酸链霉素标品,每个水平设置 3个平行,25℃静置30 min,分别处理样品,获得提取液,经PBS稀释80倍后用于间接ELISA检测,结果如表3所示。其中,回收率为88.5%~99.5%,在误差允许内,且变异系数小于7.5%。
2.5 实际样品检测结果
本试验对平菇、杏鲍菇、香菇、双孢菇及猴头菇进行抽样调查,每种抽取5个样品进行检测。实际样品中的硫酸链霉素的检测见表4。
由表4可知,在杏鲍菇、平菇、双孢菇、香菇中均检出硫酸链霉素,其结果与高效液相色谱串联质谱法一致。
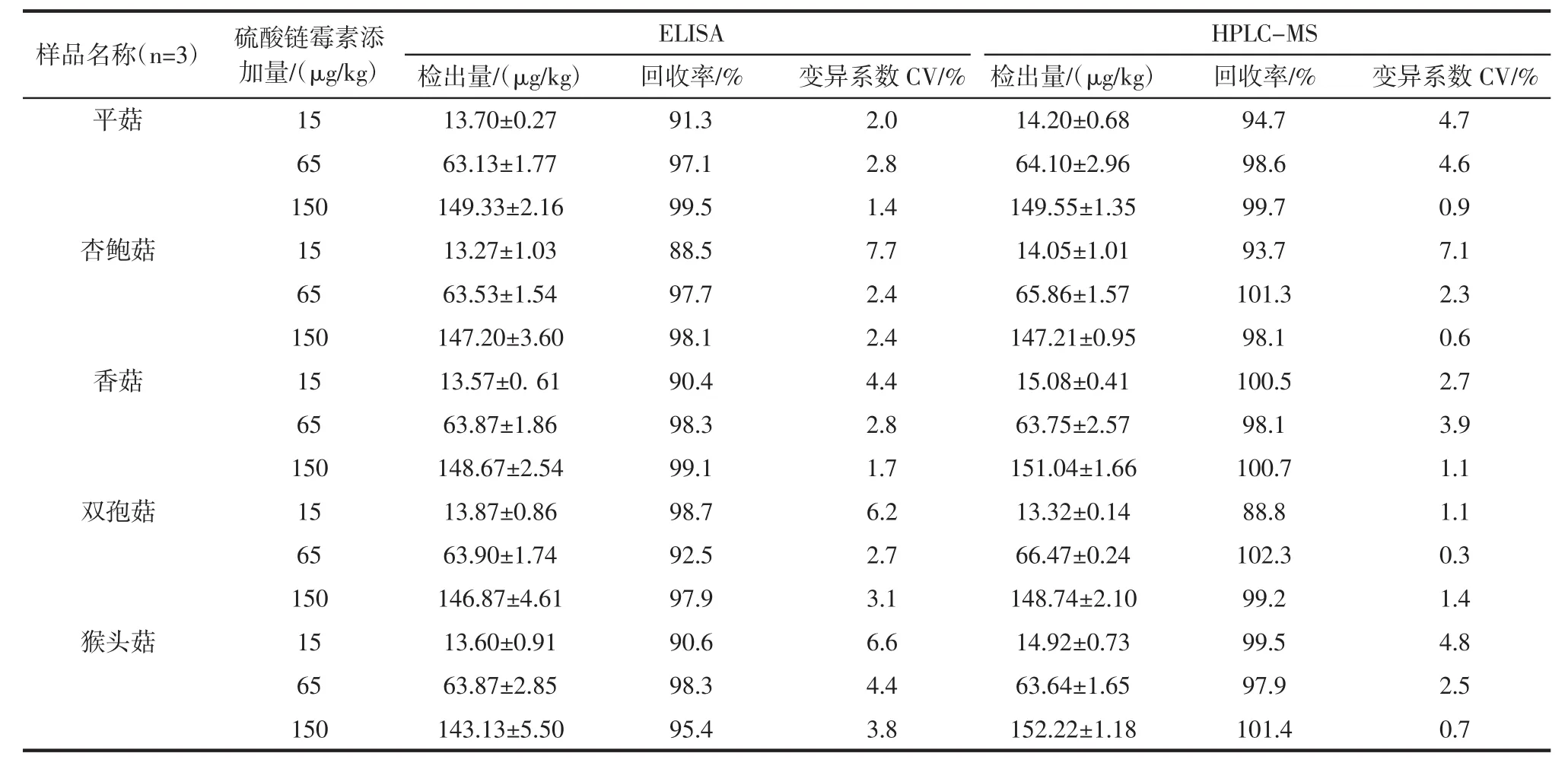
表3 硫酸链霉素在5种样品中的添加回收率Table 3 Recovery of Streptomycin in 5 Samples

表4 实际样品中的硫酸链霉素的检测Table 4 Detection of streptomycin in real samples
3 结论与展望
本研究基于间接竞争ELISA方法,建立了一种快捷、灵敏、准确的检测食用菌中硫酸链霉素残留的方法。其中,样品仅需简单提取和酸化即可基本消除基质影响并用于间接竞争ELISA检测。实现了食用菌中硫酸链霉素残留的快速检测。由于目前仅日本肯定列表中规定了部分植物源性食品中硫酸链霉素的最大残留限量,未规定食用菌中硫酸链霉素的最大残留限量,因此该结果对完善我国国家标准中食用菌中硫酸链霉素的残留限量提供一定的数据支持。
