抑制素免疫对崇明白山羊公羔羊生殖发育的影响
2020-08-24戴建军姚惠娟张树山张德福
葛 雷,李 垚,戴建军,姚惠娟,张树山,2,张德福,2
(1 上海市农业科学院畜牧兽医研究所,上海201106;2 上海市农业遗传育种重点实验室动物遗传工程研究室,上海201106;3 上海海洋大学水产与生命学院,上海201306;4 上海交通大学医学院,上海200025)
葛雷,李垚,戴建军,等.抑制素免疫对崇明白山羊公羔羊生殖发育的影响[J].上海农业学报,2020,36(4):71-76
抑制素(Inhibin,INH)是一种由动物性腺分泌的糖蛋白激素,主要来源于睾丸支持细胞和卵巢颗粒细胞,可特异性作用于垂体,对基础的卵泡刺激素(Follicle-stimulating hormone,FSH)分泌和促性腺激素释放激素(Gonadotropin-releasing hormone,GnRH)刺激的FSH 分泌有抑制作用,且呈剂量依赖关系[1-2]。 抑制素还可以通过自分泌和旁分泌途径直接作用于性腺而影响其功能[1]。 抑制素的分泌对维持睾丸正常生理功能起着重要作用,可以调节精子的发育和成熟。 抑制素免疫作为一种新型可增强动物繁殖性能的方法,可以中和动物体内内源性抑制素,减弱内源性抑制素对FSH 的抑制作用,从而达到促进FSH 分泌的效果。 抑制素免疫在促进雌性动物排卵及提高胚胎质量、增加产仔数上等方面的研究已取得重大成果[3-5]。
抑制素免疫的相关研究主要集中在其促进雌性动物排卵等方面,而对雄性动物生殖方面的影响研究相对较少,且研究结果存在差异[5]。 本试验采用抑制素主动免疫崇明白山羊雄性断奶羔羊,研究其对公羔羊体重、睾丸发育及激素水平等方面的影响,以期为抑制素免疫在雄性动物生殖中的应用奠定基础。
1 材料与方法
1.1 实验动物的选择及分组
实验动物来自上海市农业科学院草食动物试验站,选取12 头健康、断奶的雄性崇明白山羊羔羊进行试验,平均体重(15.25 ±2.22)kg,平均年龄(113.0 ±2.5)d。 随机分为对照组和免疫试验组,每组6 头。
1.2 免疫流程及样品采集
重组抑制素油乳剂由江苏省农业科学院施振旦教授馈赠。 免疫时,对免疫组羔羊颈部肌肉注射含重组抑制素的油乳剂疫苗,剂量为1 mL∕只,抑制素质量浓度为1 mg∕mL,注射当天记为第0 天。 在第21 天、第42 天、第63 天共进行3 次加强免疫。 对照组注射不含重组抑制素的油乳剂,注射剂量、时间及部位与免疫组相同。
在第0 天、第21 天、第42 天、第63 天及第84 天测量动物的体重(Body weight,BW)及阴囊(Scrotum circumference,SC)周长。 在第0 天、第21 天、第28 天、第42 天、第56 天、第63 天、第70 天、第77 天及第84 天颈静脉采血,血液静置6 h 后1 500 ×g离心15 min,收集血清,-80 ℃保存待测。
第84 天,阉割试验羊,睾丸用生理盐水清洗,清除附带组织后称取睾丸质量(Testes weight,TW)。 切取适当大小的睾丸组织放入mDF 固定液中用于石蜡切片制作,部分组织装入冷冻管,投入液氮中用于组织RNA 提取。
1.3 抑制素抗体检测
抑制素抗体浓度用山羊抑制素α 抗体(Inhibin-α)ELISA 检测试剂盒检测。 试剂盒为卡迈舒(上海)生物科技有限公司产品。
1.4 睾丸组织切片及分析
睾丸组织石蜡切片及HE(Hematoxylin-eosin staining)染色委托上海长海医院进行。 拍照后选取免疫组和对照组睾丸切片中形态完整、形状较规则的生精小管切面,用Image-Pro Express 6.0 测量其管腔面积相对大小。 挑选免疫组和对照组管腔面积相近的生精小管,用Image-Pro Express 6.0 测定单个生精细管切面中精子细胞、支持细胞、精原细胞及管腔周围间质细胞的数量。
1.5 激素水平检测
FSH、黄体生成素(Luteinizing hormone,LH)、睾酮(Testosterone,T)的浓度分别用Goat FSH ELISA Kit、Goat LH ELISA Kit 和Goat T ELISA Kit 进行检测。 试剂盒均为上海润裕生物科技有限公司产品。
1.6 生殖相关基因相对表达量检测
1.6.1 总RNA 的提取
采用北京全式金生物技术有限公司生产的TransZol Up Plus RNA Kit 提取睾丸组织总RNA。 所提取的RNA 的OD260nm∕OD280nm为1.8—2.0。
1.6.2 cDNA 的制备
使用北京全式金生物技术有限公司生产的TransScript ⅡOne-step gDNA Removal and cDNA Synthesis SuperMix 进行逆转录获得cDNA。
1.6.3 荧光定量PCR(qRT-PCR)
按照北京全式金生物技术有限公司生产的TransStart Top Green qPCR SuperMix 说明书进行试验,以1 μL cDNA、F∕R 引物各0.4 μL、2 ×TransStart Top Green qPCR SuperMix 10 μL、ddH2O 8.2 μL 构建20 μL反应体系,在Roche Light Cycler96 仪器上检测。 以GAPDH为内参基因,用2-ΔΔCt计算免疫组内基因相对于对照组表达水平,比较两组间的差异。 qRT-PCR 的引物序列及相应退火温度(Tm)见表1。

表1 qRT-PCR 引物序列及退火温度(Tm)Table 1 Primer sequences and annealing temperature(Tm)of qRT-PCR
1.7 统计分析
采用SPSS 20.0 软件进行统计学分析,数据以“均值±标准差”的形式表示,组间差异用方差分析法,P<0.05或P<0.01 表示差异显著或极显著。
2 结果与分析
2.1 抑制素抗体水平
如图1 所示,从第21 天开始,免疫组动物血清抗体浓度显著或极显著高于对照组。 整个试验期间,免疫组抑制素抗体水平均显著高于对照组。
2.2 抑制素免疫对体重、阴囊周长及睾丸质量的影响
从表2 可以看出,从第21 天开始,免疫组动物的体重增长速度较对照组变缓,但两组之间并无显著差异。第42 天起,免疫组动物阴囊周长增长速度较之前变缓,并且在第63 天开始低于对照组,但两组之间无显著差异。
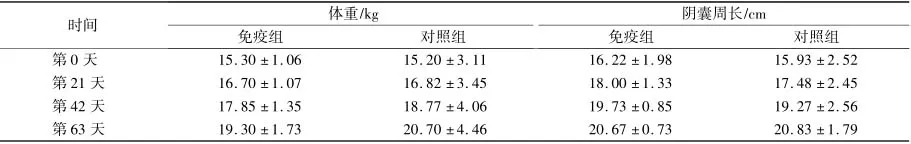
表2 免疫组和对照组动物体重及阴囊周长变化Table 2 Changes of BW and SC in immunized group and control group
由表3 可以看出,在试验第84 天,免疫组动物阴囊周长、睾丸质量及体重与对照组之间无显著差异,动物睾丸质量和体重比值也无显著差异。

表3 第84 天阴囊周长、睾丸质量、动物体重及睾丸质量/体重的比值Table 3 SC,TW,BW and TW/BW ratio of Chongming white goat on the 84th day
2.3 睾丸组织切片
如图2 所示,免疫组和对照组白山羊睾丸组织形态学上并没有显著的差异,生精小管内壁光滑,管腔内均可见精子细胞。 比较免疫组和对照组的睾丸生精小管的管腔切面面积,发现两者没有显著差异,管腔切面内精子细胞、支持细胞、精原细胞及管腔周围的间质细胞计数也没有显著差异(表4)。

表4 单个生精小管管腔切面相对面积及其内精子细胞、支持细胞、精原细胞和周围间质细胞的数量Table 4 The relative lumen area of single seminiferous tubule and the number of spermatocytes,sertoli cells,spermatogonia and peripheral stromal cells in a single seminiferous tubule
2.4 抑制素主动免疫对崇明白山羊公羔羊体内激素分泌的影响
如图3 所示,免疫后,免疫组FSH 及T 激素水平有上升趋势,在二免后7 d,即第28 天达到峰值,并显著高于对照组。 在三免(第42 天)后,即第42—56 天,免疫组FSH 及T 激素水平也有上升趋势,但与对照组之间没有显著差异。 之后,两组FSH 和T 水平呈波动变化,无显著差异。
抑制素主动免疫崇明白山羊对其LH 的分泌并无显著影响。 二免、三免后免疫组LH 激素水平有小幅上升趋势,但与对照组无显著差异。
2.5 抑制素主动免疫对崇明白山羊公羔羊生殖相关基因表达的影响
如图4 所示,免疫组试验羊睾丸组织染色体联会相关基因Dmrtc2 基因表达量极显著高于对照组(3.04 vs 1.00);性腺发育相关基因SOX30 表达量显著高于对照组(1.48 vs 1.00);雄激素受体基因AR表达量显著低于对照组(0.59 vs 1.00)。 而免疫组和对照组之间FSHR(FSH 受体基因)、LHR(LH 受体基因)、GPx4(精子发生相关基因)以及DDX4(减数分裂相关基因)表达量两组之间没有显著差异(1.03 vs 1.00;1.02 vs 1.00;0.83 vs 1.00;0.81 vs 1.00)。
3 讨论与结论
抑制素是一种主要来源于雄性动物睾丸支持细胞和雌性动物卵巢颗粒细胞的糖蛋白激素,其主要生理作用是与激活素共同调控FSH 的合成与分泌[6]。 在雄性动物体内,抑制素主要来源于睾丸,而睾丸以外的副性腺等部位也能分泌低浓度抑制素,并可能通过自分泌或旁分泌的形式发挥作用,与睾酮共同抑制FSH 的分泌,对精子发生等方面进行调控,从而影响公畜繁殖力[7-9]。
抑制素对FSH 具有反馈性抑制作用,抑制素免疫可以降低动物内源性抑制素水平,从而解除抑制素对FSH 的抑制作用,达到提高FSH 水平的效果,从而增加雌性动物卵泡数量,提高排卵率[10-12]。 试验发现,抑制素免疫可以显著提高崇明白山羊体内抑制素抗体水平。 抑制素免疫对雄性动物的相关研究结果并不一致,有研究表明抑制素免疫有利于提高牛及山羊的精子数量、精子密度及活力,降低精子畸形率,从而提高繁殖力[13];但Voge 等[14-15]在6 月龄公羔羊上的研究发现,抑制素免疫对羔羊体重、阴囊周长及睾丸质量均没有显著影响,对血清FSH、LH 和T 水平也没有显著影响,本试验结果与其基本一致。 本试验发现,二免后免疫组血清FSH 及T 水平较对照组出现短暂显著上升现象,而其余时间点FSH 及T 水平两组之间并没有显著差异,可能是由于抑制素免疫降低内源性抑制素水平,从而提高了FSH 水平;T 升高的原因可能是由于在内源性抑制素水平降低后,T 需要增强其对FSH 的抑制作用;抑制素疫苗注射或免疫后,重复免疫可造成动物对疫苗的敏感性降低,无法起到降低内源性抑制素水平的效果,故免疫后期FSH 水平并没有显著上升。
Dmrtc2 基因又名Dmrt7 基因,作为Dmrt 基因家族中重要的一员,其只在哺乳动物性腺中存在并表达,在减数分裂粗线期和双线期之间雄性特有的性染色体联会过渡中扮演关键角色[16-18],故Dmrtc2 基因在精子发生过程中起着重要作用。SOX30 基因是SOX核转录因子基因超家族成员,在整个动物界普遍存在,其主要在睾丸生殖细胞和支持细胞中表达,可能参与了性腺发育、精原细胞分化和精子形成过程[19]。本试验显示,免疫组睾丸内Dmrtc2 基因和SOX30 基因表达水平分别极显著和显著高于对照组,说明抑制素对公羔羊性腺及精子的发生、发育有促进作用。 雄激素受体(AR)作为雄激素发挥生理作用的重要载体,其基因水平限制雄激素的生理功能,从而影响动物性生理的发育[20]。 然而本试验显示,免疫组AR基因的表达水平显著低于对照组,表明抑制素免疫对公羔羊发育起一定抑制作用,相关原因仍需进一步研究阐明。 FSH 和LH 需要分别通过各自受体基因FSHR和LHR方能发挥其生理功能[21],本试验发现免疫组和对照组间FSHR和LHR基因表达水平并无显著差异,说明抑制素免疫并不通过影响FSH 和LH 的分泌来影响公羔羊生殖发育。GPx4 基因是GPxs家族的成员,其在睾丸中高度表达并在精子发生过程中发挥重要作用[22]。DDX4 基因是DEAD-box基因家族的重要成员,在哺乳动物中仅在生殖细胞系中特异性表达,表达产物是精子发生的必需蛋白,与精子发生减数分裂密切相关[23]。 本试验发现抑制素免疫不会影响GPx4 和DDX4 基因的表达水平。
此外,对睾丸组织石蜡切片的观察发现,免疫组和对照组睾丸组织在结构上并没有明显差异,生精小管管腔面积、管腔内各种细胞的数量均没有显著差异。 抑制素免疫对公羔羊生殖系统的影响是相当复杂的,很可能是促进与抑制的共同作用,具体机制还有待进一步研究。
综上,抑制素免疫虽可以显著提高崇明白山羊雄性断奶羔羊血清抑制素抗体水平、睾丸Dmrtc2 和SOX30 基因的表达水平,降低睾丸AR基因的表达水平,并在二免后短暂提高血清FSH 及T 激素水平,但并不影响体重、阴囊周长、睾丸大小及组织结构、睾丸FSHR、LHR、GPx4 及DDX4 基因的表达水平。
