粪便菌群移植通过调节Th17/Treg平衡发挥对帕金森小鼠的保护作用*
2020-08-23叶明张丽娜谢静时鹏刘晓林
叶明, 张丽娜, 谢静, 时鹏, 刘晓林
(蚌埠医学院第一附属医院,安徽 蚌埠 233004)
帕金森病(prkinson's disease,PD)是一种基底神经节运动障碍性疾病[1-2],其病因非常复杂[3-4],通常在PD运动障碍症状出现之前PD患者脑内黑质致密部(substantia nigra pars compacta,SNpc)中多巴胺能神经元就已经丢失[5],这一特征与其多因素病因相结合,阻碍了针对该疾病进展的适当疗法的发展[6]。研究表明,Th17/Treg细胞功能的失衡可加重PD的进程[7]。临床研究发现,在运动障碍发生之前往往会伴随便秘等胃肠道功能障碍[8],提示PD的发生可能与粪便菌群失调相关。Zhou等[9]的研究证明,粪便菌群能够通过增加PD小鼠的多巴胺(dopamine,DA)水平或功能而发挥其神经保护作用,另有报道称粪便菌群能调控Th17/Treg平衡[10]。因此,基于以上研究,本文拟通过采用粪便菌群移植治疗PD小鼠,探讨粪便菌群是否能够通过调节Th17/Treg平衡发挥对PD小鼠的神经起保护作用,以期为临床应用菌群移植法治疗PD提供理论研究基础和新方向。
1 材料与方法
1.1材料
1.1.1主要药物与试剂 MPTP(阿拉丁试剂)、抗生素(美仑生物),小鼠DA、5-羟色胺(5-hydroxytryptamine,5-HT)、白介素-17A(interleukin-17A,IL-17A)、白介素-22(interleukin-22,IL-22)、转化生长因子(transforming growth factor β,TGF-β)、白介素-10(interleukin-10,IL-10)ELISA检测试剂盒(武汉优尔生),Th17细胞特异性转录因子维甲酸相关孤儿受体(retinoid-related orphan nuclear receptor γt,RORγt)抗体(武汉博欧特),BCA蛋白浓度测定试剂盒、全蛋白提取试剂盒、SDS-PAGE蛋白上样缓冲液、羊抗兔IgG-HRP、SDS-PAGE凝胶制备试剂盒、Treg细胞特异性转录因子叉头状转录因子3(forkhead box protein 3,Foxp3)、β-actin抗体(万类生物),TRIpure、Super M-MLV反转录酶、RNase inhibitor、2×Power Taq PCR MasterMix(北京百泰克生物),SYBR Green、抗荧光淬灭剂(北京,Solarbio),PVDF膜(美国,Millipore)、预染蛋白分子量标准(加拿大,Fermentas)、脱脂奶粉(伊利实业)、CD4荧光抗体(美国,NOVUS)、FOXP3荧光抗体(美国,Santa)、RORγt荧光抗体(美国,Thermo Fisher),FITC标记山羊抗小鼠IgG、FITC标记山羊抗兔及Cy3标记山羊抗大鼠IgG、DAPI(碧云天生物)。
1.1.2动物 6周龄健康雄性C57小鼠,体质量(22±1)g(辽宁长生生物科技股份有限公司)。
1.1.3主要仪器 显微镜拍照系统(DP73,OLUMPUS)、显微镜(OLUMPUS,BX53)、水平摇床(WD-9405B,北京六一)、微量移液器(Proline,BIOHIT)、超纯水系统(NW10LVF,Heal Force)、电泳仪(DYY-7C,北京六一)、转移槽(DYCZ-40D,北京六一)、酶标仪(ELX-800,BIOTEK)、电热恒温培养箱(DH36001B,天津泰斯特)、真空干燥箱(DZF-6050,SYSBERY)、荧光定量PCR仪(Exicycler 96,BIONEER)、紫外可见分光光度计(上海佑科,型号UV752N)。
1.2方法
1.2.1实验分组 将18只小鼠适应性喂养1周,昼夜各12 h,温度(22±1)℃,湿度45%~55%,自由饮食。随机均分为正常对照组、粪菌移植对照组、粪菌移植组,每组6只。
1.2.2制作PD模型 造模前9 d,后两组小鼠每日予200 μL抗生素混合物(1 g/L杆菌肽+0.5 g/L庆大霉素+0.2 g/L环丙沙星+1 g/L新霉素+1 g/L青霉素+1 g/L甲硝唑+0.5 g/L头孢他啶+0.5 g/L万古霉素+2 g/L链霉素)灌胃,持续7 d后停止灌胃2 d。造模开始,将MPTP溶于无菌生理盐水中按照每公斤体质量20 g/10 L的剂量对粪菌移植组及移植对照组小鼠腹腔注射,每隔2 h注射1次,共4次,建立PD模型;正常对照组注射等量生理盐水。
1.2.3粪便菌群移植 PD模型造模后第2天开始每日收集正常对照组小鼠的新鲜粪便颗粒,同天收集的所有粪便颗粒立即用无菌PBS(1个粪粒/mL)浸泡15 min,摇匀后4 ℃离心5 min,取悬浮液继续离心洗涤,将最终的菌悬液以40 %无菌甘油稀释至终浓度为20 %,每天取200 μL菌悬液(约含1011CFU/L)对粪菌移植组小鼠灌胃1次,共7 d。粪菌移植对照组采用等剂量PBS与甘油的混合物灌胃。
1.2.4行为学训练 MPTP给药后第5天,制作一个直径为1 cm、长0.5 m并且顶端固定有一个直径为2 cm的球形突起的杆,并且缠上纱布,杆竖直放置,小鼠头朝下放到爬杆顶端的小球上进行爬杆训练;将小鼠的前爪放在水平绳索上进行牵引训练,每天1次,连续3 d。
1.2.5爬杆实验评价各组小鼠行动能力 训练完成后进行正式实验,记录小鼠从开始运动到返回杆底部的时间,对每只鼠进行3次实验,每次间隔5 min,取平均值进行统计[9-11]。
1.2.6牵引实验评价各组小鼠的肌肉力量及平衡能力 训练完成后将小鼠的前爪放在水平绳索上观察10 s,后肢的放置位置评分为1~4分,最低分表示最严重的缺陷。评分标准:动物用两只后爪抓绳子的得4分,一只后爪抓绳子得3分,两只前爪抓绳子得2分,一只前爪抓绳子为1分;每只小鼠进行3次实验,每次间隔5 min,取平均值进行统计[9-11]。
1.2.7实验取材 行为学实验完成后,处死各组小鼠,收集外周血分离血清、同时取小鼠纹状体组织及SNpc进行后续实验。
1.2.8检测小鼠SNpc中ROR-γt、Foxp3 mRNA的表达 采用Real-time PCR,收集各组小鼠SNpc组织样本,提取总RNA、测定RNA浓度及纯度;并反转录成cDNA,以cDNA为模板,β-actin为内参,按照下述体系及条件进行相对定量检测:体系为cDNA 1 μL,上下游引物各0.5 μL,2×Taq PCR MasterMix 10 μL,SYBR GREEN 0.3 μL,dd H2O补足至20 μL;反应条件为94 ℃ 5 min,94 ℃ 10 s,60 ℃ 20 s,72 ℃ 30 s,40个循环后,于72 ℃ 2 min 30 s,40 ℃ 1 min 30 s。引物序列如表1所示。

表1 引物序列Tab.1 Primer sequence
1.2.9SNpc中ROR-γt、Foxp3蛋白的表达 采用Western blot,按照全蛋白提取试剂盒说明书提取样本总蛋白,测定蛋白浓度后,按照蛋白条带大小配置浓缩胶与分离胶行SDS-PAGE电泳,电压80 V,恒压电泳2.5 h;转膜后用脱脂奶粉封闭,然后一抗4 ℃孵育过夜,二抗37 ℃孵育45 min。行ECL底物发光后暗室曝光,之后行抗体剥脱,再次封闭后孵育内参抗体,ECL底物发光后暗室曝光,最后将所有胶片进行扫描后分析目标条带的光密度值。
1.2.10纹状体中DA、5-HT及外周血与SNpc中IL-17A、IL-22、IL-10、TGF-β的表达 分别按照试剂盒说明书步骤检测小鼠纹状体中DA、5-HT及外周血与SNpc中IL-17A、IL-22、IL-10、TGF-β的含量。
1.2.11SNpc中Th17/Treg细胞的表达 制备SNpc组织样本石蜡切片后行免疫荧光双染色,将切片经脱蜡至水进行抗原修复,采用CD4、Foxp3、RORγt荧光抗体共同4 ℃孵育过夜,二抗室温孵育90 min后进行DAPI染细胞核,最后滴加抗荧光淬灭剂,盖玻片封片。于荧光显微镜下观察染色效果,于400×镜下拍照。
1.3统计学分析
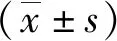
2 结果
2.1爬杆实验和牵引实验结果
爬杆实验结果显示,粪菌移植对照组小鼠的运动能力明显降低,较正常对照组小鼠返回到杆底部的时间明显延长(P<0.01);与粪菌移植对照组比较,粪菌移植组小鼠完成爬杆实验的时间明显缩短(P<0.01),见图1。牵引实验结果表明,粪菌移植对照组小鼠较正常对照组小鼠得分明显降低(P<0.01);与粪菌移植对照组比较,粪菌移植组小鼠的得分增加(P<0.01),见图2。

注:(1)与正常对照组比较,P<0.01;(2)与粪菌移植对照组比较,P<0.01。图1 各组小鼠爬杆实验结果Fig.1 Results pole-climbing test in each group
注:(1)与正常对照组比较,P<0.01;(2)与粪菌移植对照组比较,P<0.01。图2 各组小鼠牵引实验结果Fig.2 Results traction test in each group
2.2SNpc中ROR-γt、Foxp3 mRNA表达
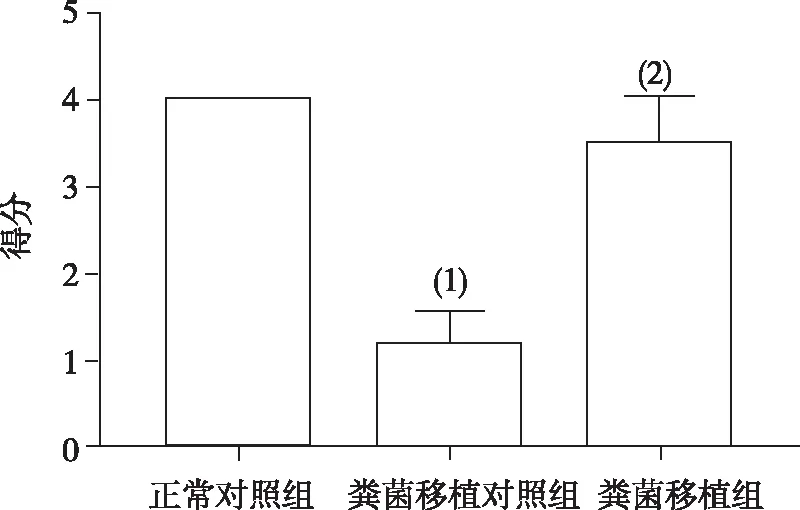
与正常对照组小鼠相比,粪菌移植对照组小鼠SNpc中ROR-γtmRNA和蛋白表达水平明显上调(P<0.01);但与粪菌移植对照组相比,粪菌移植组小鼠ROR-γtmRNA和蛋白的表达明显下调(P<0.01)。与正常对照组小鼠相比,粪菌移植对照组小鼠SNpc中Foxp3 mRNA表达水平明显下调(P<0.01);与粪菌移植对照组小鼠相比,粪菌移植组小鼠Foxp3 mRNA及蛋白表达明显上调(P<0.01),见图3和图4。
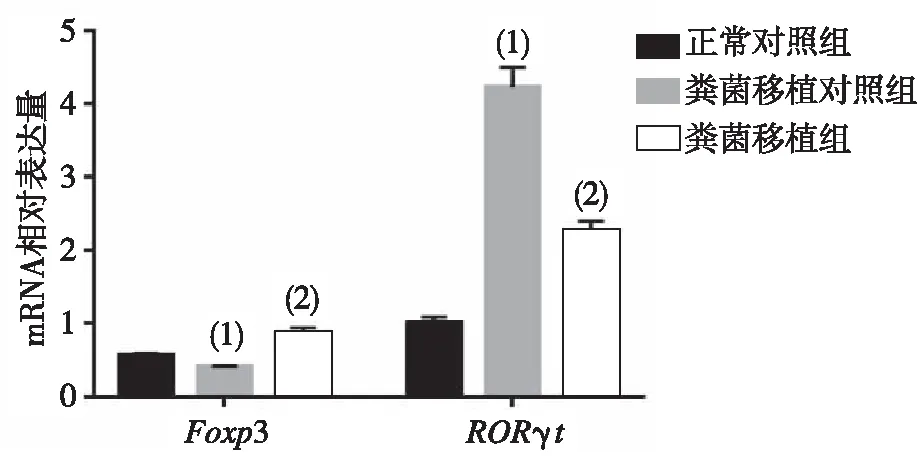
注:(1)与正常对照组比较,P<0.01;(2)与粪菌移植对照组比较,P<0.01。图3 各组小鼠SNpc中Foxp3及RORγt mRAN的表达Fig.3 Expression of Foxp3 and RORγt mRNA in SNpc of each group
2.3纹状体中DA与5-HT含量
如图5所示,与正常对照组相比,粪菌移植对照组小鼠纹状体内DA及5-HT的含量明显降低(P<0.01);与粪菌移植对照组相比,粪菌移植组小鼠纹状体内DA及5-HT的含量明显升高(P<0.01)。表明粪便菌群移植对PD具有一定的保护作用。

注:(1)与正常对照组比较,P<0.01;(2)与粪菌移植对照组比较,P<0.01。图4 各组小鼠SNpc中Foxp3及ROR-γt蛋白表达Fig.4 Expression of Foxp3 and ROR-γt protein in SNpc of each group
2.4外周血及SNpc中IL-17A、IL-22、IL-10及TGF-β含量
与正常对照组相比,粪菌移植对照组小鼠的外周血及SNpc中Th17细胞相关促炎细胞因子IL-17A及IL-22明显上调(P<0.01),而Treg细胞相关抗炎细胞因子IL-10及TGF-β的含量明显下调(P<0.01);与粪菌移植对照组相比,粪菌移植组小鼠的IL-17A与IL-22的含量明显下调(P<0.01),IL-10与TGF-β明显上调(P<0.01),见图6。
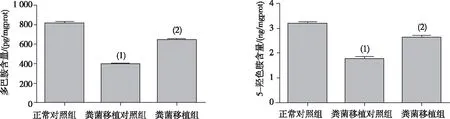
注:(1)与正常对照组比较,P<0.01;(2)与粪菌移植对照组比较,P<0.01。图5 各组小鼠纹状体中DA与5-HT的含量Fig.5 Contents of DA and 5-HT in the striatum of each group
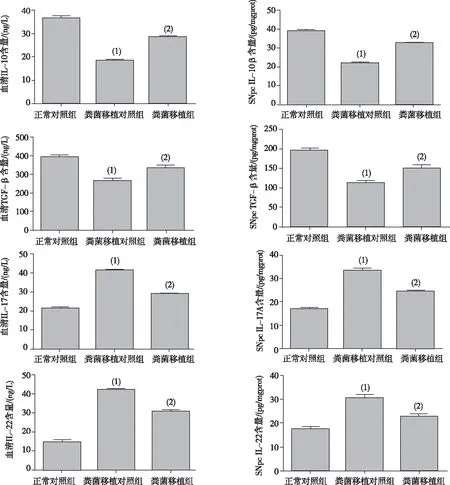
注:(1)与正常对照组比较,P<0.01;(2)与粪菌移植对照组比较,P<0.01。图6 各组小鼠外周血及SNpc中IL-17A、IL-22、IL-10及TGF-β的含量Fig.6 Contents of IL-17A, IL-22, IL-10 and TGF-β in peripheral blood and SNpc of each group
2.5SNpc中Th17/Treg细胞平衡
结果显示,与正常对照组相比,在粪菌移植对照组及粪菌移植组小鼠中有较多的Th17细胞(RORγt+CD4+)侵入到SNpc中;而相较于Th17细胞,Treg细胞仅有少量的表达。与粪菌移植对照组相比,在粪菌移植组小鼠SNpc中Th17细胞(RORγt+CD4+)的数量有所下调,而Treg细胞(Foxp3+CD4+)的数量有所上调,见图7。
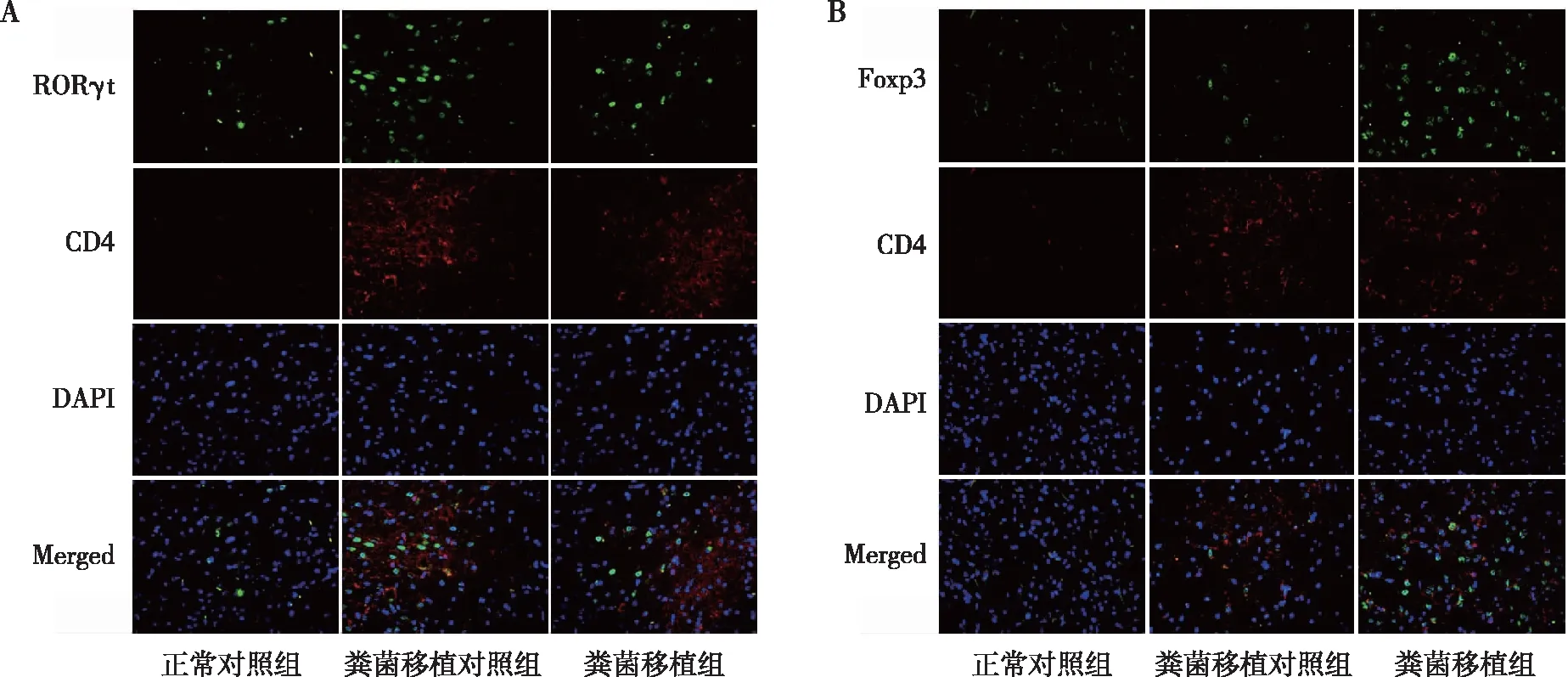
注:A为Th17细胞表达结果,B为Treg细胞表达结果。图7 各组小鼠SNpc中Th17及Treg细胞的表达(IF,×400)Fig.7 Expression of Th17 and Treg cells in SNpc of each group (IF,×400)
3 讨论
PD作为一种常见的神经退行性疾病,其发病机制复杂多样[12-13]。炎症反应是PD的发病机制之一[14],其中起最显著作用的是T细胞[15-16]。已有研究证明,在神经元变性过程中,CD8+和CD4+T细胞能侵入MPTP诱导的小鼠PD模型的大脑中[17-18]。在本研究中确认了MPTP诱导PD的相关特征,包括运动和行为损伤以及黑质纹状体DA及5-HT含量的下降。重要的是,本研究通过免疫荧光双染结果观察到CD4+T细胞在PD小鼠的SNpc中增加。更直接的证据表明,PD小鼠SNpc中Th17细胞数量增加,而Treg仅有较少量的表达,表明Th17细胞迁移并积聚在PD小鼠受损的脑实质中。Th17与Treg细胞分别主要与促炎和抗炎作用相关。侵入到脑实质内的Th17细胞通过释放炎性细胞因子如IL-17和IL-22来促进胶质细胞的活化,而过度活化的胶质细胞在PD动物受损的大脑区域释放更多的炎性介质和更少的神经营养因子,进而产生神经毒性,最后对神经元造成直接损伤[19-20]。此外,Treg可以通过释放抗炎因子如IL-10及TGF-β等调节炎症反应,抑制上述过程,促进MPTP中毒后神经元的存活[21-22]。因此识别CD4+T细胞的不同亚群,调控Th17/Treg细胞的平衡对于PD及其他炎症性疾病具有重要意义。
据报道,粪便菌群的移植在PD、高血压、肌萎缩侧索硬化症[23]、炎症性肠病[24-25]等疾病中均发挥重要作用。本研究证明,在PD小鼠外周血及SNpc中促炎因子表达上调,抗炎因子表达下调。而在将正常小鼠的粪便经过一系列处理后获得的微生物群给予PD小鼠灌胃后,小鼠的PD样行为、纹状体中DA及5-HT及炎症因子的含量被逆转。并且使Th17/Treg功能被调控到相对平衡的状态。综上所述,通过粪便菌群移植的方法可调控Th17/Treg细胞反应的平衡,而不是针对促进中枢神经系统抗原的自动反应性免疫,实际上是在诱导保护性的T细胞反应,而不会由于引起炎症反应导致神经元损伤的二次加重。因此这种采用粪便菌群移植来保护PD神经损伤的治疗方法具有十分重要的科学意义。
