离子液体一步法催化合成4-乙酰胺基苯亚磺酸
2020-08-22梁晓通李国兵沈京华张旭斌
梁晓通,李国兵,沈京华,张旭斌
(天津大学化工学院,天津 300350)
4-乙酰胺基苯亚磺酸(见图1 所示),分子式为C8H9NO3S,可以用来合成对位酯,即对(β-硫酸酯乙基砜)苯胺,后者是染料行业中关键的反应中间体,可用于合成EF 型、KN 型、ME 型等乙烯砜基型活性染料[1-5]。 近年来随着活性染料的快速发展,其需求量日益增长,导致对位酯的需求量也逐年增加。目前对位酯的合成路线主要有β-羟乙基砜路线、巯基乙醇路线、硫醚氧化路线和乙酰苯胺路线等[6-8],其中乙酰苯胺路线是开发时间最长,工业化最成熟的路线。 如图2 所示,以乙酰苯胺为原料,经过氯磺化、还原两步得到对乙酰苯亚磺酸,再经氯乙醇缩合、硫酸水解和酯化等步骤得到对位酯[3,7]。

图1 4-乙酰胺基苯亚磺酸Fig.1 p-Acetamidobenzenesulfinic acid
4-乙酰胺基苯亚磺酸是乙酰苯胺路线合成对位酯过程中的重要中间体,第1 步由氯磺酸对乙酰苯胺进行氯磺化反应,为提高第1 步的收率必须氯磺酸过量,从而产生大量硫酸废液,回收较难,不符合绿色可持续发展理念,同时对设备造成严重的腐蚀[9]。
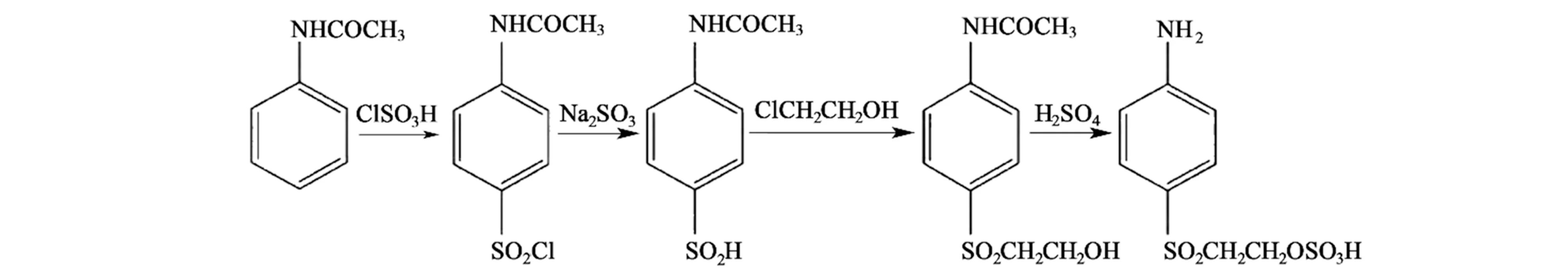
图2 乙酰苯胺路线合成对位酯Fig.2 Synthesis of para-esters by acetaniline
4-乙酰胺基苯亚磺酸与乙酰苯胺相比在对位上多了一个亚磺酸基基团, 而芳香族化合物与二氧化硫的傅克亚磺化反应[10-11]又是得到芳香亚磺酸最直接、最简便的方法之一,在忽略催化剂消耗的前提下原子利用率甚至可达100%[12-13]。 近年来,离子液体作为一种新型的绿色、环保化合物具有一些优异的物化性质:低的饱和蒸气压、良好的溶解性、热稳定性、高电导率和宽电化学窗口等[14-16],可以广泛应用于化工过程的不同方面,不仅是许多反应的优良溶剂, 还可以用作反应的催化剂。 由此产生了将二者结合起来的想法,故提出采用某种离子液体直接催化乙酰苯胺和SO2亚磺化一步合成4-乙酰胺基苯亚磺酸的新工艺(见图3)。

图3 离子液体催化乙酰苯胺与二氧化硫的亚磺化反应Fig.3 Sulfination reaction of acetanilide with sulfur dioxide catalyzed by ionic liquids
1 实验部分
1.1 试剂与仪器
乙酰苯胺,1-丁基-3-甲基咪唑氯盐([BMIM]Cl)、1-乙基-3-甲基咪唑氯盐([EMIM]Cl)、1-丁基-3-甲基咪唑/四氟硼酸盐([BMIM]/BF4)、氯化铝、甲醇、三乙胺盐酸盐(Et3NHCl)、碳酸氢钠,均为分析纯;氯化铁、氯化亚铜、氯化锌质量分数均大于98%;SO2体积分数大于99.99%。
LC-2030 高效液相色谱;Thermo Nicolet 傅里叶红外光谱仪;miorOTOF-QⅡ型液相色谱-高分辨四极杆飞行时间串联质谱联用仪;Renishaw inVia Reflex拉曼光谱仪;Bruker AVANCE Ⅲ型核磁波谱仪。
1.2 离子液体的合成
以合成0.65Et3NHCl/AlCl3为例: 准确称量13.34 g 氯化铝(0.1 mol)加入到通有氮气保护的三口烧瓶中,室温下开启机械搅拌。 20 min 内分5 次将8.95 g 三乙胺盐酸盐(0.065 mol)加入到通有氮气保护的三口烧瓶中,80 ℃下继续反应3 ~4 h 直至得到澄清均一的液体,存放在干燥箱中备用。
1.3 离子液体催化乙酰苯胺亚磺化反应
准确称取2 mmol 乙酰苯胺与已知量的液体催化剂加入到通有氮气保护的50 mL 三口烧瓶中并开启搅拌,待乙酰苯胺完全溶解后通入4 mmol 二氧化硫并在设定温度下反应。 结束后用碳酸氢钠水溶液水解,经抽滤、旋蒸、萃取除去有机配体,再经乙醇萃取、干燥得到白色固体粉末状的4-乙酰苯亚磺酸钠。 相应的4-乙酰苯亚磺酸可以通过使用对钠盐酸化、重结晶获得。
1.4 分析方法
通过比对标准物质与反应后生成物在高效液相色谱中的保留时间以及液相色谱-质谱联用分析来对反应生成物进行定性分析。 利用高效液相色谱,通过配置标准样品的液相外标曲线来对不同反应条件下的产物进行定量分析。
用IR、液相色谱-质谱联用和1H NMR 等分析方法表征产物。
2 实验结果与讨论
2.1 离子液体筛选
烷基取代咪唑类离子液体作为第1 代离子液体有着悠久的研究历史,同时因为其优良的物化性质而被广泛应用于各类反应当中。 首先合成了几种具有代表性的基于咪唑类阳离子的离子液体并用于催化乙酰苯胺与二氧化硫的亚磺化反应,离子液体在反应过程中既是催化剂,也是溶剂(表1)。

表1 不同离子液体的催化性能Table 1 Catalytic performance of different ionic liquids
反应条件:采用乙酰苯胺为2 mmol,温度为90 ℃,反应时间为4 h,催化剂为4.5 g,二氧化硫为4 mmol。
从表1 中的数据可以看出,中性的1-丁基-3 甲基咪唑/四氟硼酸盐类([BMIM]/BF4)与显Lewis酸性的1-丁基-3 甲基咪唑/三氯化铁型离子液体(记为[BMIM]Cl/FeCl3)对反应都没有催化作用。而Lewis 酸性更强的[BMIM]Cl/AlCl3离子液体则表现出了一定的催化活性,通过HPLC 在体系中检测到了相应亚磺酸产物的生成,但反应足够长的时间乙酰苯胺也无法完全彻底转化,在使用的实验条件下最终转化50%左右。 1-乙基-3-甲基咪唑/三氯化铝([EMIM]Cl/AlCl3)离子液体也表现出了类似的反应结果,咪唑阳离子的碳链长度对其在本反应中的催化性能影响不大。 根据这些结果推测选用催化剂的Lewis 酸性强弱会对其催化性能有造成一定影响。
为了验证猜测,选取合成了Et3NHCl/CuCl、Et3NHCl/FeCl3、 Et3NHCl/ZnCl2和 Et3NHCl/AlCl3等几种基于三乙胺盐酸盐(Et3NHCl)与金属氯化物的离子液体用于反应,结果列于表2。
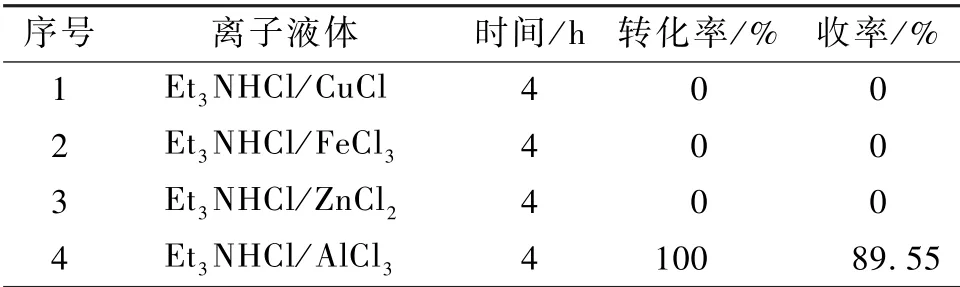
表2 不同基于三乙胺盐酸盐(Et3NHCl)与金属氯化物的离子液体的催化性能Table 2 Catalytic performance of different ionic liquids based on Et3NHCl and chloride metal
根据相关文献报道所使用的离子液体Lewis 酸性强弱顺序与其所含金属氯化物的酸性强弱顺序一致:CuCl<FeCl3<ZnCl2<AlCl3。 在选用的4 种离子液体催化剂中,只在Lewis 酸性最强的Et3NHCl/AlCl3体系中检测到了产物,其他几种催化剂对反应都没有活性。 0.55Et3NHCl/AlCl3[n(Et3NHCl) ∶n(AlCl3)= 0.55 ∶1.00,记为0.55Et3NHCl/AlCl3]表现出了十分优良的催化性能,90 ℃下乙酰苯胺反应4 h 之内转化完全,液相收率达到89.55%。 这些实验结果表明离子液体催化剂Lewis 酸度的大小在催化效果当中扮演者十分重要的角色,其Lewis 酸度必须高于一定的程度才能催化二氧化硫参与的亚磺化反应。 综上所述,离子液体在二氧化硫的亚磺化反应中表现出了优良的反应性能,同时克服了传统反应的诸多弊端,在之后的实验中选取Et3NHCl/AlCl3体系做更深入的研究。
2.2 Et3NHCl/AlCl3 物质的量配比对催化性能的影响
氯铝酸型离子液体是一个动态平衡的体系,液体中存在的反应平衡以及不同物系结构是可以通过改变组成离子液体化合物的物质的量配比来进行调控的,同时其自身物化性质也会发生很大的改变。
采用乙酰苯胺为2 mmol,温度为90 ℃,反应时间为4 h,催化剂为4.5 g,二氧化硫为4 mmol,合成n(Et3NHCl)/n(AlCl3) 分 别 为0.55、0.65、0.75、0.85、0.95 和1.00 的离子液体应进行实验。 结果见表3。

表3 Et3NHCl/AlCl3 不同物质的量配比对亚磺化反应的影响Table 3 Influence of different Et3NHCl/AlCl3 molar ratio on sulfination
从表3 中的数据可以看出,当Et3NHCl/AlCl3物质的量配比大于0.85 时,体系中无法检测到相应产物的生成,直到使用配比为0.75 的催化剂时反应才得以发生, 乙酰苯胺在 4 h 内的转化率为29.83%。 随着物质的量配比的降低,离子液体表现出了更好的催化性能[18],当使用配比为0.65 的催化剂时,在相同的时间下乙酰苯胺的转化率由29.83% 提高到了92.58%,而使用配比0.55 的催化剂在相同的实验条件下乙酰苯胺则能彻底转化完全。 此外,Et3NHCl/AlCl3自身物理性质也随着配比的改变而发生了变化,当物质的量配比大于0.65时催化剂的在室温下(≈10 ℃)为固态,而当配比小于0.50 时,在离子液体的制备过程中一直会有不溶固体存在而无法得到均一液相,因此没有选用其来进行反应。
因此,在后续实验当中选取0.55Et3NHCl/AlCl3作为催化剂的最适宜物质的量配比。
2.3 反应温度对催化性能的影响
离子液体有着良好的热稳定性与低蒸气压,在高温、高真空度的环境下也不会发生分解与挥发,与传统有机溶剂相比有着更宽广的应用范围。 而温度对反应速率、目的产物的选择性等都有着很大的影响。
采用乙酰苯胺为2 mmol,反应时间为4 h,催化剂为4.5 g,二氧化硫为4 mmol,Et3NHCl/AlCl3物质的量配比为0.55,选取10、30、50、70、90 和110 ℃进行反应。 结果见图4。
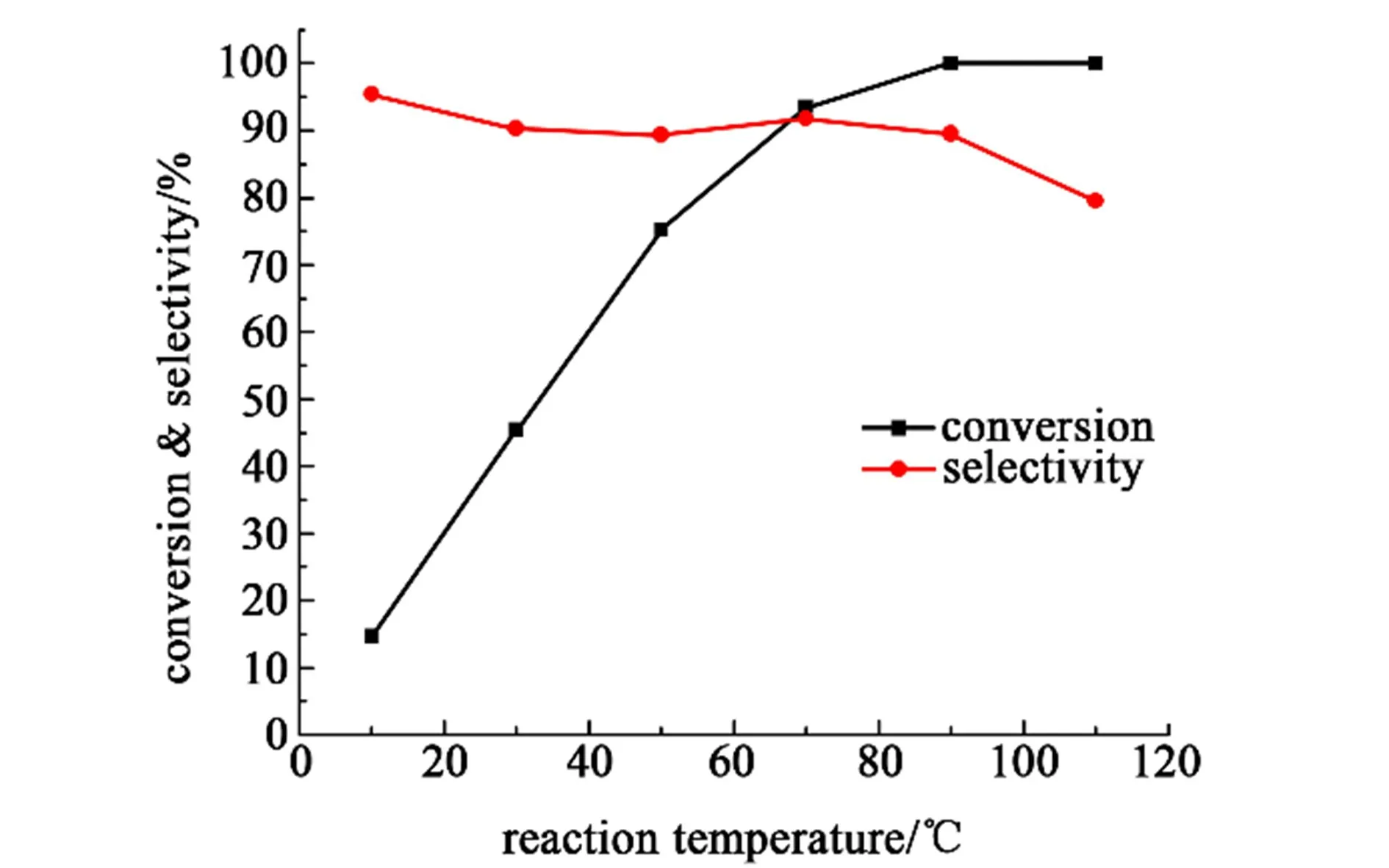
图4 反应温度对亚磺化反应的影响Fig.4 Influence of reaction temperature on sulfination
从图4 中可以看出,反应在低温时进行得十分缓慢,10 ℃下反应4 h 乙酰苯胺转化率仅为14.67%,随着温度的升高在相同的反应时间内反应物转化率不断提高,当温度高于90 ℃时反应能彻底完成。 反应在10 ℃时几乎没有副反应的发生,HPLC 检测液相选择性高达95.46%,而在30 ~90 ℃的温度范围内选择性会有1 个小幅的下降,但也都在90%上下波动。 当温度上提高到110 ℃时选择性会有1 个急剧的下降,这可能是因为产物亚磺酸长时间处于高温下不稳定而发生了小部分的分解,因此选择90 ℃作为最适宜反应温度。
2.4 反应时间对催化性能的影响
采用乙酰苯胺为2 mmol,反应温度为90 ℃,催化剂为4.5 g,二氧化硫为4 mmol,n(Et3NHCl)/n(AlCl3)为0.55,进行0.5、1.0、1.5、2.0、3.0、4.0、6.0、8.0、12.0 和18.0 h 反应实验。 结果见图5。

图5 反应时间对亚磺化反应的影响Fig.5 Influence of reaction time on sulfination
从图5 中可以看出:在选定的实验条件下乙酰苯胺在最开始的0.5 h 内能转化50%左右,之后反应速率逐渐有所减慢,在4.0 h 之内反应物彻底转化完全。 而在使用二氯乙烷作为溶剂、AlCl3作为催化剂的传统反应中,前1.0 h 内乙酰苯胺转化率不到20%,10.0 h 内转化率达到77%,但反应速率已经变得十分缓慢,需要超过24.0 h 的时间来达到完全反应。 Et3NHCl/AlCl3离子液体体系中除了反应物几乎没有其他杂质能参与反应,随着反应时间的变化对产物的选择性几乎不变,因此选择4.0 h 作为最适宜反应时间。
2.5 催化活性组分的探究
20 世纪初Knoevenagel 和Kenner[19]首次报道了以AlCl3催化二氧化硫与芳香族化合物的亚磺化反应,但并未涉及太多有关机理方面的研究,而仅提出向反应体系中引入HCl 气体能将二氧化硫活化,更有利于之后在催化剂的作用下进攻反应底物生成相应的亚磺酸产物,在之后很长一段时间内都没有关于二氧化硫参与的傅克亚磺化反应的报道。
Szilárd 等[20]利用传统氯铝酸与铝铁酸离子液体催化了苯与乙酰氯的傅克酰基化反应,利用原位红外技术详细地研究了整个反应过程不同键的生成与断裂以及存在的中间产物,并与其在二氯乙烷中的反应进行了对比(见图6)。 反应当中最关键的步骤是离子液体催化剂对乙酰氯的活化,体系中的Lewis 酸活性组分会先与乙酰氯络合,生成四氯合金属阴离子与乙酰基正离子中间体,而后再由正离子进攻苯环得到相应产物。

图6 MCl3(M=Al,Fe)催化苯与乙酰氯傅克酰基化反应的可能机理[20]Fig.6 Proposed mechanism of the Friedel-Crafts acetylation of benzene with acetyl chloride in the presence of MCl3 (M=Al, Fe)[20]
本课题组之前利用AlCl3催化了二氧化硫替代物(DABSO)与一系列芳香族化合物的亚磺化反应,并同样运用原位红外光谱对其反应过程进行监测,提出一种可能的反应机理:在反应过程当中反应底物与生成的亚磺酸产物都会与AlCl3发生络合作用;AlCl3会先与DABSO 相络合,随后络合产物分解为DABCO 与整个反应过程中最重要的中间体AlCl3·SO2,而AlCl3·SO2与文献[20]中提到的AlCl3活化乙酰氯得到的中间体类似,最终在催化剂的作用下进攻底物得到相应产物。
在先前研究得到的结论以及对二氧化硫参与的亚磺化反应体系深入研究的基础上,利用拉曼光谱对液体配位络合物催化的亚磺化反应机理进行了研究(图7)。 首先是寻找二氧化硫的特征振动峰在拉曼谱图中的位置,从图7a)中可以看出在向二氯乙烷中通入二氧化硫后,在1 150 cm-1处出现的峰代表典型的二氧化硫S—O 键的对称伸缩振动(v1SO2),这与文献中报道的液态二氧化硫振动峰位置一致。 图7b)表示向AA/AlCl3液体体系中通入二氧化硫前后的变化,当二氧化硫通入液体后同样出现了S—O 的特征振动峰,但峰位置向高波数发生了偏移,证明二氧化硫与液体体系中的组分发生了相互作用。 此外,体系中活性组分[Al2Cl7]-的强度减弱而中性离子[AlCl4]-强度增强, 表明[Al2Cl7]-与Lewis 碱相结合后转化为[AlCl4]-,这与先前研究的基于DABSO 反应体系中催化剂对DABSO 的活化步骤类似。 综合上述实验现象与分析,对本研究催化体系中二氧化硫与乙酰苯胺亚磺化反应的机理做出如下解释:液体催化剂体系中的Lewis 酸活性组分[Al2X7]-会先与通入的二氧化硫相结合而将其活化, [Al2X7]-转化为相应的[AlX4]-并生成SO2和AlX3的加和产物,而二氧化硫的加和产物是整个反应过程中的重要中间体,随后会进攻苯环发生亲电取代反应,生成与催化剂相络合的亚磺酸产物。
当催化剂的物质的量配比为1.0 时,催化剂体系中的阴离子全部为[AlCl4]-,反应体系显中性。随着催化剂物质的量配比的降低,中性的[AlCl4]-会向具有Lewis 酸性的[Al2Cl7]-转化,体系Lewis酸度逐渐增强。 图8 是各催化剂在可见激发光下的拉曼谱图,在300 ~400 cm-1间的2 个明显的振动峰在体系中的强度。 从图8 中可以看出随物质的量配比的降低,[AlCl4]-强度降低,[Al2Cl7]-强度升高,离子液体Lewis 酸度增强,表现出更优越的催化活性,这些结果同样表明催化剂需要达到一定的Lewis 酸度才能使反应发生。
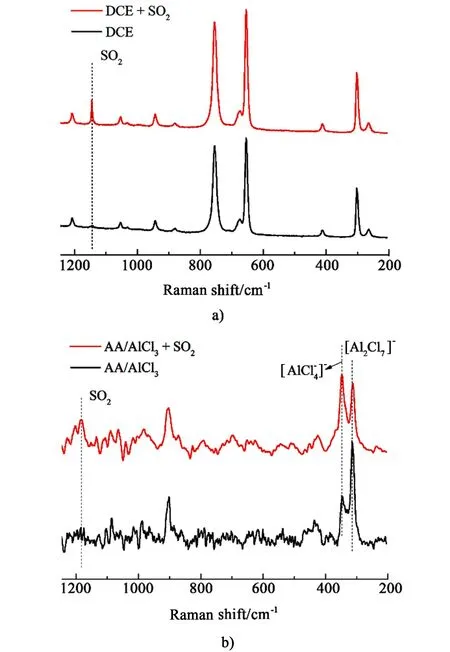
图7 溶剂吸收二氧化硫前后的拉曼谱图Fig.7 Raman spectra of the solvents before and after SO2 absorption
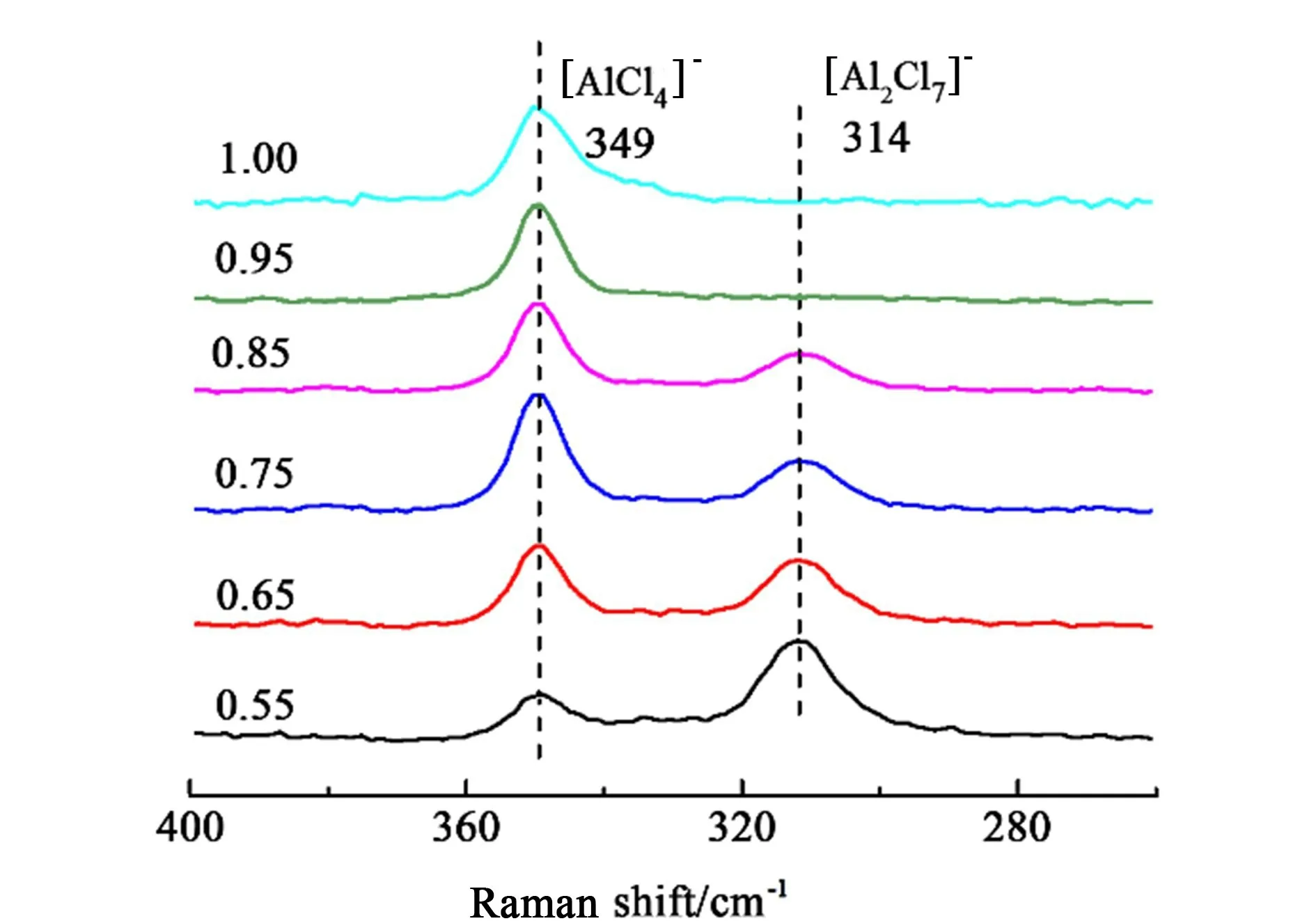
图8 不同物质的量配比Et3NHCl/AlCl3 的拉曼谱图Fig.8 Raman spectra of Et3NHCl/AlCl3 as a function of the molar ratio
图9 给出了 Et3NHCl/AlCl3体系中存在的平衡反应,具体实验结果列于表4。

图9 Et3NHCl/AlCl3 体系中存在的平衡反应Fig.9 Equilibrium reaction in Et3NHCl/AlCl3 system
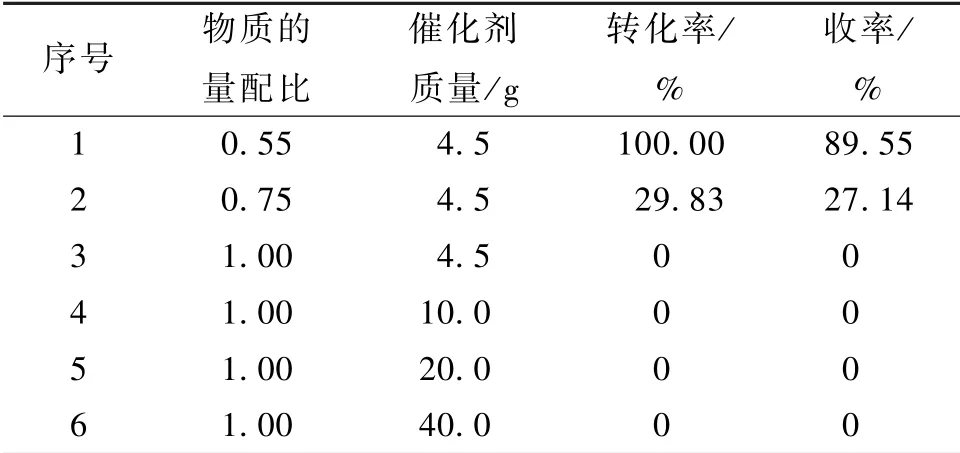
表4 不同物质的量配比及催化剂用量对反应性能的影响Table 4 Effect of different molar ratios and catalyst amount on reaction performance
从图9 可以看出随物质的量配比的降低,平衡向[Al2Cl7]-进行;从表4 中可以看出,在相同质量催化剂条件下物质的量配比越低,离子液体催化效果越好;同时体系中如果存在AlCl3,随催化剂用量的增加,体系的Lewis 酸性必然可以增强至达到反应进行的酸强度进而发生反应。 这些结果表明在亚磺化反应中真正起催化作用的是阴离子铝物系[Al2Cl7]-而不是AlCl3[21]。 另外,Wilkes[22]验证了1-丁基吡啶氯铝酸型离子液体中不存在AlCl3或Al2Cl6。
2.6 产物表征
通过液相色谱保留时间对比、液质联用、红外、核磁验证了产物4-乙酰胺基苯亚磺酸结构,见图10 ~图12。
通过比对标准物质与反应后生成物在高效液相色谱中的保留时间以及液相色谱-质谱联用确认生成物为4-乙酰胺基苯亚磺酸。
4-乙酰胺基苯亚磺酸红外核磁结果。1H NMR (400 MHz, DMSO-d6): δ10.227 3 (s, 1H,NH), 7.767 6 (d, J=8.5 Hz, 2H, Ar-H), 7.597 1 (d, J=8.6 Hz, 2H, Ar-H), 2.077 6 (s, 3H,CH3);109, 3 059, 2 453, 1 635, 1 608, 1 585, 1 540, 1 492, 1 400, 1 326, 1 092, 822, 586, 555; HRMS (ESI-): m/z 198.025 3。
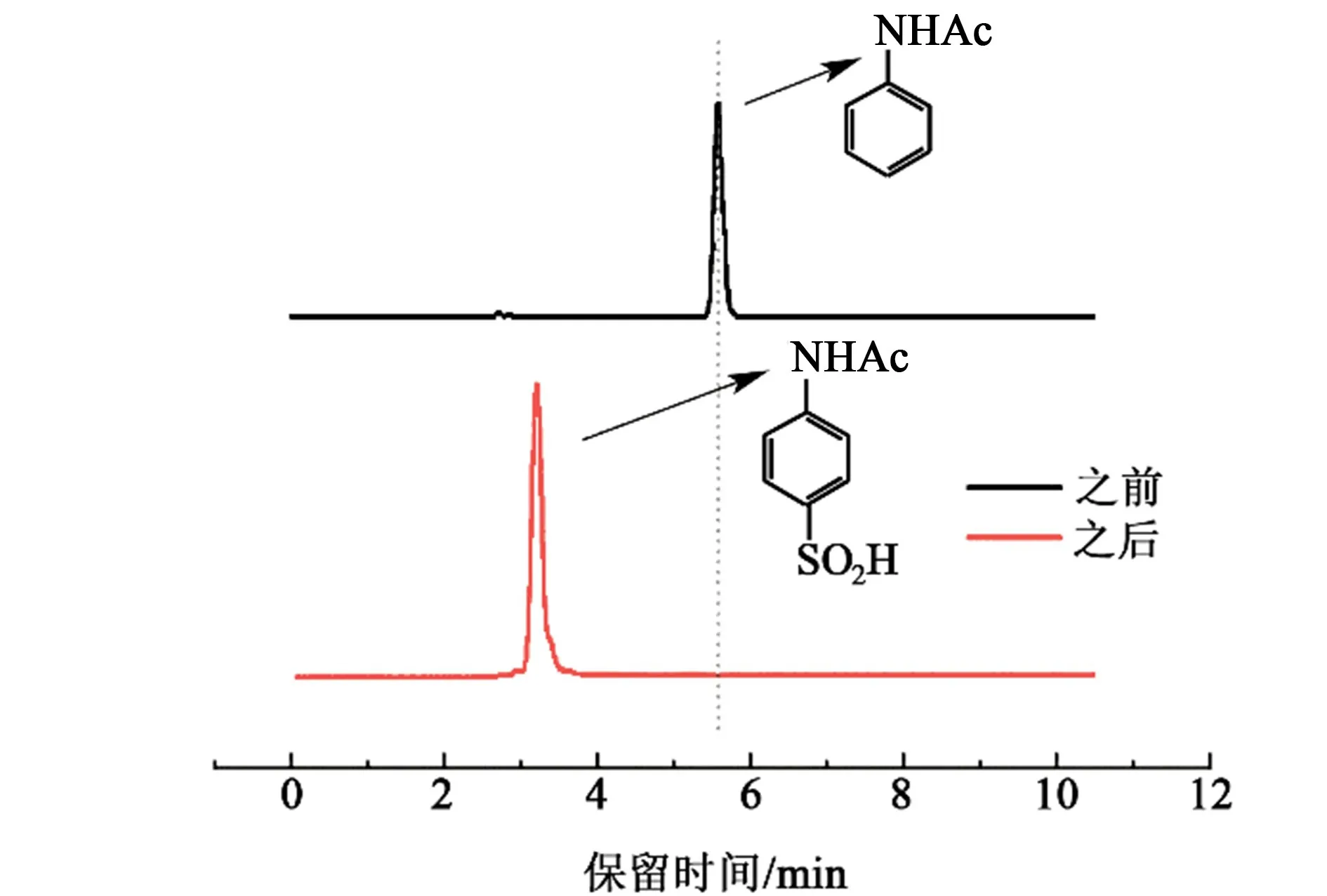
图10 亚磺化反应前后混合物液相谱图Fig.10 LC spectrum of the mixture before and after sulfination reaction

图11 反应后混合物的液相色谱-质谱联用谱图Fig.11 LC/MS spectrum of the mixture after reaction

图12 产品的核磁共振图谱Fig.12 NMR atlas of products
3 结论
1)采用离子液体催化乙酰苯胺亚磺化反应直接合成4-乙酰胺基苯亚磺酸,其中离子液体在反应当中既做溶剂又做催化剂。
2)合成了一系列不同种类的离子液体,其中n(Et3NHCl)/n(AlCl3)为0.55 时,催化性能最佳。90 ℃下乙酰苯胺在4 h 内反应完全,液相收率达到89.55%。
3)通过对中性离子液体以及具有梯度Lewis 酸强度离子液体反应结果的比较,证明了催化剂必须要具备足够的Lewis 酸强度才能催化亚磺化反应。通过拉曼光谱研究了Et3NHCl/AlCl3体系中存在的物系与平衡反应,在n(Et3NHCl)/n(AlCl3)为1.00时体系中阴离子只有中性的[AlCl4]-,随着物质的量配比的降低,[AlCl4]-会向酸性[Al2Cl7]-转化,催化剂表现出了更好的催化活性;对催化剂体系的活性组分进行了研究,验证了在反应体系中真正起催化作用的是[Al2Cl7]-而不是AlCl3。
