香芹酚-酪蛋白纳米颗粒制备及其对枇杷果实炭疽病的抑制作用
2020-08-22花春阳李卓烨覃定奎杜琪珍
花春阳,李卓烨,金 鹏,覃定奎,杜琪珍
(浙江农林大学农业与食品科学学院,浙江 杭州 311300)
病原微生物引起的腐烂是造成果蔬采后损失的主要原因,由此带来巨大的经济损失[1],因此,研发用于果蔬保鲜的安全防腐剂至关重要[2]。近年来,纳米技术在采后果蔬保鲜方面受到关注[3]。其研究主要集中在以下两方面:一方面,在果蔬包装材料中使用金属氧化物类纳米颗粒(nanoparticles,NPs)(如纳米TiO2、纳米ZnO、纳米CuO等)可以间接避免果蔬在贮运过程中受到病菌污染;另一方面,在果蔬表面喷涂纳米化的抗菌剂(如纳米化肉桂醛、纳米化葡聚糖)可以直接预防果蔬的腐败[4]。
香芹酚(carvacrol,CL)是一种酚类单萜类化合物[5],广泛存在于牛至、百里香、胡椒、佛手柑等植物的精油中。在植物来源的酚类化合物中,由于CL存在游离羟基和酚基,其抗菌活性高于其他挥发性化合物[6]。然而,CL因具有挥发性、疏水性而容易被氧化和热降解,导致应用时分散不均、时效短和稳定性差。此外,CL的疏水性也使其在食物保鲜过程中易与脂质和蛋白质结合,从而降低抗菌效果[7]。因此,纳米和微乳液包埋(如纳米醇质体、纤维素衍生物[8]或生物聚合物制备的微球、壳聚糖[9]和交联的明胶[10]制备的纳米复合物)成为解决上述问题的重要策略。
酪蛋白(casein,CS)是牛乳中主要的乳蛋白(占牛乳蛋白的80%),在食品和饮料行业中是一种低成本的食品级添加剂[11]。天然酪蛋白在溶液中可以自组装成纳米微团结构,其直径大约为80~400 nm,已被广泛用作疏水试剂输送系统的有效纳米载体[12-13]。本实验通过低能量、简单的自乳化技术,利用低成本的食品级酪蛋白制备香芹酚-酪蛋白纳米颗粒(CL-CS-NPs),对其物理性质进行测定,并对其在枇杷果实上的抗菌效果进行分析,以期为CL-CS-NPs的生产及其采后预防果实腐烂提供科学依据。
1 材料与方法
1.1 材料与试剂
100 kg成熟‘白沙’枇杷(Eriobotrya japonica(Thunb.) Lindl.cv.Baisha),采自浙江省杭州市余杭区琵琶湾枇杷园,3 h内运回实验室,挑选颜色较一致、表面无缺陷的果实用于实验。
酪蛋白(纯度大于98%) 美国Sigma-Aldrich公司;CL(纯度99%) 上海源叶生物科技有限公司;乙醇、磷酸、乙醚均为国产分析纯;甲醇为国产色谱纯。
LB培养基(含10 g/L色氨酸、5 g/L酵母提取物、10 g/L氯化钠和质量分数1%葡萄糖)。
1.2 仪器与设备
Zetasizer Nano ZS90型纳米粒径电位分析仪 英国马尔文仪器有限公司;TGL-16G型高速离心机 上海安亭科学仪器厂;KQ5200B型超声波清洗器 昆山市超声仪器有限公司;XW-80A漩涡混合仪 上海驰唐电子有限公司;ZNCL-GS磁力搅拌器 杭州明远仪器有限公司;JY92-IIN超声仪 上海沪析仪器有限公司;ME104E/02电子天平 瑞士梅特勒-托利多仪器有限公司;高效液相色谱系统 日本Shimadzu公司;H-9500E透射电子显微镜日本日立公司。
1.3 方法
1.3.1 游离CL、酪蛋白+CL混合物和CL-CS-NPs的制备
游离CL:将CL溶于乙醚配制成一定的质量浓度,即得到游离CL。
酪蛋白+CL混合物:将游离CL添加于酪蛋白溶液(2 mL),漩涡混匀3 min即得到酪蛋白+CL混合物。
CL-CS-NPs:将酪蛋白完全溶解于去离子水中,配制成终质量浓度20 mg/mL溶液。CL溶于无水乙醇中,配制成终质量浓度300 mg/mL溶液。将10 mL酪蛋白溶液置于50 mL玻璃烧杯中,在磁力搅拌器上搅拌(500 r/min),同时将CL溶液以10 μL的体积分多次加入到酪蛋白溶液中(至CL质量浓度分别为3、6、9、12、15 mg/mL),然后超声处理5 min(22 Hz、50 W),即得到CL-CS-NPs分散液。将CL-CS-NPs置于冷藏室(4~10 ℃)贮存备用。
1.3.2 CL-CS-NPs分散液中CL包埋率测定
取1.3.1节制备的不同CL质量浓度CL-CS-NPs分散液(5 mL),3 000×g离心10 min,使游离的CL(不溶于水)与纳米分散液分层,在纳米分散液层取50 μL,加450 μL甲醇沉淀蛋白并提取CL,甲醇提取液用高效液相色谱外标法测定待测液CL质量浓度。高效液相色谱测定条件为: C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇/水/磷酸(30∶70∶0.01,V/V),流速为1 mL/min,柱温为30 ℃,检测波长为280 nm。离心后纳米分散液中的CL质量即为CL-CS-NPs包埋的CL质量。包埋率按式(1)计算。

1.3.3 CL-CS-NPs物理性质的测定
将500 μL CL-CS-NPs颗粒分散液用去离子水稀释成5 mL,用Zetasizer Nano ZS90型纳米粒径电位分析仪测定CL-CS-NPs的粒径分布、多分散指数(polydispersity index,PDI)和Zeta电位。测定温度25 ℃、激光波长633 nm。
1.3.4 CL-CS-NPs纳米粒微观结构观察
首先用纯水稀释的CL-CS-NPs分散液,然后将其吸附到附着在金属样品网格的碳涂层膜上。接着用吸水纸去除多余样品,并用一滴染色液(质量分数2%磷钨酸)覆盖网格。染色数分钟后去除多余的溶液。待样品彻底风干,然后用H-9500E透射电子显微镜对CL-CS-NPs进行微观结构观察。
1.3.5 CL-CS-NPs释放性分析
将CL-CS-NPs分散液(CL 10 μg/mL)或酪蛋白+CL混合物(CL 10 μg/mL)分别喷洒在固体LB培养基(固化前体积为5 mL)表面(10 μL/cm2),然后置于28 ℃培养箱中,每隔24 h取出一批培养皿,将培养皿中的培养基取出,置于三角瓶中,用20 mL乙醚提取CL(提取3 次),合并提取液,氮吹挥发乙醚,用适量甲醇溶解提取物,通过高效液相色谱测定甲醇溶液中CL质量浓度,并计算培养基中CL存留量。游离CL用乙醚溶解并喷洒在固体培养基表面(10 μL/cm2),待乙醚挥发后置于28 ℃培养箱中,CL存留量分析同处理组。
1.3.6 病菌培养
参照本课题组前期的实验方法[14],从腐烂枇杷果实中分离出炭疽菌(Colletotrichum acutatum)。然后将菌丝体在28 ℃的LB琼脂培养基上预培养5 d作为种子。
1.3.7 CL-CS-NPs离体抗菌活性分析
CL-CS-NPs、酪蛋白+CL混合物抑菌活性测定:在培养基表面分别喷洒CL-CS-NPs分散液10 μL/cm2(CL 10 μg/mL)、酪蛋白+CL混合物10 μL/cm2(CL 10 μg/mL)和1.3.5节CL-乙醚,之后在培养基中央接种5 μL孢子悬浮液,然后在28 ℃下培养。在没有CL的情况下进行相同的对照实验。每隔24 h测定菌斑的直径,计算菌斑增长率(式(2))。病斑增长率实验重复3 次。

1.3.8 CL-CS-NPs对枇杷炭疽病的抗菌活性分析
用无菌生理盐水擦洗枇杷果实表皮,用无菌注射针在每果中部接种5 μL炭疽菌孢子悬液(1×105孢子/mL)。将含等量CL(10 μg/mL)的酪蛋白+CL混合物样品溶液和CL-CS-NPs分散液喷在果实表面。每组10 个枇杷果实,重复3 次。对照组用无菌蒸馏水处理。随后,所有处理过的样品在28 ℃的无菌室中储存。测定并记录疾病发生率和病变直径。将接种孔处出现腐烂斑点和果肉颜色变化的枇杷定义为发病枇杷。
1.4 数据统计分析
实验采用完全随机设计,用SPSS 18.0统计软件采用单因素方差分析对数据进行显著性分析,结果以平均值±标准偏差表示。采用Duncan法进行多重比较,P<0.05认为具有显著性差异。
2 结果与分析
2.1 CL-CS-NPs的制备、表征与相对抑菌活性
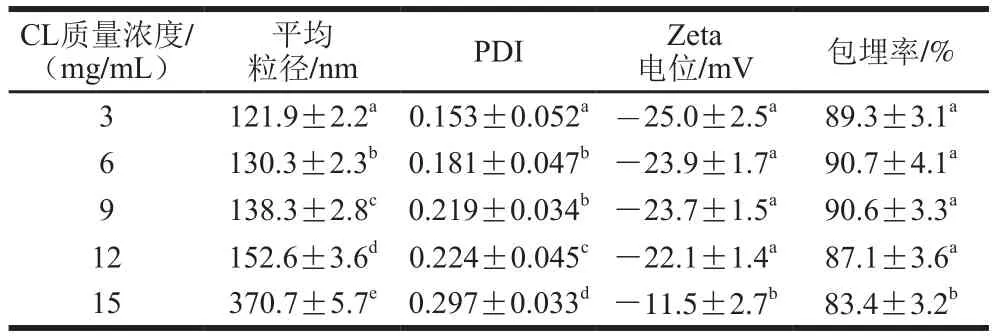
表1 不同CL质量浓度制备的CL-CS-NPs的特性及包埋率Table 1 Characterization and encapsulation rate of CL-CS-NPs prepared at different CL concentrations
如表1所示,CL-CS-NPs的粒径、分散性(PDI)、Zeta电位和包埋率与制备时添加的CL质量浓度有关。CL质量浓度从3 mg/mL增加到12 mg/mL,CL-CS-NPs的粒径仅从121.9 nm增加到152.6 nm;但CL质量浓度增加到15 mg/mL时,纳米颗粒粒径则增加到370.7 nm,表明过量CL诱发了纳米颗粒的聚集。纳米颗粒的聚集导致分散液的透光率显著降低(图1A)。CL-CS-NPs的Zeta电位绝对值与CL的粒径呈负相关,表明CL导致纳米颗粒所带负电荷的减少。Zeta电位与纳米颗粒的稳定性有一定的相关性,通常对粒径相同的粒子,所带电荷越多,相互之间的斥力越大,分散液体系的稳定性越高。本研究中只有CL质量浓度增加到15 mg/mL才导致Zeta电位发生显著改变,因此,可以认为CL质量浓度3~12 mg/mL制备的纳米颗粒稳定性与所带电荷的关系不大。CL质量浓度在3~12 mg/mL,纳米颗粒的包埋率变化不显著,但CL质量浓度增加到15 mg/mL时,包埋率降低,且与其他质量浓度之间有显著性差异(P<0.05)。
不同CL质量浓度制备的纳米分散液在相同CL添加量时对炭疽菌的抑制活性如图1B所示,结果表明,15 mg/mL CL制备的纳米颗粒抑菌活性较其他质量浓度CL制备的纳米分散液显著降低(P<0.05)。从表1中可以看出,15 mg/mL CL制备的纳米颗粒的粒径比其他几种质量浓度制备的粒径大1 倍以上,提示粒径对抑菌活性有较大的影响。大的药物装载量在制备和使用时更经济,因此,从药物装载量和抑菌活性两方面综合考虑,采用12 mg/mL CL是较理想的,透射电子显微镜观察表明,该纳米分散液中的纳米颗粒呈球形,均匀性较好(图1C)。
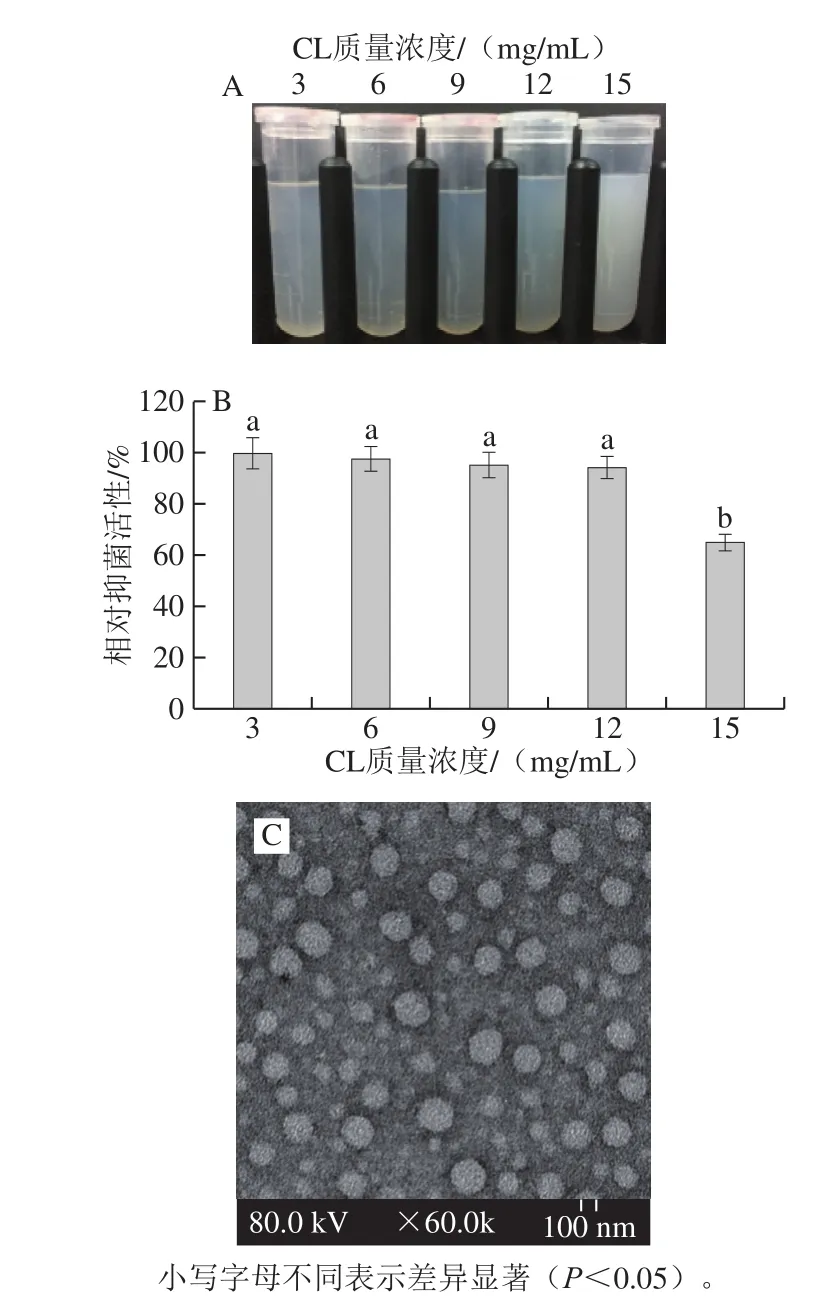
图1 CL-CS-NPs纳米分散液(A)及其相对抑菌活性(B)和CL 12 mg/mL制备的样品透射电子显微镜图(C)Fig.1 Samples of CL-CS-NPs nanodispersions (A) and their relative anti-fungal activity (B), and transmission electron microscope of CL-CS-NPs nanodispersion prepared with 12 mg/mL CL (C)
2.2 CL-CS-NPs的CL释放性
为了研究CL-CS-NPs的CL缓释效果,测定了28 ℃下不同时间LB固体培养基上CL存留量。如图2所示,游离CL处理、酪蛋白+CL混合物处理、CL-CS-NPs处理CL接近挥发完全的时间分别为2、4 d和6 d,CL-CS-NPs处理组的缓释时间较游离CL处理组和酪蛋白+CL混合物处理组分别延长了4 d和2 d。表明纳米化CL缓释效果明显,应用CL-CS-NPs可以延长CL对病菌的作用时间。
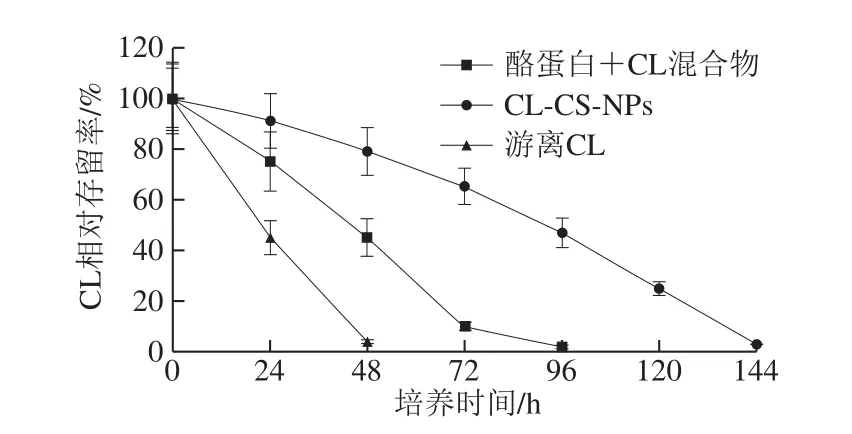
图2 培养基上喷洒CL-CS-NPs、酪蛋白CL混合物和游离CL不同时间的CL存留率Fig.2 Retention rates of CL after incubation of CL-CS-NPs, casein +CL mixture and free CL on the culture medium for different periods
2.3 CL-CS-NPs对离体枇杷炭疽菌的抑制作用
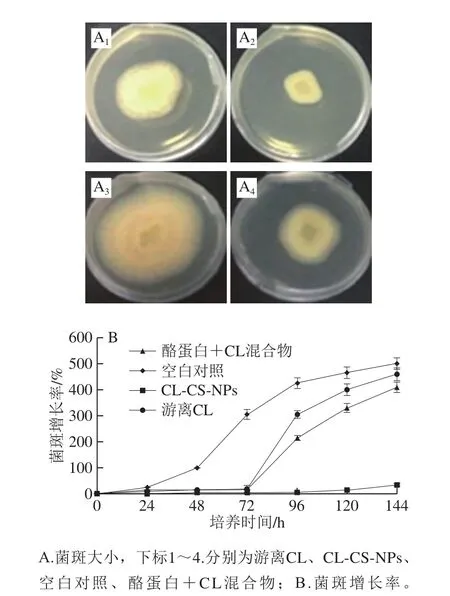
图3 培养基上喷洒CL-CS-NPs和其他处理抑菌效果比较Fig.3 Comparison of in vitro antifungal effects of CL-CS-NPs,CL + CS mixture and free CL
如图3所示,CL-CS-NPs组的完全抑菌时间达到5 d,酪蛋白+CL混合物和游离CL组均为3 d。由于游离CL组CL挥发快,因此在3 d之后,菌斑增长率开始迅速升高,而酪蛋白+CL混合物中的CL由于酪蛋白的作用可相对延缓CL挥发时间。CL-CS-NPs中的CL能够缓释,使得病菌被CL作用的时间大幅延长,因而完全抑制病菌生长的时间也大幅延长。因此,将CL-CS-NPs分散液直接喷涂在枇杷果实上,可较好地抑制枇杷腐烂。
2.4 CL-CS-NPs在枇杷果实上的防腐作用
由图4可知,接种5 d后,喷涂蒸馏水的枇杷果实(空白对照)腐烂已比较严重,而喷涂CL-CS-NPs分散液的枇杷果实基本没有出现腐烂(图4A)。接种7 d后CL-CS-NPs组的平均病斑直径仅为1.5 mm(图4B),发病率仅为10%(图4C),表明大多数枇杷果实没有被病菌侵害,抗菌剂的效果良好。相对而言,喷涂酪蛋白+CL混合物的枇杷果实5 d后病斑直径也相对较小,但发病率高达80%;7 d后的病斑平均直径达到4.8 mm,腐烂比较严重。由此可见,CL-CS-NPs在枇杷果实上的抗菌效果良好,能够用于采后枇杷果实及其他一些水果的抑菌防腐。

图4 CL-CS-NPs分散液抑制枇杷炭疽菌引起的枇杷腐烂作用Fig.4 CL-CS-NPs dispersion inhibited anthracnose rot in loquats
3 讨 论
酪蛋白纳米载体由于其优良的乳化性[15]和可自组装胶束的性质[16],被广泛用作疏水药物和生物活性化合物的递送系统[17-20]。本研究表明,CL可以与酪蛋白的低极性氨基酸残基(如酪氨酸残基)相互作用,从而使酪蛋白+CL混合物释放CL的速率显著放缓;而CL被制备成CL-CS-NPs后,其释放CL的速率又能进一步大幅减缓。培养基上喷洒游离CL、酪蛋白+CL混合物、CL-CS-NPs得到的CL释放速率结果与枇杷果实上接种炭疽菌后涂布游离CL、酪蛋白+CL混合物、CL-CS-NPs产生的抑菌效果(图3、4)基本一致。由此可以得出,CL-CS-NPs喷涂比其他处理抑制效果增强的主要原因是纳米颗粒的缓释作用使得功效成分抗菌作用的时效大大延长。
枇杷是我国南方特有的水果,以口感好、营养丰富而著称。枇杷通常在温暖的雨季成熟,易发生微生物感染,每年遭受的经济损失巨大。炭疽真菌引起的炭疽病是枇杷果实采后的主要病害[21-23]。虽然冷藏是一种被广泛应用的防腐技术,可以保持枇杷特有的风味,但冷藏会引起果肉的坚韧性和木质化,使枇杷果实品质显著下降[24]。传统上,枇杷果实采后病害的防治主要采用杀菌剂(如苯醚甲环唑、异菌脲、啼菌环胺、多菌灵、甲基硫菌灵、施保工等[25]),由于杀菌剂残留物对环境和人类健康的负面影响,近年来,采取其他措施控制枇杷果实的采后病害受到重视[26]。国内外学者选择安全无毒的物质替代化学杀菌剂的研究越来越多[27]。Cao Shifeng等[28-29]使用茉莉酸甲酯处理接种炭疽菌的枇杷果实,发现该处理能降低枇杷果实的发病率、病斑直径以及提高枇杷果实的贮藏品质。张春萍等[30]使用壳聚糖和那他霉素涂膜液处理枇杷果实,发现该处理能够减少枇杷果实的腐烂。Schirra[31]和Liu Fengjuan[32]等对枇杷果实用加热和皮氏毕赤酵母联合处理,结果表明,该方法对炭疽病有一定的防治效果。Wang Kaituo等[33]用乙醇处理枇杷果实后,发现枇杷炭疽病得到明显抑制。以上方法各有优缺点,可为解决枇杷腐烂问题提供技术支撑。
本研究采用食品安全性高的酪蛋白包埋天然抗菌物质CL,由于纳米颗粒的缓释作用使得CL发挥抗菌作用的时间大幅延长,所得纳米化的CL对枇杷的抗炭疽菌效果显著提高。这种纳米化的CL有望在枇杷的产后保鲜中得到实际应用。进一步的研究有望将CL-CS-NPs分散液开发成果蔬抗菌保鲜剂。
