艾滋病合并肝癌CT边缘形态与CD34表达的相关性研究*
2020-08-21甘清鑫刘晋新肖艳华杨可立张烈光黄德扬
甘清鑫 刘晋新△ 肖艳华 杨可立 张烈光 黄德扬
1.广州市第八人民医院放射科 (广东 广州,510060) 2.广州市第八人民医院病理科 3.广州市第八人民医院肝病科
艾滋病即获得性免疫缺陷综合征(AIDS)患者免疫功能降低,患各种恶性肿瘤的风险明显增加。AIDS合并恶性肿瘤,可以分为AIDS定义的肿瘤(ADCs),即AIDS相关肿瘤;和非AIDS定义的肿瘤(NADCs),即非AIDS相关肿瘤[1,2]。随着高效抗逆转录病毒治疗(HAART)的广泛应用及其疗效的不断提高,AIDS患者的生存期明显延长,ADCs、卡波氏肉瘤和非霍奇金淋巴瘤的发病率降低,AIDS合并NADCs的发病率逐年增高[3],各个系统的恶性肿瘤均可发生[4-6],AIDS合并肝癌已成为AIDS患者死亡的重要病因之一[7]。本文回顾性分析了本院2013年9月至2017年10月经外科手术切除的12例AIDS合并肝癌患者的临床、CT、病理资料及CD34表达情况,以期为该病的术前评估及预测其预后提供影像学依据。
1 资料与方法
1.1 临床资料 外科手术切除并经病理学诊断为AIDS合并肝癌的患者12例,肝癌诊断标准符合《原发性肝癌诊疗规范(2011年版)》,病理学诊断标准符合《原发性肝癌规范化病理诊断指南(2015版)》。所有患者均经过广州市疾病控制中心确证为HIV感染,所有患者入院后根据美国CDC1993年的AIDS诊断标准确定分期。12例患者全部为男性,年龄36~71岁,平均48.87岁。临床表现主要以腹痛、腹泻、腹胀为主,部分患者出现尿黄、乏力、发热等症状。
1.2 外周血检查 所有患者均经过外周血检查HIV抗原,甲型肝炎、乙型肝炎、丙型肝炎、戊型肝炎、丁型肝炎抗原及抗体,甲胎蛋白(AFP)、肝功能及外周血CD+4T淋巴细胞计数。
1.3 CT扫描方法及结果判断 12例患者均在外科手术前行上腹部CT平扫及增强扫描,所有患者CT检查均采用Philips Mx8000螺旋CT机,行CT常规平扫及增强扫描。检查体位:患者取仰卧位,行腹部螺旋扫描,上腹部扫描范围从肝顶部至肾下缘。检查条件:电压120 kV,电流240 mA,层厚6.5 mm,层距6.5 mm,腹部窗宽300~500,窗位20~50。常规腹部CT平扫后,均行双期增强扫描,增强扫描采用非离子型对比剂(碘海醇300 mg I/m l),高压注射器团注,注射流率2.5~3.0 m l/s,于注射后25 s开始动脉期扫描,70 s开始门脉期扫描,层厚6.5mm,层距6.5 mm。对艾滋病合并肝癌边缘特征描述按如下标准进行:平扫时病灶边缘表现为完整记作CT扫描边缘清楚;癌灶边界不清,与邻近非癌变组织之间无明确的分界,记作CT扫描边缘不清。增强后以邻近非癌变肝组织密度作为标准,将肿瘤边缘分为高密度强化或低密度不强化。CT影像征象的记录由两名影像诊断经验丰富的副高职称以上影像诊断医师共同阅片,结果经讨论以两者意见统一为准。阅片前两位影像诊断医师均未知临床及实验室检查结果。所有被试人员均已签署知情同意书。所有患者CT随访1年,分别于术后1、2、3、6个月和1年复查CT,评估术后肝内肝癌转移或复发情况。
1.4 免疫组织化学染色检测CD34表达 所有样本均经10%中性甲醛固定后用石蜡包埋,切片厚度为4μm。采用免疫组化(IHC)法检测。CD34鼠抗人单克隆抗体、免疫组化MaxVision检测试剂盒均为北京中杉金桥生物技术有限公司产品。每批染色均设立阴、阳性对照,按照免疫组织化学试剂盒说明书方法和步骤进行蛋白检测。结果判定标准:CD34蛋白阳性表达为棕黄色定位于血管内皮细胞胞膜和胞质。由资深病理医师对实验结果进行双盲法评估,CD34蛋白阳性范围计分:0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;阳性着色计分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分(根据阳性着色部位,排除假阳性)。两项结果相加<2分为阴性(0),2~3分为阳性“+”,4~5分为中度阳性“++”,6~7分为强阳性“+++”。
1.5 统计学方法 采用SPSS 22.0软件进行统计学分析。计数资料采用χ2检验、Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 患者CT表现及病理学资料 12例患者术前均行CT动态增强扫描,其中10例CT边缘模糊并强化,2例CT边缘清晰并可见包膜无强化。12例中,病理确诊为肝细胞癌(中、低分化)11例,肝细胞癌合并胆管细胞癌(中、低分化)1例。肝癌边缘组织CD34蛋白阳性表达10例(83.3%),患者CT肿瘤边缘形态与肿瘤边缘CD34表达有相关性(P<0.05)。术后1年内肝内发现肝癌转移或复发有10例(83.3%),肝内未见肿瘤转移或复发2例(16.7%),患者CT肿瘤边缘形态与术后1年内肝内肝癌转移或复发有相关性(P<0.05),说明AIDS合并肝癌CT肿瘤边缘模糊者于肝癌切除术后1年内容易发生肝内肝癌转移或复发。见表1,插页图1。
2.2 实验室检查结果 9例患者外周血HBsAg阳性,1例丙型肝炎病毒抗体阳性,2例乙型及丙型肝炎病毒抗原阳性。丙氨酸氨基转移酶(ALT)23~762 U/L,平均154.4 U/L,天门冬氨酸氨基转移酶(AST)42~488 U/L,平均166.1 U/L,9例(75.0%)AFP升高。血T淋巴细胞计数亚群计数:选取患者CD细胞最低时计数,12例患者CD+4T淋巴细胞计数4~530/μl,平均值279.0/μl,有9例(75.0%)CD+4T淋巴细胞计数大于200/μl。(HCV)感染是世界性的重要公共卫生问题,其混合感染的发生率极高。HIV感染可导致免疫抑制,加速HBV、HCV发展为慢性肝病、肝硬化及原发性肝癌。在AIDS患者中肝癌是最常见的NADCs之一,诊断为肝细胞癌的AIDS患者常为HBV和HCV合并感染。AIDS患者合并肝癌的主要风险因素是病毒性肝炎和酒精的滥用,HIV导致的免疫抑制可能加速肝纤维化和增加肝细胞癌的风险,某一些抗逆转录病毒治疗药物有直接的肝毒性作用,可能会加重肝脏损害,临床上发现时常为中晚期或伴多发转移[8-12]。
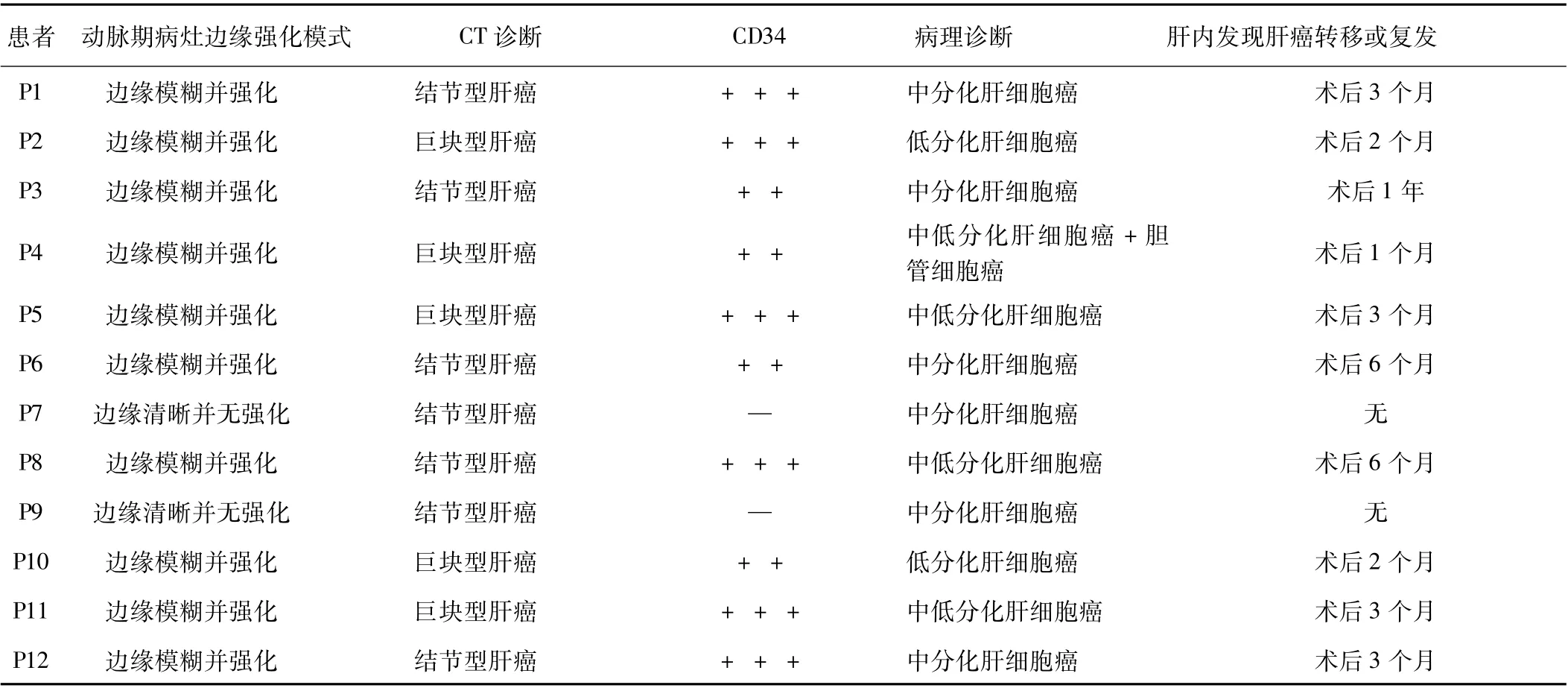
表1 12例患者的术前CT表现、病理诊断、CD34蛋白表达、术后1年内肝癌肝内转移或复发
肝癌的边缘形态特征与肿瘤边缘浸润情况及肿瘤新生血管生成程度密切相关,多期动态增强CT扫描是诊断肝癌的最常用无创性检查方法之一,而肿瘤边缘新生血管的观察主要靠病理学检查,其中IHC染色技术是直接反应肿瘤边缘生物学特性的最有效方法。肿瘤边缘新生血管生成受到血管内皮细胞生长因子等多种生长因子的调节,肿瘤边缘新生血管生成越多,说明营养供应丰富,肿瘤细胞增殖越活跃,很容易发生边缘组织侵袭和周围转移[13]。反映肿瘤边缘微血管密度生成的标志物较多,而CD34是血管源性肿瘤的特异性标志物之一,属于肝细胞癌相对特异性抗体,是临床常用的特异性标志物,据报道CD34在HCC微血管中阳性表达[14,15],CD34阳性定义为在肝细胞癌组织中出现特征性的微血管内皮染色,有研究者称其为“肝细胞癌型染色”,其特点是阳性标记的微血管呈短小的裂隙及狭长的分支状,管壁纤细,管腔狭窄,分布弥漫而均匀;癌旁肝硬化组织的血窦为阴性[16]。CD34能较好反映肿瘤边缘微血管生成的情况。CT动态增强扫描使用含碘对比剂作为示踪剂,能提供良好的密度对比,能较好显示肿瘤边缘形态及血供情况,是安全、有效的无创性影像学检查方法之一。
目前国内外关于AIDS合并肝癌CT边缘形态与CD34表达的相关性研究罕见报道,本研究中12例患者有9例患者合并乙型肝炎,1例患者合并丙型肝炎,2例患者合并乙型及丙型肝炎,12例(100.0%)患者均为肝硬化。12例患者术前均行CT动态增强扫描,其中10例CT边缘模糊并强化,2例CT边缘清晰并可见包膜无强化。12例患者中,病理确诊为肝细胞癌(中、低分化)11例,肝细胞癌合并胆管细胞癌(中、低分化)1例。肝癌边缘组织CD34蛋白阳性表达10例,说明AIDS合并肝癌CT肿瘤边缘模糊与肿瘤边缘组织CD34阳性表达密切相关。12例患者复查CT,术后1年内肝内发现肝癌转移或复发有10例,且CT肿瘤边缘形态与术后1年内肝内肝癌转移或复发有相关性,说明艾滋病合并肝癌CT肿瘤边缘模糊的患者于肝癌切除术后1年内容易发生肝内肝癌转移或复发。本研究中AIDS合并肝癌患者多见巨块型肝癌或多发结节型肝癌,动态增强扫描时可见病灶边缘模糊并强化,肿瘤边缘CD34表达中度阳性或强阳性,呈典型性“肝细胞癌型血管染色”,病理显示肿瘤边缘呈浸润性生长,肿瘤边缘出现丰富的肿瘤新生血管,中、低分化肿瘤多见,恶性度高,CD34蛋白在癌灶边缘阳性表达与AIDS合并肝癌CT边缘模糊并明显强化与肿瘤边缘浸润密切相关,术后肿瘤容易发生肝内转移或复发。
由于本研究样本量较小,AIDS合并肝癌的类型较少,对AIDS合并肝癌CT边缘形态与CD34表达的相关性有待进行大样本的进一步研究,为该病的术前评估及预测其预后提供帮助。
