基于槲皮素标记的金属有机框架放疗联合阿霉素诱导宫颈癌HeLa细胞凋亡的研究
2020-08-21罗丽芳刘运铎陈秀玮
罗丽芳 刘运铎 关 玥 陈秀玮
宫颈癌是严重威胁全球女性生命健康的恶性肿瘤之一。其发病率较高并逐渐呈年轻化趋势[1]。目前,宫颈癌的临床治疗主要采用手术治疗为主,放疗、化疗或生物治疗为辅的联合治疗方法,但肿瘤细胞的侵袭和转移是绝大多数患者治疗后复发的主要原因。且对于晚期或者复发性宫颈癌患者,现有的治疗效果有限,并严重影响患者生命质量。众所周知,缺氧诱导因子1(Hypoxia inducible factor-1,HIF-1)是细胞内最重要的转录因子之一,也是机体对肿瘤缺氧微环境产生应答的一种关键分子,有α和β两个亚基组成,大量研究表明HIF-1α在恶性肿瘤中高表达,通过促进下游相关基因的转录,促使恶性肿瘤的增殖和转移[2]。目前国内外学者研究发现槲皮素(Quercetin,QU)有极强的抗肿瘤作用,其机制是通过多途径抑制肿瘤细胞增殖,诱导其凋亡等[3]。本研究旨在探讨基于槲皮素标记的金属有机框架(Zr-MOF)放疗(RT)联合阿霉素(DOX)对宫颈癌HeLa细胞的抑制作用,为宫颈癌治疗提供新的实验依据和理论依据。
1 材料与方法
1.1 材料
人宫颈癌HeLa细胞株(保存自哈尔滨医科大学附属肿瘤医院);槲皮素(Aladdin公司,USA);Caspase-3及HIF-1α抗体(Abcam公司,USA);DMEM培养基及胎牛血清(Gibco公司,USA);将50 mg QU溶解在5 mL乙醇溶液中,加入10 mg Zr-MOF并分散到溶液中;再将该溶液保持在冰水浴中,摇动6 h,离心获得负载QU的Zr-MOF(Zr-MOF-QU)。将20 mg DOX溶解在5 mL乙醇溶液中,加入5 mg Zr-MOF-QU并分散到溶液中;再将该溶液保持在冰水浴中,摇动6 h,离心获得负载DOX的Zr-MOF-QU(Zr-MOF-QU-DOX)。
1.2 方法
1.2.1 细胞培养 HeLa细胞复苏后,用含有10%的新生牛血清的DMEM培养基置于含5% CO2的37℃孵箱中培养,每2~3 d传代一次。
1.2.2 放射条件 将实验细胞在室温下采用直线加速器6 MV-X射线进行照射,平均剂量率为400 cGy/min,照射时间1 min,源床距为100 cm。
1.2.3 细胞培养分组与处理 将对数生长期的HeLa细胞分为对照组、RT组、阿霉素处理组(Zr-MOF-DOX+RT)、QU处理组(Zr-MOF-QU+RT)及联合处理组(Zr-MOF-QU-DOX+RT);对照组是不做任何处理只含等量DMEM培养液培养细胞48 h;RT组是只含等量DMEM培养液培养细胞48 h进行放射线下照射1 min;阿霉素处理组使用的药物浓度为2 μg/mL,培养48 h进行放射线下照射1 min;QU处理组使用槲皮素浓度为20 μmol/L,培养48 h进行放射线下照射1 min;联合处理组使用槲皮素和阿霉素浓度分别是20 μmol/L和2 μg/mL,培养48 h进行放射线下照射1 min。
1.2.4 克隆形成实验 处于对数生长期的细胞经过单纯的胰酶消化处理后形成单细胞悬液,按照5×104个/孔的细胞数量将HeLa细胞铺在6孔板上,并在37℃下孵育1天。实验分为五组(对照组、RT组、阿霉素处理组、QU处理组、联合处理组)。用等量辐射剂量的X射线辐照除对照组外的四组细胞,然后继续培养48 h。PBS连续清洗两遍后,加入4%多聚甲醛固定细胞,10 min后弃固定液,加入0.05%的结晶紫染色30 min,洗涤干燥后拍照并在显微镜下观察计数。本实验均重复三次,通过计算菌落的存活率来评估不同处理组的增殖能力。
1.2.5 蛋白印迹分析 消化收集五组细胞,PBS洗两次,裂解、离心,提取总蛋白,BCA法测定蛋白浓度。灌制SDS-PAGE胶,将蛋白样品加入点样孔中,电泳完毕后将胶上的蛋白转移至NC膜上,用5%脱脂牛奶封闭,加入一抗Caspase-3(1∶1 000)、HIF-1α(1∶1 000),4℃孵育过夜,洗膜,加入二抗(1∶2 000)室温下孵育2 h。置于显像仪中显影、拍照。蛋白条带用Quanti Scan软件进行密度扫描分析。
1.2.6 免疫荧光分析 在五组实验组中,将爬好细胞的玻片用PBS洗涤三次,每次约3 min;4%多聚甲醛室温固定30 min;PBS洗涤,透膜20 min;PBS洗涤,室温封闭30 min,滴加足量预先稀释好的一抗(Caspase-3、HIF-1α),4℃孵育一抗过夜;24 h内间断浸润爬片三次,每次时间约3 min,之后吸净玻片上的液体,滴加预先已经稀释好的荧光二抗,室温下孵育2 h;PBS洗涤,加入DAPI染料染核,室温避光孵育5 min;PBS洗涤,在200倍荧光显微镜下,观察蛋白荧光强度。
1.3 统计学分析
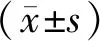
2 结果
2.1 细胞克隆形成实验检测各处理组细胞增殖活性
与对照组相比,RT组、阿霉素处理组、QU处理组及联合处理组细胞增殖活性明显降低(P<0.05);与阿霉素处理组、QU处理组相比较,联合处理组的细胞增殖活性显著降低(P<0.05);对照组和RT组细胞分别有85%和76%的集落形成,而阿霉素处理组、QU处理组及联合处理组细胞存活率分别只有51%、47%和16%(图1)。

图1 不同组别中HeLa细胞增殖活性的差异Figure 1 The proliferation of HeLa cells was inhibited in different groups
2.2 蛋白印迹法检测Caspase-3与HIF-1α蛋白含量的变化
与对照组比较,RT组、阿霉素处理组、QU处理组及联合处理组中凋亡蛋白Caspase-3呈明显上升趋势,有统计学差异(P<0.05),且联合处理组含量最高。而缺氧诱导因子HIF-1α蛋白水平在各处理组中表达明显下降,差异具有统计学意义(P<0.05),联合处理组中HIF-1α含量最低(图2)。

图2 不同组别中Caspase-3与HIF-1α蛋白含量的变化Figure 2 The expression of Caspase-3 and HIF-1α proteins in HeLa cells treated with the control,RT,Zr-MOF-DOX+RT,Zr-MOF-Qu+RT and Zr-MOF-Qu-DOX+RT groupsNote:A.The expression of Caspase-3 and HIF-1α proteins in HeLa cells was detected by Western blot;B-C.The intensity analysis for protein bands of HIF-1a and Caspase-3 in each group.* P<0.05,** P<0.01,*** P<0.001,when compared with the control group.
2.3 免疫荧光法检测各组凋亡蛋白及缺氧诱导因子含量变化
与对照组比较,RT组、阿霉素处理组、QU处理组及联合处理组中凋亡蛋白Caspase-3表达水平呈明显上升趋势,荧光强度显著增强,差异具有统计学意义(P<0.05)。联合处理组中Caspase-3表达水平最高,荧光强度最强,显著高于其他组(P<0.001)(图3)。

图3 免疫荧光法检测各组凋亡相关蛋白Caspase-3的荧光强度Figure 3 Fluorescence intensity of apoptosis-associated Caspase-3 protein was detected in HeLa cells by immunofluorescenceNote:A.Fluorescence imaging of Caspase-3 in each group;B.The intensity expression of Caspase-3 in each group.* P<0.05,** P<0.01,*** P<0.001,when compared with the control group.### P<0.001,when compared with the RT、Zr-MOF-DOX+RT,Zr-MOF-QU+RT groups.
与对照组比较,RT组、阿霉素处理组、QU处理组及联合处理组中缺氧诱导因子HIF-1α蛋白表达水平呈明显下降趋势,荧光强度显著减弱,差异具有统计学意义(P<0.05)。联合处理组中HIF-1α表达水平最低,荧光强度最弱,显著低于其他组(P<0.01)(图4)。

图4 免疫荧光法检测各组缺氧诱导因子HIF-1α蛋白的荧光强度Figure 4 Fluorescence intensity of hypoxia-inducible factor HIF-1α protein was detected in HeLa cells by immunofluorescence in each groupNote:A.Fluorescence imaging of HIF-1α in each group;B.The intensity expression of HIF-1α in each group.* P<0.05,** P<0.01,when compared with the control group.## P<0.01,when compared with the RT、Zr-MOF-DOX+RT,Zr-MOF-QU+RT groups.
3 讨论
侵袭转移是恶性肿瘤的重要生物学特征,也是治疗失败的主要原因之一。肿瘤细胞的侵袭转移过程受多种因素的影响,由于新生血管的形成及血管通透性的增加,肿瘤细胞容易穿透血管壁和淋巴管壁,从而为癌细胞的转移提供途径[4-5]。如今同步放化疗已经成为中晚期宫颈癌的标准治疗。由于化疗药物毒副作用大,同时放疗对肿瘤细胞的选择性差,因此找到一个安全而有效的放化疗方案是临床中需要解决的问题。
Zr-MOF材料由于其独特的金属离子及较高的比表面积和多孔结构,自身即可呈现优异的放射增敏性能,无须包裹其他离子结构,且易于表面修饰和装载各种药物,可降解并且生物相容性良好[6]。纳米颗粒已被证明可以提高氧水平和减轻肿瘤缺氧[7],并且因纳米载体尺寸小、生物相容性高、可体内降解等多种特性,可通过表面修饰实现药物靶向递送[8]。美国德克萨斯州农工大学Park等人报道了叶酸靶向且负载卟啉的锆基NMOF用于Hela细胞的光动力治疗[9]。而且槲皮素是一种具有多种生物学活性的黄酮类化合物,广泛分布于蔬菜、水果及多种中草药中。研究显示,具有抗氧化、抗病毒、抗过敏及抗血小板聚集等多重功效,可起到降低血压、扩张冠状动脉等作用[10]。尤其是槲皮素的抗肿瘤作用引起人们的重视。张阳阳等[11]用槲皮素预处理MCF-7乳腺癌细胞,发现槲皮素可以增强阿霉素诱导的凋亡作用,同时与阿霉素联合运用有协同化疗效应。师迎旭等[12]研究表明槲皮素可以有效提升阿霉素的抑制白血病细胞增殖的效率,对原代白血病细胞的增殖抑制具有协同和相加作用。已有报道证实,槲皮素对多种不同肿瘤细胞具有抗肿瘤活性,包括白血病细胞、淋巴瘤细胞、结肠癌细胞、卵巢癌细胞、宫颈癌细胞、前列腺癌细胞及乳腺癌细胞等[13]。并且对多种抗癌药物具有化疗增敏作用,对放射也具有增敏作用,而相关的报道尚少。
本实验结果表明,基于槲皮素标记的金属有机框架放疗联合阿霉素可以有效抑制宫颈癌的生长转移同时能够促进肿瘤细胞的凋亡,使肿瘤细胞内HIF-1α的表达下调,其治疗效果明显。因此,本研究认为基于槲皮素标记的金属有机框架放疗联合阿霉素可以作为宫颈癌有效治疗手段,增加肿瘤细胞对放疗及阿霉素药物化疗的敏感性,从而增强其抗肿瘤效果,同时为其在宫颈癌治疗中提供新的实验和理论依据。
