一株油脂降解菌的筛选及其降解条件优化
2020-08-20王亚军蔡文娟耿冲冲王惠张蓉陈甜靖李金守
王亚军,蔡文娟,耿冲冲,王惠,张蓉,陈甜靖,李金守
1. 兰州理工大学土木工程学院,甘肃 兰州 730050;2. 兰州兴蓉环境发展有限责任公司,甘肃 兰州 730070
近些年来,含油废水的排放量不断增加,这些含油废水主要来自肉类加工行业、餐饮业、动植物油加工厂等。油脂会对水环境造成严重的危害,例如水体中的油脂会形成油膜漂浮在水面,使水体与外界环境间氧气的传输过程受到阻碍,威胁水生动植物及微生物的生长;另外油膜的存在使水体中的废气和温度难以逸散,致使水质黑臭;而油脂水解时产生的长链脂肪酸等一些中间产物对水环境中的某些生物具有一定的毒害性,甚至会破坏水系统的平衡状态(秦华明,2003)。现阶段,对于含油污废水的处理方法主要有物理法和化学法,但这两种方法在处理过程中仍存在一定的局限性;生物法的处理成本低廉,效果也较好,并且对环境无二次污染,因此得到普遍认可与广泛推崇(Asses et al.,2009;Song et al.,2011)。生物处理法主要利用某些对于油脂具有降解功能的微生物自身所产生的脂肪酶(Hasan et al.,2009)将油脂水解为甘油和脂肪酸。有研究表明,油脂的水解过程是油脂废水处理的限速步骤(刘国防,2012)。
现阶段,国内外有关油脂降解菌的研究报道并不多,并且主要集中在水处理领域。为减少油脂对库区河流的污染,史红玲等(2019)经筛选获得一株变形杆菌(Proteus mirabilis)NY-201801,最优的条件下对油脂的降解率可达92%,并且具有较好的环境适应性,对水生态安全的保护具有重要意义。对于高浓度含油废水的处理,Gao et al.(2019)从含油污泥中筛选出3株油脂降解菌,它们对初始质量浓度在20 g·L−1的油脂降解率均在95%以上,并且当初始油的质量浓度增加到100 g·L−1时,其对油脂的降解率仍在40%左右,说明该研究所筛选出的菌株在高质量浓度油脂污废水的处理中具备很好的应用潜力。对于高盐度含油废水的处理,Yan et al.(2018)筛选出2株对大豆油具有降解效果的菌株,经过5 d的培养,它们的降解率均在50%以上,对其进行耐盐性的测试,最终结果显示其中一株更适合降解餐厨废水。另外油脂降解菌还可应用于畜禽尸体堆肥,肖翰等(2017)筛选出一株粘质沙雷氏菌(Serratia marcescem)D-4油脂降解菌,当该菌株培养96 h时降解率约为57%,相比于对照组油脂降解率更高。目前,研究报道出的油脂降解菌还有不动杆菌属(Acinetobactersp.)、假单胞杆菌属(Pseudomonassp.)(Sugimori et al.,2012)、气单胞菌属(Aeromonassp.)(Affandi et al.,2014)等。
油脂自身具有难降解特性,若仅靠土著微生物降解,最终效果远远达不到标准,而且油脂也是污水中CODCr的组分(刘婕等,2010),若不进行处理会影响出水水质。经调研发现,近些年来兰州市生活污水中的含油量与日俱增,这给污水处理厂的运行带来一系列问题,一方面污水厂现有的设备条件难以对油脂进行有效处理,另一方面油脂的存在影响到生化池处理效果,最终导致污水厂出水水质难以达标。目前所报道出的油脂降解菌基本筛选自高浓度含油废水或食堂下水道,这些菌株对油脂的降解效果好,但是由于外来菌株与土著微生物有竞争关系,使得筛选出的油脂降解菌在生活污水中难以存活,另外生活污水成分有别于高浓度含油废水,其油脂浓度远远偏低,因此生活污水中的营养物质满足不了这些从高浓度含油废水或食堂下水道中所筛选出的油脂降解菌的要求,以至于油脂降解菌难以发挥其真正有效的作用。基于上述各个问题,本研究从兰州市某生活污水处理厂的剩余污泥中筛选分离出对油脂具有降解功能的微生物,为生物处理含油污水提供更合适的菌种选择,并期望可以通过原位投加的方式解决污水处理厂对油脂处理效果不佳的问题。
1 材料与方法
1.1 材料
1.1.1 菌种分离源
本实验所用的菌种分离源是兰州市某生活污水处理厂的剩余污泥,将采集的样品装入经紫外线杀菌后的封口袋中,放入−20 ℃的冰箱中保藏备用。
1.1.2 培养基
LB培养基:蛋白胨10.0 g·L−1,酵母膏5.0 g·L−1,NaCl 5.0 g·L−1,pH 7.0,121 ℃灭菌 20 min。
富集培养基:LB培养基加金龙鱼菜籽油 3.0 g·L−1。
选择培养基:KH2PO40.3 g·L−1,MgSO4·7H2O 0.1 g·L−1,K2HPO41.5 g·L−1,(NH4)2SO41.0 g·L−1,NaCl 5.0 g·L−1,金龙鱼菜籽油 3.0 g·L−1,琼脂 18 g·L−1,pH 7.0,121 ℃ 灭菌 20 min。
复筛培养基:成分同选择培养基,不含琼脂。
1.2 方法
1.2.1 高效油脂降解菌的筛选
称5 g样本污泥到三角瓶中并用45 mL无菌水稀释成泥水混合液,放在恒温磁力搅拌器上搅拌约10 min,使菌胶团充分被打散,静置数分钟后,吸取 1 mL上清液接种于 50 mL富集培养基中,在30 ℃,150 r·min−1的恒温振荡培养箱中培养,每7天为一个周期。吸取1 mL培养液转接到新的富集培养基中,期间观察油脂降解情况,若发现培养基中油脂降解较好时,就补加少量菜籽油。对上述过程循环进行4个周期。吸取驯化后的菌液进行梯度稀释并涂布于选择培养基中,在 30 ℃的生化培养箱中进行48 h的培养,期间对菌种的生长状况进行观察,挑取培养基中透明圈直径约为菌落直径2倍的菌株(闫红梅等,2013),然后进行划线分离得到纯种菌。用接种环挑取菌株,接到50 mL复筛培养基中,在 30 ℃,150 r·min−1的恒温振荡培养箱中培养72 h,同时设未接菌培养基为对照,测定培养液中的含油量,筛选出油脂降解率高的菌株。
1.2.2 种子液的制备
挑取一环菌苔(30 ℃下培养了 24 h)接种到LB培养基中,在30 ℃,150 r·min−1的恒温振荡培养箱中培养24 h,通过调节和镜检使菌悬液浓度约为 1×108CFU·mL−1。
1.3 油脂降解菌的鉴定
根据《常见细菌系统鉴定手册》(东秀珠等,2001)对菌株的形态和生理生化特征进行鉴定。菌株的16S rDNA测序鉴定和系统发育树构建均由广州美格生物科技有限公司完成。
1.4 油脂降解菌降解特性初步研究
1.4.1 生长曲线的测定
接种6%(V/V)的种子液于150 mL液体LB培养基中,在 30 ℃,150 r·min−1的恒温振荡培养箱中培养72 h,每4小时取样一次用紫外分光光度计测定OD600的值,即为菌体细胞密度,根据所测定的吸光度值绘制菌株的生长曲线。
1.4.2 不同时间对油脂的降解情况
为考察该菌株在不同时间段内对菜籽油的降解效果,接种6%(V/V)的种子液于150 mL复筛培养基中,在 30 ℃,150 r·min−1的恒温振荡培养箱中进行培养,每 12小时取样一次,分别测定各时间点的油脂降解率(Oil degradation rate,d(O)/%)和OD600。
1.4.3 共基质对菌株降解性能的影响
向50 mL复筛培养基中加入不同基质(淀粉、葡萄糖、蔗糖、蛋白胨、酵母膏、牛肉膏),接入6%(V/V)种子液,在 30 ℃,150 r·min−1的恒温振荡培养箱中培养 72 h后测定油脂降解率(张庆云等,2017)。
以上每组设置3个平行实验。
1.5 油脂降解菌降解条件优化
1.5.1 接种量
分别移取2%、4%、6%、8%、10%、12%、14%(V/V)的种子液,按不同接种量(Inoculation volume,v/%)转接到含50 mL复筛培养液的250 mL锥形瓶中,在 30 ℃,150 r·min−1的恒温振荡培养箱中经过72 h培养后,测定不同接种量下菌株对菜籽油的降解率和OD600。
1.5.2 初始pH
接种6%(V/V)的种子液于50 mL pH分别为4.0、5.0、6.0、7.0、8.0、9.0的复筛培养基中,在30 ℃,150 r·min−1的恒温振荡培养箱中进行 72 h 培养,测定不同pH下菌株对菜籽油的降解率和OD600。
1.5.3 培养温度
将6%(V/V)的种子液转接到含50 mL复筛培养液的250 mL锥形瓶中,按不同温度(Temperature,ɵ/℃)分别将培养基置于 15、20、25、30、35、40 ℃,150 r·min−1的恒温振荡培养箱中进行72 h培养,测定不同温度下菌株对菜籽油的降解率和OD600。
1.5.4 初始NaCl的质量浓度
将6%(V/V)的种子液转接到含50 mL复筛培养液的 250 mL锥形瓶中,该培养基中初始 NaCl质量浓度(NaCl concentration,ρ(NaCl)/(g·L−1))分别为 0、2.5、5.0、7.5、10.0、15 g·L−1,在 30 ℃,150 r·min−1的恒温振荡培养箱中进行72 h培养,分别测定不同 NaCl质量浓度下菌株对菜籽油的降解率和OD600。
以上每组设置3个平行实验。
1.6 油脂降解菌对实际污水的降解
实验按最优降解率下所对应的条件进行设定,向已灭菌的装有150 mL实际生活污水的三角瓶中接入种子液,置于恒温振荡培养箱中进行72 h的培养,测定培养基中油脂和 CODCr的含量。设置 3组平行实验。
1.7 检测项目与方法
菜籽油回归方程:精确称取1.00 g菜籽油溶解于石油醚中,配制成10 g·L−1的菜籽油标准液。吸取梯度体积的菜籽油标准液并用石油醚稀释,配制质量浓度梯度为 0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 g·L−1的菜籽油溶液。以石油醚为空白,测定各质量浓度下菜籽油溶液的OD230值,依此绘制标准曲线并得到回归方程为:y=0.512x+0.0026,相关系数为0.9996。
菜籽油质量浓度:参考秦华明(2003)和沈叔平等(1994)采用紫外分光光度法对油脂进行测定。
CODCr:采用重铬酸钾法进行测定。
1.8 数据处理
研究数据采用Excel进行数据统计分析,应用Origin 9.0进行制图。
2 结果与分析
2.1 油脂降解菌的筛选
选取选择培养基中形态显著的菌株,经划线分离得到了3株具有较大透明圈的菌株。经过筛选最终得到一株对油脂降解效果最好的菌株YZ-1,该菌株在72 h内对菜籽油的降解率为54.91%。
2.2 油脂降解菌的鉴定
菌株 YZ-1为革兰氏阴性菌,其菌落在固体培养基上呈圆形半透明状。菌株 YZ-1的生理生化特征如表1所示。经鉴定菌株YZ-1与铜绿假单胞菌(P.aeruginosa)的相似度在99.9%以上(表2),基于16S rDNA序列分析与比对对菌株YZ-1进一步进行表征,利用 MEGA软件构建系统发育树如图1所示。

表1 菌株YZ-1的生理生化特征Table 1 Physiological and biochemical characteristics of strain YZ-1
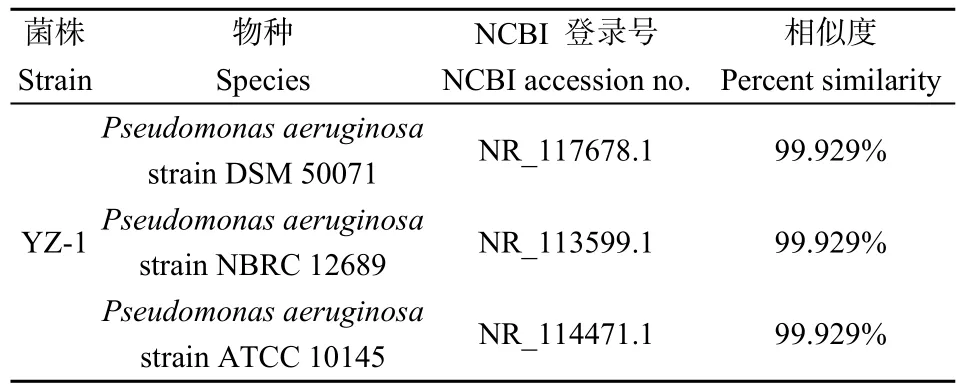
表2 通过16S rDNA基因序列分析鉴定菌株YZ-1Table 2 Identification of strain YZ-1 by 16S rDNA gene sequence analysis
2.3 油脂降解菌降解特性初步研究
2.3.1 生长曲线的测定
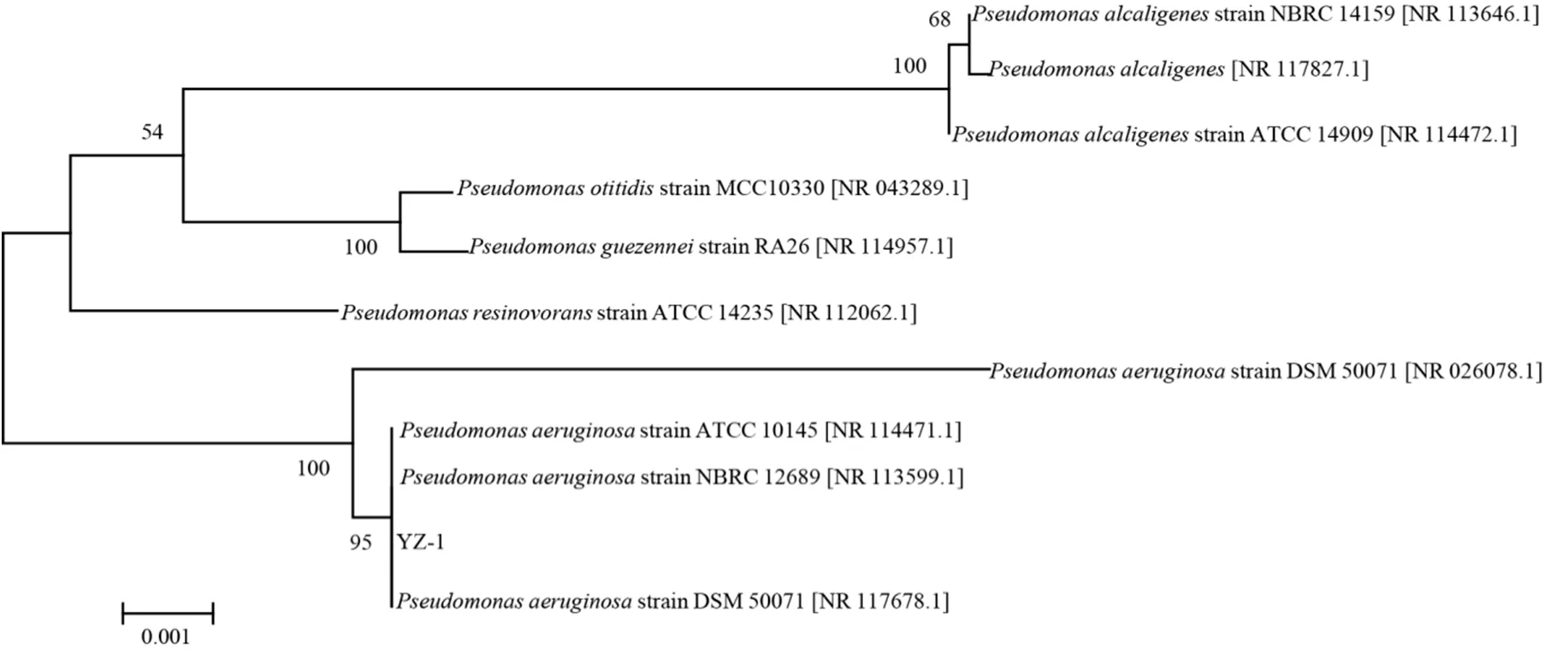
图1 菌株 YZ-1 系统发育树Fig. 1 Phylogenetic tree of strain YZ-1
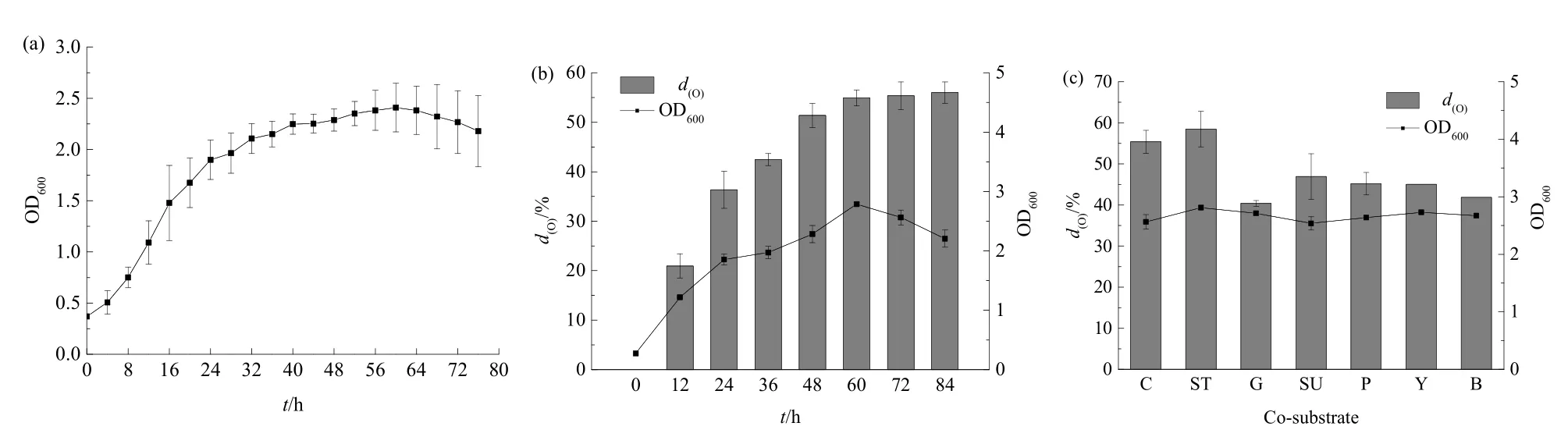
图2 菌株YZ-1降解特性初步研究Fig. 2 Preliminary study on the degradation characteristics of strain YZ-1
微生物的生长曲线可以直观地反映其生长规律和增殖情况。从图2a可以看出,在接种量为6%(V/V)的情况下,油脂降解菌YZ-1在0—32 h时很快适应新的环境,菌体数量快速增加。32—60 h时菌株YZ-1处于稳定生长时期,生长逐渐趋于平缓,说明代谢产物的积累和营养物质比例失衡影响了微生物的生长,菌体数量达到峰值,OD600值为2.409。60 h后,曲线呈现了逐渐下降的趋势,说明菌株从此时开始便进入到衰亡期。
2.3.2 不同时间对油脂的降解情况
为进一步考察菌株YZ-1对油脂的降解情况,本研究每 12小时对培养基中油脂含量进行测定并计算其降解率,如图2b所示,经过72 h菌株YZ-1对油脂的降解率为55.37%。在0—24 h时,由于培养基中的环境适宜、营养物质充足,菌株利用培养基中的油脂进行自身的生长与繁殖,因此油脂降解率大幅度增加。24—60 h时,菌体数量继续增大,对油脂的降解率也逐步提高。经过60 h的培养,菌株对油脂的代谢能力逐渐减弱,其主要原因有环境变化、营养物质比例失衡、代谢产物长链脂肪酸的积累。油脂水解过程中由于脂肪酸的产生,会使培养基中的pH发生明显变化(Affandi et al.,2014;高贵等,2005),营养物质也相继消耗,同时油脂水解后的中间产物长链脂肪酸对菌株也有毒害作用(段艳平等,2008),从而会威胁菌株的生存和增殖。
2.3.3 共基质对菌株降解性能的影响
实际污水中有机物的成分较为复杂,一般情况下微生物会优先利用容易降解的有机物而影响对目标污染物的去除效果,因此研究共基质的存在对油脂降解率的影响是很有必要的。从图 2c可以看出,不同共基质对油脂的降解效果影响不同,在加入淀粉的培养基中油脂的降解效果要优于对照组,菌体数量也有所增长,说明淀粉在一定程度上促进了菌株YZ-1的生长,从而提高了油脂降解效率(郭静波等,2018)。而其它组的油脂降解率均低于对照组,可能的原因是共基质被菌株YZ-1优先利用,使其在一定时间内无法对油脂进行充分的降解(秦华明等,2007)。但总体而言,在共基质存在的情况下,菌株YZ-1对油脂仍保有降解效果。
2.4 油脂降解菌降解条件的优化
2.4.1 接种量
接种量的多少会影响微生物生长代谢能力,接种量少时,会降低反应体系中微生物的数量,导致培养时间延长,接种量大时,会增加反应体系的负荷(吴晓娜等,2018)。王佳君等(2017)研究了接种量对产甲烷菌产气量的影响,结果表明由于接种量过大使得反应中产生大量的VFAs气体,对产甲烷菌产生了抑制。另外,当接种量过大时,菌种会大量繁殖而聚集成球,导致体系中溶解氧的含量下降(康燕莉,2013)。因此选择合适的接种量有利于菌株对于油脂的降解。
图3a是不同接种量下菌株YZ-1在对油脂的降解率。当培养基中的接种量为 12%(V/V)时,菌株YZ-1对菜籽油的降解率为59.42%,达到最大值,此时培养基中的OD600值亦达到最大,接种量大于或小于 12%(V/V)时,降解率均在减小。接种量会影响微生物生长调整期的长短,从图中可以看出,当接种量为2%时,油脂的降解率为38.64%,OD600为 1.944,说明由于接种量太少,菌株 YZ-1需要更长的时间去适应环境并生长增殖,从而在72 h时内对菜籽油的降解效果未达到最优值。随着接种量的增加,油脂降解率也随之增加,说明随着OD600的增长,菌株YZ-1能更加快速地分解油脂。当接种量为 14%(V/V)时,油脂降解率下降,可能的原因有菌株的快速繁殖与代谢,使得产生的代谢产物过多累积,并且影响到培养基中的氧气含量,从而抑制了菌株进一步利用油脂的能力。
2.4.2 初始pH
pH是影响微生物生存很关键的因素,微生物在最适pH条件下的酶活力最高,生长率最快。由于微生物细胞内的 DNA、ATP等物质对酸较为敏感,而RNA、磷脂等对碱较为敏感,因此微生物细胞中的环境一般维持中性状态(陈燕飞,2009)。外界环境的pH通过影响细胞膜的表面电荷来影响膜的通透性和酶的活性,进而影响微生物对营养物质的吸收过程,最终会使微生物的生长遭到抑制,甚至死亡。
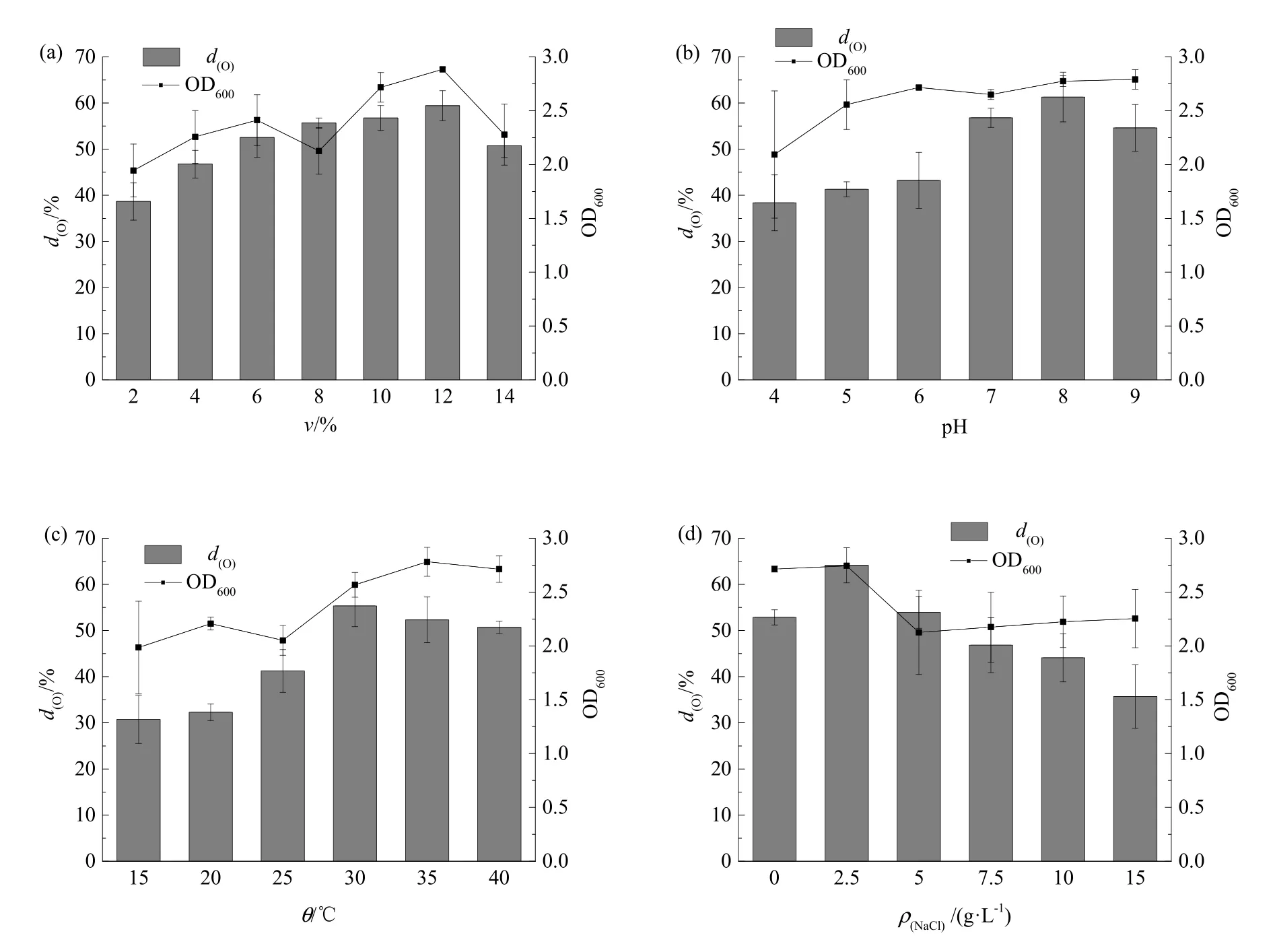
图3 接种量、初始pH、温度初始NaCl质量浓度对菌株YZ-1油脂降解率的影响Fig. 3 Effect of inoculation volume, initial pH, temperature, initial NaCl concentration on oil degradation rate of strain YZ-1
图3b是不同pH条件下菌株YZ-1对油脂降解率的变化情况,菌株YZ-1最适pH为8,油脂的降解率为61.28%,大于pH为7时的降解率,可能的原因是油脂水解后产生脂肪酸,会使培养基偏酸性,不利于菌株的生长。有研究报道称铜绿假单胞菌(P.aeruginosa)所分泌的脂肪酶具有一定的耐碱性(李文君等,2012),秦华明等(2003)分离出的铜绿假单胞油脂降解菌可以在pH为4—9的环境中生长,当pH为9时,对油脂降解率约为20%。菌株YZ-1可以在较广的pH范围内生存,对外界环境的变化具有一定的缓冲能力,而且菌株YZ-1在pH为5—9时,降解率均在40%以上。
2.4.3 培养温度
温度在微生物生长环境因子中起很重要的作用,对于大多数微生物而言,温度过高会使得细胞发生不可逆的损伤,而温度过低会抑制酶的活性,影响微生物的代谢功能,更甚者会使原生质体内的水分结冰,从而导致细胞死亡。因此选择微生物生长最适温度有利于微生物的增殖和对营养物质的代谢。
菌株 YZ-1在 15—40 ℃的范围内对油脂均有一定的降解效果,如图 3c所示。其最高的降解率是处于 30 ℃时,当温度低于 30 ℃,油脂降解率和OD600均呈现较低的趋势,说明低温环境抑制了菌株YZ-1的增殖和分泌脂肪酶的能力,或脂肪酶在低温环境中的比活力有所降低,最终影响对油脂的降解效果。当温度大于30 ℃时,菌株YZ-1对油脂的降解率也逐渐减小,原因是温度促进了生化反应的进行,使菌株增殖加快,营养物质快速消耗,代谢产物过量积累,导致其代谢能力变弱,但是对于油脂的降解率仍然维持在50%以上。由此可以得出,菌株 YZ-1适宜生长的温度范围较广,对外界环境的变化具有一定的抵抗能力。
2.4.4 初始NaCl质量浓度
微生物细胞的渗透压可以通过Na+、K+等简单的金属离子和化合物来维持。高质量浓度 NaCl会抑制微生物的酶活性,导致其呼吸速率、生长繁殖速率和对营养物质的吸收能力降低,另外高盐环境会使细胞处于高渗状态,细胞容易脱水甚至死亡(Kai et al.,2012;Pendashteh et al.,2010)。而当NaCl质量浓度过低,细胞处于低渗环境时引起细胞膨胀,亦会影响微生物的吸收能力。生存环境为等渗状态时,微生物的生长情况较好。
不同质量浓度的NaCl对菌株YZ-1降解菜籽油的影响结果如图3d所示,当NaCl质量浓度处在0—15 g·L−1时,菌株YZ-1对油脂均有降解效果。油脂降解率最高时所对应的 NaCl质量浓度为 2.5 g·L−1,随着环境中NaCl质量浓度不断增大,菌株YZ-1细胞中的水不断向细胞外渗透,影响菌株生长,导致油脂降解率逐渐减弱,但当NaCl质量浓度达到 10 g·L−1和 15 g·L−1时,菌株 YZ-1 在 72 h内对油脂的降解率分别为 44%、35%,远远高于Yan et al.(2018)4-5所筛选出的2株耐盐油脂降解菌在同等NaCl质量浓度下经5 d时间对油脂的降解率。为验证在低渗情况下菌株YZ-1的生长状况,本研究对NaCl质量浓度为0时的情况做了实验,实验结果显示在不加NaCl时菌株YZ-1的生长情况良好,主要原因是由于培养基中含有大量的K+,它不但是细胞内某些酶的激活剂,而且也可以简单维持细胞的渗透压,虽然菌株YZ-1处于低渗状态,但是对其生长增殖的影响并不是很大。
2.5 油脂降解菌对实际污水的降解
经过油脂降解条件的单因素优化实验,得到了在72 h内当接种量为12%(V/V)、pH为8、温度为 30 ℃、初始 NaCl质量浓度为 2.5 g·L−1时分别对应了各条件下的最高油脂降解率。进一步通过实验研究菌株YZ-1在最优条件下对实际污水中的油脂和CODCr的降解效果,结果如表3所示。菌株YZ-1对于实际污水中CODCr的降解作用如图4所示。
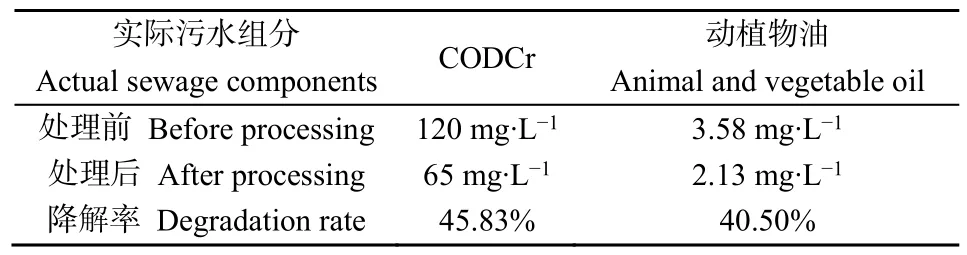
表3 菌株YZ-1对实际污水的降解Table 3 Degradation of actual sewage by strain YZ-1
3 结论
从兰州市某生活污水厂取得剩余污泥样品,将其进行富集驯化、分离筛选获得一株油脂降解菌,并对该菌进行了鉴定和单因素降解条件的优化,结论如下所述:
(1)筛选得到一株菌株 YZ-1在以菜籽油为唯一碳源的培养基中生长良好。经过鉴定菌株 YZ-1与铜绿假单胞菌(P.aeruginosa)的相似度在99.9%以上,因此该菌株为铜绿假单胞菌(P.aeruginosa)。
(2)对降解特性进行初步研究发现菌株 YZ-1在72 h内对油脂的降解率可达到55%,说明该菌株可以分泌脂肪酶,具备降解油脂的功能。不同共基质对油脂的降解效果影响不同,淀粉作为共基质一定程度上促进了菌株YZ-1的生长,从而提高了油脂降解率。

图4 菌株YZ-1对实际污水中CODCr的降解率Fig. 4 Degradation rate of CODCr in actual sewage by strain YZ-1
(3)对菌株 YZ-1进行单因素降解条件的优化实验,最终发现当接种量为12%(V/V)、pH为8、温度在 30 ℃、NaCl质量浓度为 2.5 g·L−1时,菌株YZ-1在72 h内对油脂的降解率达到最大值,分别为 59.42%、61.28%、55.33%、64.14%,对应的菌体细胞密度均大于 2.5。且当接种量在 6%—14%(V/V),pH在7—9,温度在30—40 ℃,NaCl质量浓度在0—5 g·L−1范围内,菌株YZ-1生长良好,降解率波动不大。
(4)研究菌株 YZ-1对实际污水的降解效果,在接种量为12%(V/V)、pH为8、温度为30 ℃、NaCl质量浓度为2.5 g·L−1下菌株YZ-1对实际污水中的油脂和 CODCr的降解率分别为 40.50%和45.83%。
