海南红树林沉积物中多环芳烃降解菌群组成及降解率的比较研究
2020-08-20龚莹王海花马思远林雨彬刁晓平
龚莹 ,王海花 ,马思远,林雨彬 ,刁晓平, *
1. 海南大学环境与生态学院,海南 海口 570228;2. 海南大学南海海洋资源利用国家重点实验室,海南 海口 570228;3. 海南师范大学生命科学学院, 海南 海口 571158
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)作为一种广泛存在于自然界中的污染物,对生物具有普遍的致癌性、致畸性及致突变性(Blumer,1976);又因其疏水性较难被分解利用,能在环境中长时间存在积累(Ribes et al.,2003)而受到广泛关注。地表径流和大气是PAHs传输的主要途径,红树林生态系统处于海洋、陆地、大气的动态交界面,使其更易积累来自三方的污染。已有研究表明红树林表层沉积物中 PAHs的积累量较大,众多红树林超过1500 ng·g−1,香港红树林 PAHs浓度超过5000 ng·g−1,印度塔那溪红树林超过 1600 ng·g−1(Sukhdhane et al.,2015;Domínguez et al.,2010;Klekowski et al.,1994;Tam et al.,2001;Wang et al.,2015;Wu et al.,2014)。由于红树林环境较为特殊且复杂,在长期的自然选择下形成了独特而又丰富的微生物类群(龙寒等,2005)。
目前去除PAHs的方法主要有物理、化学及微生物处理方法。微生物降解PAHs具有低成本,环境安全性高等优点,已成为PAHs污染修复的重要技术(陈铮等,2019)。研究表明可从有PAHs污染的环境中筛选得到PAHs降解菌,已有许多研究从焦化厂、码头等存在PAHs污染的不同环境介质中筛得PAHs降解菌(Arias et al.,2017;李晓斌等,2010;徐虹等,2004)。此类研究多关注单一降解菌的降解特性,但由于单菌对PAHs的降解能力有限,且环境中微生物和PAHs均不是单独存在,故研究PAHs降解菌群具有更好的应用前景。
中国红树林面积共有1.5×104hm2,海南是主要的红树林分布区之一,面积4638 hm2,占全国红树林总面积的33%(陈绵俊,1996;严承高等,1999)。已有研究从海南东寨港等地红树林沉积物中检出PAHs(Qiu et al.,2018;Zhang et al.,2018)。故本研究希望能从海南不同红树林分布区的沉积物中筛选PAHs的降解菌群比较PAHs的降解菌群降解特征,并阐明菌群降解率和菌群结构之间的关系,为环境中PAHs污染区域修复提供理论依据。得到对PAHs降解较为高效的菌群,基于其结构为提高PAHs污染修复效率提供一定参考。
1 材料方法
1.1 材料
1.1.1 采样
于2018年8—9月,从海南红树林分布区域(澄迈、儋州、东寨港、三亚、文昌)采集了24个样点的红树林表面0—5 cm沉积物样品。每个采样点设置10 m×10 m的正方形样方,采用五点采样法进行样品采集,5个样品混合均匀后置于冰盒中当天运回实验室进行菌群富集实验。采样点如图1所示。
1.1.2 仪器试剂
仪器:高效液相色谱(HPLC)、氮吹仪、PCR仪、凝胶成像仪、纯水机。
试剂:菲(3-环)、芘(4-环)、苯并(a)芘(5-环)、乙酸乙酯(分析纯)、乙腈(色谱纯)、甲醇(色谱纯)、10%盐度海水(由陈海水配制)、二甲基亚砜(DMSO)。
1.1.3 培养基配制
无机盐(MSM)培养基:K2HPO41 g,NaH2PO41 g,CaCl20.02 g,MgSO4·7H2O 0.2 g,NaCl 0.5 g,FeSO4·7H2O 0.01 g,NH4NO31 g 溶于蒸馏水中并定容至1 L,调pH至7.0,灭菌待用。
营养(LB)培养基:牛肉膏5 g,蛋白胨10 g,NaCl 5 g溶于蒸馏水中并定容至1 L,调pH至7.0,灭菌待用。
PAHs A培养基:在灭菌后的锥形瓶中分别加入 1 mL 菲(1 mg·mL−1)、1 mL 芘(1 mg·mL−1)及 0.5 mL 苯并(a)芘(0.5 mg·mL−1)的 DMSO 溶液,待DMSO挥干后加入50 mL MSM。
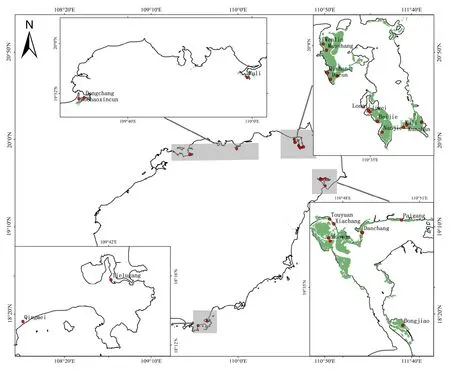
图1 采样点Fig. 1 Sampling sites
PAHs B培养基:将菲、芘、苯并(a)芘三类PAHs混合液(溶剂为DMSO)加至50 mL MSM培养基中,使培养基中的菲、芘、苯并(a)芘的终浓度分别为 20、20、5 mg·L−1。
PAHs C培养基:PAHs平板筛选培养基,于MSM平板培养基上涂布PAHs A培养基使用的3种PAHs DMSO 溶液,菲(100 μL)、芘(100 μL)、苯并(a)芘(50 μL),挥尽DMSO待用。
1.2 降解菌群富集及其降解率测定
1.2.1 菌群富集
取沉积物样品5 g,置于45 mL灭菌海水(盐度10%)中振荡30 min,后静置5 min,取5 mL上清至45 mL PAHs A培养基中,每个采样点设3个重复。在30 ℃,130 r·min−1转速下进行避光培养,培养至14 d后,取5 mL富集液转接至PAHs A培养基继续培养,连续转接4代,得到混合菌群。
1.2.2 PAHs的提取及分析
取 4 mL 第 4 代的菌液 6000 r·min−1离心 6 min获得菌体,用500 μL MSM悬浮菌液后加入培养基中,以不接种菌液的PAHs B培养基为空白对照,以菌群富集的相同条件培养14 d后,用50 mL乙酸乙酯振荡2 min萃取残留的PAHs。萃取液过滤(0.22 μm滤膜)取1 mL,氮吹干后用乙腈(色谱纯)定容至1 mL,待HPLC测定。
分析仪器为HPLC(Agilent 1260),菲、芘、苯并(a)芘分别使用250、239、295 nm波长检测,进样量为5 μL,流动相为超纯水:乙腈(40:60),流速为 1 mL·min−1。
1.3 菌株分离鉴定
将富集得到的混合菌群用PAHs C培养基培养1代后同种培养基划线分离一代,再用LB平板划线分离纯化得到单一菌落,镜检菌体,再提取得到的单菌落DNA,以27F 5′-AGAGTTTGATCATGGC TCAG-3′, 1492R 5′-TAGGGTTACCTTGTTACG ACTT-3′为引物PCR,将PCR产物送样测序(天一辉远生物科技有限公司)。测序结果在NCBI上blast比对分析,挑选出同源序列,选择相似性较高的序列,并利用Mega软件进行系统发育分析,使用邻接法构建系统进化树。
2 结果
2.1 不同样点混菌的降解率
通过对各个采样点混合菌群降解率的测定,发现本研究区域中所有菌群对3种PAHs的平均降解效率以菲(79%)最高,其次是芘(77%),最低为苯并(a)芘(23%),结果如表1所示。其中,菌群对菲的降解率以Q15最高:95%,Q23最低:14%;菌群对芘的降解率以Q12最高:94%,Q23最低:35%;而菌群对苯并(a)芘的降解率则是 Q9最高:50%,Q19最低仅2%。经统计学分析,发现菲和芘的降解率没有显著性差异(P>0.05),而苯并(a)芘的降解率显著低于菲和芘的降解率(P<0.05)。
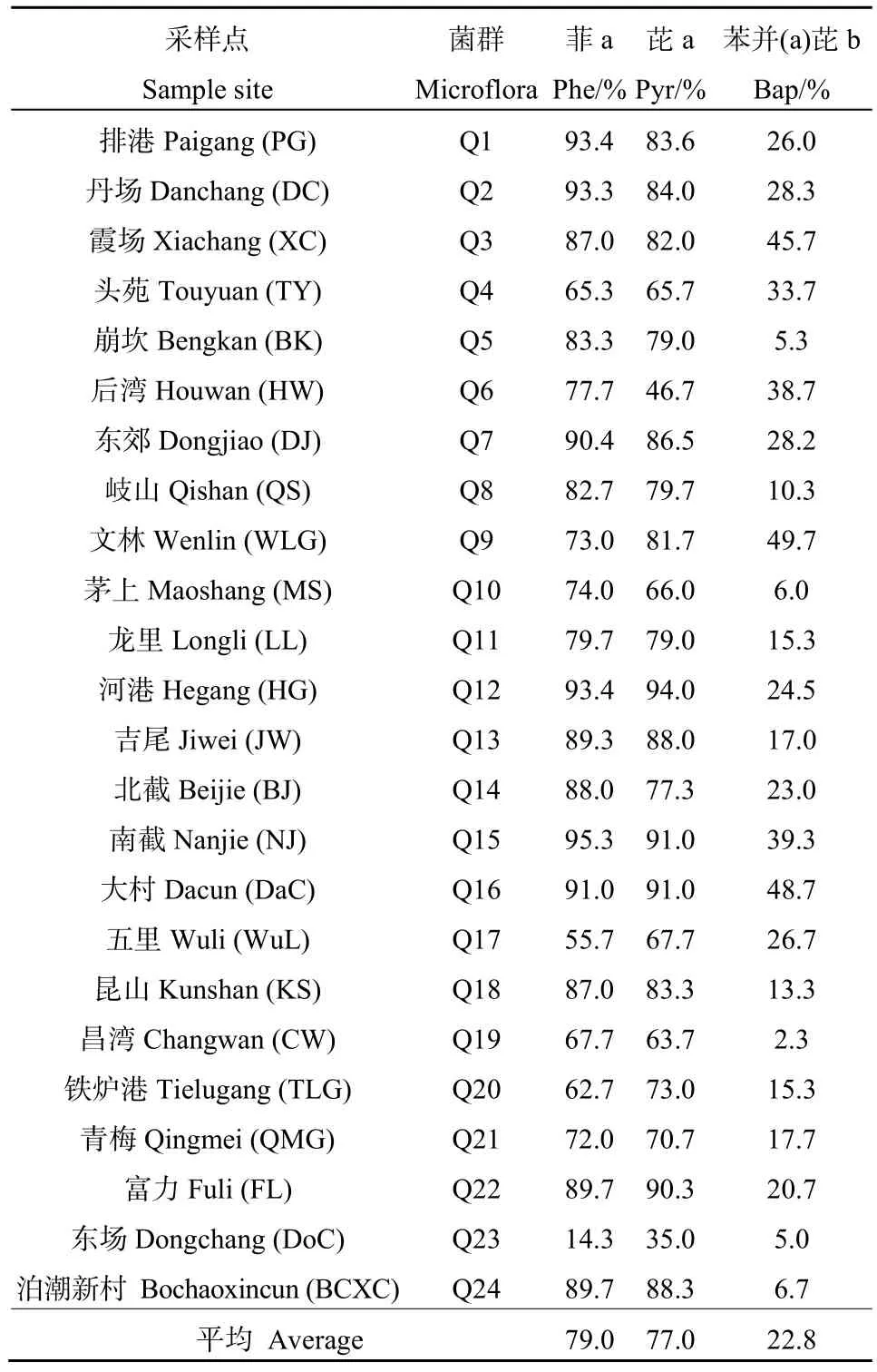
表1 混合菌群降解率Table 1 The degradation rates of PAHs by microflora
2.2 混合菌群的群落结构分析
采用分离培养的方法得到的菌群组成如表2所示。其中菲降解率最高的Q15菌群筛得贪噬菌1株,剑菌1株;菲降解率最低的Q23菌群筛得假单胞菌2株,伯克氏菌3株。芘降解率最高的Q12菌群筛得伯克氏菌1株,鞘脂单胞菌1株;芘降解率最低的Q23菌群筛得假单胞菌2株,伯克氏菌3株。对苯并(a)芘的降解率较高共筛得5个菌群,其中对苯并(a)芘降解率最高的为Q9菌群(49.7%),筛得申氏杆菌2株;其次是Q16菌群(48.7%),筛得鞘氨醇杆菌1株,申氏杆菌1株,食酸菌1株,螺旋菌1株;Q3(45.7%)筛得假单胞菌3株;Q15菌群(39.3%)筛得贪噬菌1株,剑菌1株;Q4菌群(33.7%)筛得鞘脂单胞菌1株,申氏杆菌1株,贪噬菌2株。

表2 不同PAHs降解菌群的群落组成Table 2 The composition of degradation bacteria
本研究从富集到的 24个菌群中共分离得到了81株PAHs降解菌,通过对16S rDNA测序结果进行blast对比,确认筛得的81株菌属于23个属60个种,除两株为厚壁菌门外,其余为变形菌门。菌群Q16有1株菌DAC9的序列与最相近的,可能是潜在的新菌。所有筛得降解菌的系统发育树见图2。系统发育树主要可分为 5簇,其中申氏杆菌属(Shinella)、剑菌属(Ensifer)、双头菌属(Labrys)、鞘脂单胞菌属(Sphingopyxis)、鞘氨醇单胞菌属(Sphingobium)、短波单胞菌属(Brevundimonas)、固氮螺旋菌属(Azospirillum)、芽孢杆菌属(Bacillus)、螺旋菌属(Spirosoma)、假黄色单胞菌属(Pseudoxanthomonas)、寡养单胞菌属(Stenotrophomonas)、假单胞菌属(Pseudomonas)为一簇。假黄色单胞菌属DC2单成一簇。伯克氏菌属(Burkholderia)、潘多拉菌属(Pandoraea)、青枯菌属(Ralstonia)为一簇。贪噬菌属(Variovorax)、假食酸菌属(Pseudacidovorax)、食酸菌属(Acidovorax)、嗜脂环物菌属(Alicycliphilus)、Diaphorobacter属为一簇。卡斯特兰尼菌属(Castellaniella)、噬染料杆菌属(Pigmentiphaga)、无色杆菌属(Achromobacter)为一簇。
3 讨论
迄今为止,已有研究报道从不同环境介质中筛选得到多种对PAHs有降解能力的微生物,现已筛选得到70多个属,200多株对PAHs有利用能力的微生物,包括微藻、真菌、细菌等,其中真菌和细菌占多数(Arias et al.,2017)。且很多PAHs降解菌是从红树林沉积物中筛得的,如:福建九龙江河口红树林(骆苑蓉等,2005)、香港米埔红树林(殷波等,2005)、珠海淇澳岛红树林(李玫等,2011)、广州番禺莲花山红树林(李玫等,2012)等,筛得黄杆菌、假单胞菌、弧菌、红球菌、鞘氨醇单胞菌等PAHs降解菌。从大西洋洋中脊表层沉积物中筛得由盐单胞菌属、食烷菌属、海旋菌、Tistrella属组成的PAHs混合物(萘、菲、芘)降解菌群(崔志松等,2009)。从广州石化厂筛得的由假单胞菌属和潘多拉菌属组成的菌群 GP3对芘有较强降解能力(陈晓鹏等,2008)。从油污土壤中筛得由杆菌属、盐单胞属、泛菌属、假单胞菌属菌组成的降解菌群分别对 25 mg·L−1的菲和芘在 15 d时降解75.3%和52.0%,略低于本研究Q15、Q16等菌群(宋立超等,2012)。本研究在海南红树林沉积物中筛得PAHs降解菌种类与上述研究存在一定差异,可能是由于筛选环境、微生物类群、筛选底物、筛选浓度等多种因素的差异共同导致。本研究筛得双头菌属虽王守志等人用混合 PAHs(菲、荧蒽、芘)及 Ma et al.(2010)和 Wang et al.(2012)用混合PAHs(菲、芘、苯并(a)芘)筛选所得菌群中含有双头菌属,但未对其本身降解特性进行研究,而本研究筛得螺旋菌属及卡斯特兰尼氏菌属的细菌对PAHs的降解特性少有报道,其他所得菌属中已有研究的如表3所示。基于传统培养分离得到的菌是菌群中优势菌属(Huang et al.,2008),有研究指出的降解菌有一定的降解偏好(李晓明等,2012),结合表1、表2的结果,菌群Q11仅筛得伯克氏菌3株,Q19仅筛得贪噬菌2株,Q21仅筛得1株鞘脂单胞菌,推测伯克氏菌属、贪噬菌属和鞘脂单胞菌属偏好降解中 3-、4-环 PAHs(菲和芘),说明菌群中优势菌属的降解偏好一定程度上影响了菌群降解能力。菌群Q9仅筛得申氏杆菌2株,其苯并(a)芘降解率最高(49.7%),Q4、Q16对苯并(a)芘降解率接近Q9,这两个菌群中均筛得申氏杆菌,故说明申氏杆菌对于苯并(a)芘的降解可能有重要作用。

图2 所得降解菌进化树Fig. 2 Neighbor-Joining phylogenetic tree of PAHs-degrading bacteria and their closest NCBI (BLAST) relatives based on 16S rRNA gene sequences
芽孢杆菌是已知的能降解苯并(a)芘的菌属之一(Cerniglia,1992),假单胞菌属降解菌多降解低环PAHs,对高环PAHs也有一定降解能力(Chebbi et al.,2017;Zhao et al.,2009),与 MS(鞘氨醇杆菌)相似度达 99%的菌株Sphingobium barthaii可降解菲、荧蒽、苯并[a]蒽等高分子量PAHs(Saraf et al.,2019),结合表3和图2发现降解偏好相似的菌属可聚做一簇。菌群Q1、Q2 3种PHAs降解率相似,Q1筛得假单胞菌 2株,假黄色单胞菌 1株,双头菌1株;Q2筛得假单胞菌3株,假黄色单胞菌1株,假食酸菌1株。Q1、Q2两个菌群筛得菌属相似及筛得的假单胞菌聚为一簇,表明群落结构相似的菌群其降解能力相似,进化距离相近的菌可能具有相近的功能。菌群 Q5、Q18均筛得潘多拉菌,且两个菌群对菲和芘的降解率相近,推测潘多拉菌属偏好于降解菲和芘。仅菌群Q23由假单胞菌属和伯克氏菌属组成,对3种PAHs降解率均低,说明这两个菌属对PAHs的降解可能存在相互抑制的作用。菌群Q7、Q12、Q22均筛得嗜脂环物菌,但Q12对菲、芘的降解率高于其余两个菌群,因此鞘脂单胞菌属和嗜脂环物菌属可能相互促进对菲、芘的降解。基于菌群Q15、Q12的降解结果,推测贪噬菌属和剑菌属共同存在时利于菲的降解,伯克氏菌属与鞘脂单胞菌属共同存在时利于芘的降解。由李晓明等(2012)在 2012年的研究可知降解菌单独存在时一般只适合低分子量PAHs的降解,但在菌群中则可能能降解更多分子量 PAHs,故虽Q5、Q6、Q8、Q11等菌群中没有筛得能直接利用高分子量PAHs的菌属但对苯并(a)芘也有一定利用能力。
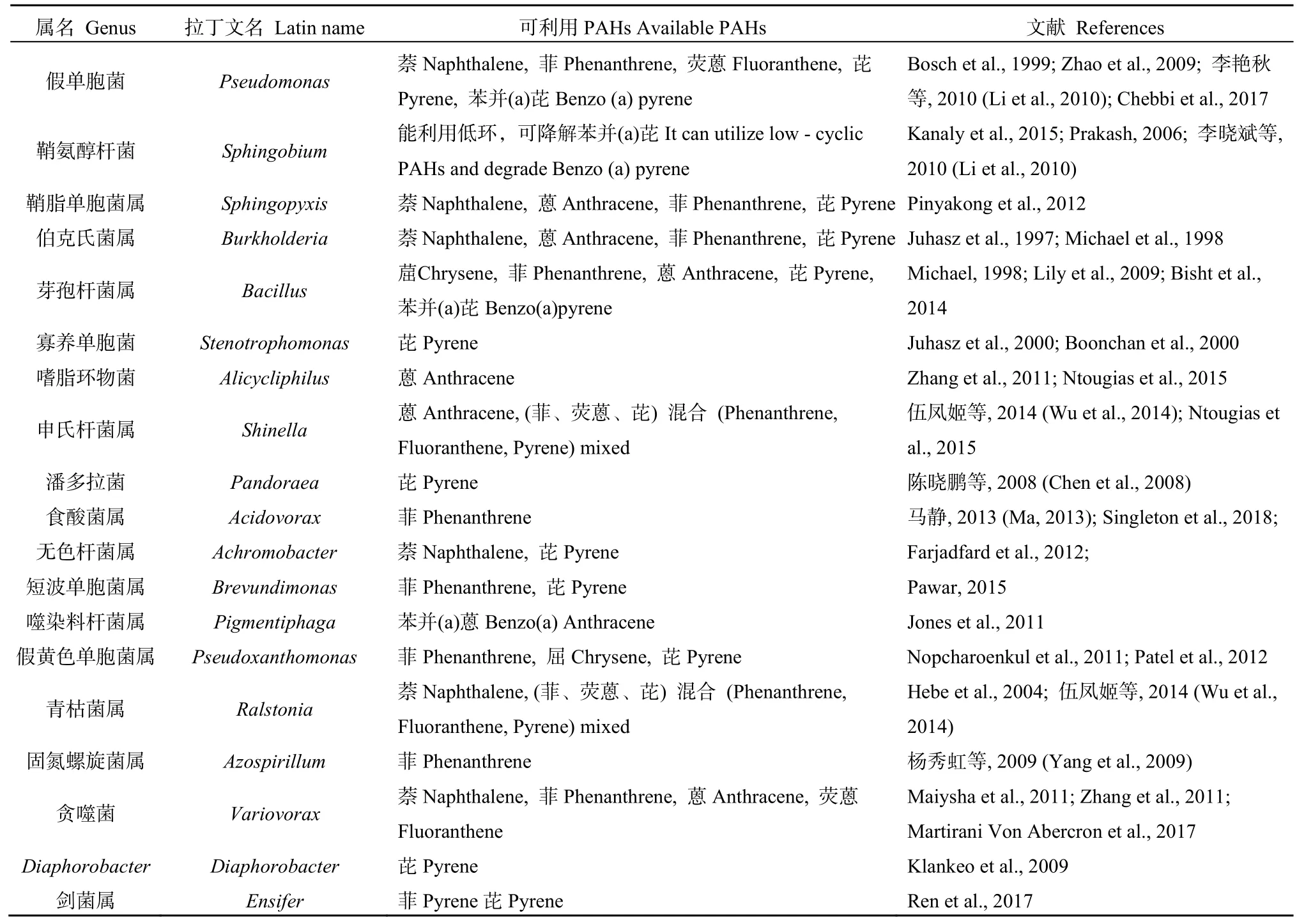
表3 已报道的PAHs降解菌属及降解能力Table 3 PAHs degradation strains and the microbial transformation ability
4 结论
在对PAHs的研究中,认为低环的PAHs更易被微生物利用,在本研究中所筛菌群的降解率再次验证此规律。海南红树林沉积物中存在多种 PAHs降解菌,其中双头菌属、螺旋菌属及卡斯特兰尼氏菌属对PAHs的降解特性少有报道,DAC9与最相近的菌株(Spirosoma terrae)相似度仅为97%,可能是潜在的新菌。菌群Q15菲降解率最高达95.3%,菌群Q12芘降解率最高为94%,Q9苯并芘降解率最高为49.7%。贪噬菌属和剑菌属共同存在时可能利于菲的降解,伯克氏菌属与鞘脂单胞菌属共同存在时可能利于芘的降解,鞘脂单胞菌属和嗜脂环物菌属可能能相互促进对菲、芘的降解,潘多拉菌属可能能抑制寡养单胞菌对苯并(a)芘的降解能力,申氏杆菌对于苯并(a)芘的降解可能有重要作用,假单胞菌属和伯克氏菌属可能存在相互抑制作用,这些推测需实验进一步验证。由于传统培养的局限性,菌群中其他可能对PAHs降解有重要作用的菌未分离得到,且菌群中菌间相互作用尚不清楚,仍需进一步研究。
