环境和微生物因子对隆宝滩不同植被类型土壤甲烷通量的影响
2020-08-20管崇帆何方杰韩辉邦马学谦张劲松孙守家
管崇帆 ,何方杰 ,韩辉邦,马学谦,张劲松 ,孙守家 *
1. 中国林业科学研究院林业研究所/国家林业局林木培育重点实验室,北京 100091;2. 南京林业大学南方现代林业协同创新中心,江苏 南京 210037;3. 青海省人工影响天气办公室,青海 西宁 810001
甲烷(CH4)是最重要温室气体,其100年尺度增温潜势是 CO2的 25倍左右(IPCC,2013),且通过改变大气的氧化能力来间接影响气溶胶或其他化学物质(Shindell et al.,2009)。CH4在空气中的体积分数比工业化前增长了2.5倍(Hu et al.,2017),贡献了自工业时代以来约 20%温室气体的总排放量(Kirschke et al.,2013)。全球CH4源总强度约为 600 t·a−1(Lelieveld et al.,1998),主要来源于自然源(湿地生态系统)和人类活动。湿地生态系统中的大部分土壤处于厌氧环境中,产甲烷菌分为乙酸营养型、氢营养型和甲基营养型3种类型(王世全等,2016),通过甲基辅酶 M 还原酶催化来分解有机物产生CH4(Feng et al.,2020;杨秀清等,2017),所有产甲烷菌的基因组都可编码α亚基(mcrA)基因。甲烷氧化菌(MOB)分为 I型和 II型,在有氧条件下通过自身甲烷单加氧酶(MMO)催化将CH4转化为CO2(王玉芳等,2019),除了 Methylocella,几乎所有的甲烷氧化菌都有pmoA基因。故此,mcrA基因和pmoA基因被广泛用于产甲烷菌(Li et al.,2017)和甲烷氧化菌(莫永亮等,2019)的检测中。CH4排放受土壤中产甲烷菌产生和甲烷氧化菌消耗共同控制,气候变化对其排放产生深远影响(顾航等,2018)。因此,开展产甲烷菌和甲烷氧化菌共同影响 CH4排放的机理研究,对于理清湿地生态系统中CH4动态变化具有重要意义。
青藏高原上分布着大面积的高寒草地和高寒湿地,许多学者对青藏高原CH4吸收(Fu et al.,2018)、源汇转换(Mu et al.,2017)、非生长季节排放(Song et al.,2015)以及微生物影响(Zhang et al.,2019)等方面进行研究,不同干扰(张俊珍等,2019)和不同植被类型CH4排放差异亦被报道,不同植被类型可能是甲烷源也可能是汇(Christensen et al.,2000),这与土壤微生物的活性和丰度有关。先前研究发现植被或物种之间的甲烷氧化菌活性在存在差异(Yang et al.,2013),但产甲烷菌和甲烷氧化菌结构与CH4通量无关(Kao-Kniffin et al.,2010),显示出微生物与不同植被类型 CH4排放关系的复杂性(Christiansen et al.,2016)。在全球模型模拟中,湿地多作为CH4的源输入到模型中,但青藏高原湿地生态系统存在多种植被类型,均作为源输入到模型中容易高估CH4的排放(Wei et al.,2015b)。因而,理清高寒地区不同植被类型CH4排放差异及其与微生物和环境的关系,对于准确建立青藏高原甲烷循环模型以及全球气候变化预测具有重要意义。
青海隆宝滩国家级自然保护区位于三江源核心区,高寒草原、草甸、沼泽和湖泊高度发达,空间分布差异明显,植被类型丰富,是研究不同植被类型土壤微生物与碳排放关系的理想场所。因此,本研究对高寒草地(Alpine grassland,AG),沼泽化草甸(Marsh meadow,MM)和高寒沼泽(Alpine marsh,AM)的土壤理化性质、产甲烷菌和甲烷氧化菌丰度进行测定,同时使用便携式土壤温室气体测量系统,测定其CH4通量及相关的环境因子,旨在确定3种植被类型的:(1)CH4通量差异;(2)产甲烷菌和甲烷氧化菌丰度差异;(3)CH4通量与微生物和环境因子之间的关联。通过本研究,期望能确定隆宝滩不同植被类型CH4通量的差异及与生物因子和环境因子的关系,为精确估算青藏高原高寒地区的碳排放提供数据支持。
1 材料与方法
1.1 研究地概况
隆宝滩国家级自然保护区(33°09′—33°12′N,96°30′—96°35′E,海拔 4200 m)位于青海省玉树藏族自治州境内,地处三江源国家公园核心区域,雨量充沛,年际间降雨量变化大,年均降雨量在500—600 mm之间,集中在6—9月,年均气温在−2.0 ℃左右,极端最高气温27 ℃,月平均气温在−7.6—12.7 ℃之间,为高原大陆性气候。保护区东西长25 km,南北宽约4.2 km,核心区面积约为75.73 km2,两侧为低丘山地,中间为草甸沼泽区,分布着AG、MM和AM等3种典型植被类型。其中,AG位于低丘山地,水位较低,植被以小蒿草(Kobresia pygmaea))和紫花针茅(Stipa purpurea)等为主,AM位于谷底区域,常年积水植被较少,以藏嵩草(K.tibetica)、杉叶藻(Hippuris vulgaris)为主,MM位于低丘与沼泽之间,条带状分布,植被茂盛,以藏嵩草(K.tibetica)和圆囊苔草(Carex orbicularis)为主,伴生星状风毛菊(Saussurea stella)和矮金莲花(Trollius farreri)等植物,所处位置如图1所示。本试验在隆宝滩上中下游的3种植被类型分别设定3块20 m×20 m样地,样地周围用网围栏封育,在每个样地随机设定3个采样点。
1.2 采样和测定方法
1.2.1 气象数据测定
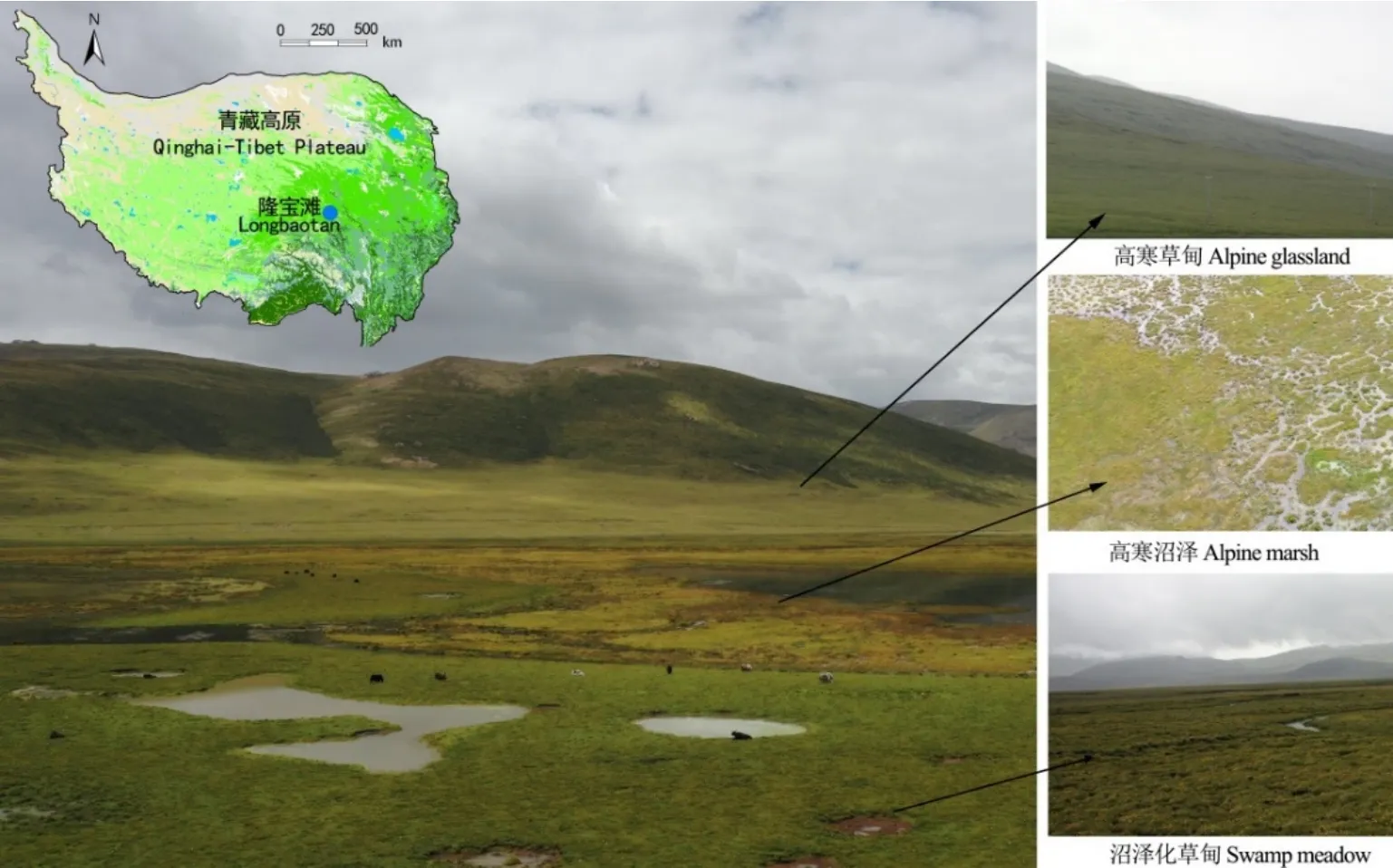
图1 试验地点示意图Fig. 1 Location of experimental sites
在隆宝滩内设立小型自动观测气象站,不同土层中(5、10、15、20 cm)安装AV-10T土壤温度(Avalon Inc,美国)、EC-H2O土壤湿度(Avalon Inc,美国)、AV-3665R雨量计(AVALON Inc,美国)、HMP45C空气温湿度(Vaisala,Helsinki,芬兰)和LI190SB太阳辐射(Li-cor Inc,美国)传感器,测定土壤温度(ts)和湿度(Ms)、降雨量(P)、空气温度(ta)、相对湿度(RH)以及太阳辐射(Ra),数据采集器为CR1000(Campbell,美国),设置每10 min采集1次,每1 h输出1组平均值。
1.2.2 土壤理化性质和生物量测定
在生长季节的5—10月,对不同植被的土壤分3层(0—10、10—20、20—30 cm)每月中旬取样一次,装入密封袋,用低温 0—5 ℃,保存运回实验室,一部分用于土壤理化性质测定,另一部分用产甲烷菌和甲烷氧化菌丰度测定。土壤有机碳的测定方法采用重铬酸钾氧化—外加热法,土壤全钾采用微波消解ICP-OES法测定,全氮采用凯氏半微量定氮法测定,铵态氮采用0.5 mol·L−1K2SO4靛酚蓝比色法测定,硝态氮采用分光光度计法测定,将 3层土壤进行容重加权计算获得不同植被土壤理化性质的平均值。生物量测定是在2018年8月底生长高峰时期,在每个样地上随机设置5个25 cm×25 cm的小样方,用收割法测定地上生物量和挖掘冲洗法测定0—30 cm地下生物量(王文颖等,2007)。
1.2.3 土壤微生物基因组总DNA的提取
每个土样称取0.5 g,利用土壤基因组DNA抽提试剂盒(SoilGen DNA Kit,北京康为世纪生物科技有限公司)对土壤基因组总DNA进行提取,超微量分光光度计检测DNA总浓度和纯度,提取的DNA样品保存在−20 ℃冰箱中。
1.2.4mcrA和pmoA基因丰度测定
以纯化的 DNA作为模板,选用 ME1:GCMATGCARATHGGWATGTC 和 ME2:TCATKGCRTAGTTDGGRTAGT引物对扩增mcrA基因,利用引物 A189f(5′-GGNGACTGGGAC TTCTGG-3′)和 mb661r(5′-CCGGMGCAACGTCY TTACC-3′)扩增pmoA基因,引物由能更好地分离扩增产物,通常引物5′端加一段高GC含量的序列(CGCCCGCCGCGCGCGGCGGGCGGGGCGGGG GCACGGGGG)。参照北京康为世纪生物科技有限公司的2xEs Taq MasterMix(Dye)说明书进行PCR反应,反应结果进行凝胶电泳检测。
PCR扩增产物用SanPrep柱式DNA胶回收试剂盒进行纯化,与pEASY-T1载体(北京全式金生物技术有限公司)连接,构建质粒后转化到大肠杆菌DH5α感受态细胞中,通过蓝白斑试验筛选出阳性转化菌。用质粒DNA小量抽提试剂盒提取mcrA和pmoA阳性质粒DNA,使用超微量紫外分光光度计测定浓度,存−20 ℃备用。将制备好的质粒标准品10倍梯度稀释,每个稀释度2个平行样品,取其平均值,以定量PCR反应的循环数为横坐标,以不同模板拷贝数的对数为纵坐标,分别绘制其标准曲线。
在最优扩增条件下对土壤微生物DNA样品进行real-time PCR扩增,对扩增后的土壤产甲烷菌和甲烷氧化菌进行定量检测,将得到的每个样品对应的值带入标准曲线方程中,计算样品中的拷贝数,并以每克土壤(干质量)为单位给出不同植被类型土壤中产甲烷菌和甲烷氧化菌的丰度(copies·g−1)。
1.2.5 CH4通量测量
使用 915-0011型土壤碳通量测定系统(LGR Inc,美国)测定CH4通量,测定方法同何方杰(何方杰等,2019)。测量时间为2018年5—11月,选择晴天或者少云的09:00—12:00时段,观测频率为每月3次。CH4通量是通过呼吸室内气体浓度随时间变化的直线斜率计算获得,当决定系数R2≥0.9时认为数据有效,当R2<0.9时,剔除数据,CH4通量计算公式如下:

式中:Fc为土壤被测气体通量,单位为nmol·m−2·s−1,V为气路总体积(cm3),P0为气室初始气压(kPa),W0为气室内部初始水汽浓度( nmol·mol−1),R为 理 想 气 体 常 数 ( 8.314 Pa·m3·K−1·mol−1),S为气室覆盖的面积(cm2),T0为气室初始气温(℃),∂C′/∂t为 CH4浓度随时间的变化率(μmol−1·mol·s−1)。
1.3 数据处理
对不同植被的CH4通量进行配对t检验,计算获得月尺度、年尺度CH4通量均值,IBM Statistics 24对不同植被的mcrA和pmoA丰度、土壤温湿度、营养元素、CH4通量等进行One-way ANOVA分析并用最小显著差数法(LSD)进行多重比较,统计分析水平为α=0.05。采用Pearson相关系数评价月尺度上 CH4通量与环境因子的关系,使用 R语言Hmisc和 corrplot程序包绘制相关系数图,其余图片使用Excel 2010绘制。
2 结果与分析
2.1 环境因子和生物量

图2 2018年研究点气温(ta)、降水量(P)、土壤温度(ts)以及不同植被类型土壤湿度(Ms)变化Fig. 2 Variation of air temperature (ta)、precipitation (P) and soil temperature (ts) at the experimental site and the difference of soil humidity (Ms)among different vegetation types in 2018
图2所示,因海拔超过4200 m,隆宝滩2018年年均温仅有−0.59 ℃,4月下旬日均温度开始超过 0 ℃,10月下旬日均温度开始低于冰点,最高月均温度出现在 7月,为 10.3 ℃,极端低温为−29.81 ℃,极端高温为 21.45 ℃。2018年 5—11月的降水量为590.4 mm,但主要集中在6—9月,降水天数较多,约134 d,约占5—11月日数的63%,然而单次降水量少,最高日降水量仅为25.8 mm。土壤温度呈先升后降的变化趋势,最高温度出现在7月,随后保持平稳,9月上旬开始下降,11月后低于0 ℃,在0—4月和11—12月中,5 cm土壤温度较低,20 cm土壤最高,5—10月则相反。AG土壤湿度在降水较多的7月和9月较高,呈双峰曲线变化,9月达到最高值25.58%,MM和AM的土壤湿度呈单峰曲线变化,分别在8月和9月达到峰值(为44.11%和50.97%)。统计显示,2018年AG年均土壤湿度为 19.81%,低于 MM(37.15%)和AM(39.05%),差异显著(P<0.05)。
AG 土壤有机碳质量分数为 (45.31±18.62)g·kg−1,约为 MM (162.08±10.84) g·kg−1和 AM(183.95±9.17) g·kg−1的四分之一,差异显著(P<0.05)(图 3)。AG 土壤总氮质量分数为 (4.08±2.11)g·kg−1,约为 MM (12.05±1.14) g·kg−1和 AM (13.40±5.32) g·kg−1的三分之一,其中硝态氮差异不显著,但 AG的铵态氮 (5.01±1.17) μg·g−1仅为 MM和AM的31.18%和27.05%,差异显著(P<0.05),表明总氮差异主要是由铵态氮造成的。AG全钾质量分数为 (21.56±2.43) g·kg−1,显著高于 MM 和 AM(P<0.05)。AG的地上地下生物量显著低于MM和AM(P<0.05),3种植被的地下部分生物量约为地上部分的10—15倍,是总生物量的主要部分。
2.2 CH4通量的变化
图4结果显示,在生长季节中,MM和AM中的CH4通量均为正值,表现为CH4源,呈先升后降的变化趋势,5月份 CH4通量较低,小于 2 nmol·m−2·s−1,从 6 月开始逐步升高,在 9 月初达到最 高 值 , 分 别 为 (31.75±8.54) nmol·m−2·s−1和(42.22±14.07) nmol·m−2·s−1,随后开始下降,11 月降到 5 nmol·m−2·s−1左右,AM的CH4通量略高于MM。AG的CH4通量月均值均为负值,表现为CH4的汇,呈先降后升的变化趋势,5—6月和 9—11月 CH4通量在−0.2— −0.1 nmol·m−2·s−1之间波动,7 月开始下降,8 月降到最低值−0.5 nmol·m−2·s−1左右,随后升高。统计显示,AG、MM和AM中的CH4通量分别是−0.14、11.02 和 14.51 nmol·m−2·s−1,AG 显著低于MM和AM(P<0.05)。
2.3 macrA和pmoA的变化

图3 不同植被类型土壤有机碳、氮、钾及生物量差异Fig. 3 The differences of organic carbon, nitrogen, potassium in soil and biomass among different vegetation types
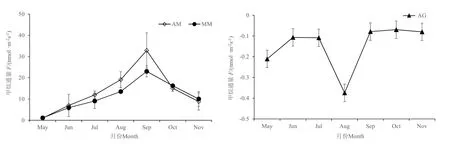
图4 不同植被类型的CH4通量(F)变化Fig. 4 Variation of CH4 flux (F) in different vegetation types
产甲烷菌种群数量与CH4排放关系密切,表1结果显示3种植被类型的mcrA基因丰度随着时间呈先升后降趋势,5月较低,3种植被类型的不同深度土壤mcrA 基因丰度均不超过 8.1×105copies·g−1,在 8 月达到最高值,AG 中 0—10、10—20、20—30 cm 土壤的mcrA基因丰度分别为(29.3±8.3)、(37.6±8.9)、(62.1±28.9) 105copies·g−1,MM 分别为 (40.8±15.5)、(85.6±35)、(50.4±26) 105copies·g−1,AM 分别为 (58.3±26.6)、(93.8±35.0)、(71.7±24.4) 105copies·g−1,随后开始下降,10 月的各层土壤mcrA 基因丰度均不超过 9.3×105copies·g−1。从深度分布来看,AG 中 5、6、7、10月的10—20 cm土壤mcrA基因丰度高于其他2层,8月和9月20—30 cm土壤mcrA基因丰度最高。在整个生长季中,MM和AM中10—20 cm土壤mcrA基因丰度均为最高。5、6、7、10月的AG各层土壤中的mcrA基因丰度均显著低于MM和AM(P<0.05),8月和9月AG中0—10 cm的mcrA基因丰度仅与AM差异显著(P<0.05),而9月3种植被类型20—30 cm的土壤mcrA基因丰度无显著差异。统计结果显示,整个生长季节中,AG的平均mcrA基因丰度低于 MM 和 AM,差异显著(P<0.05)。
甲烷氧化菌能将CH4氧化成CO2,与CH4吸收关系密切。表2结果显示3种植被类型的pmoA基因丰度随着时间变化先升后降,5月最低,3种植被类型的各层土壤中pmoA基因丰度均不超过1.0×107copies·g−1。8 月pmoA 基因丰度达到最高值,其中AG中0—10、10—20、20—30 cm的丰度分别为 (181.5±47.7)、 (148.6±38.5)、 (96.3±27.8) 107copies·g−1,MM 分别为 (119.8±40.6)、(84.7±36.6)、(64.7±26.0) 107copies·g−1,AM 分别为 (65.9±24.7)、(57.2±22.6)、(52.6±30.3) 107copies·g−1,随后开始下降,10月的各层土壤pmoA基因丰度均不超过3.1×107copies·g−1。从深度分布来看,3 种植被类型6—9月的0—10 cm土壤pmoA基因丰度高于其他2层,5月则均低于其他2层,10月10—20 cm土壤pmoA基因丰度高于其他2层。5月AG中10—20 cm土壤pmoA基因丰度与MM差异显著(P<0.05),10月AG中0—10 cm土壤pmoA基因丰度与MM和AM差异显著(P<0.05),10月MM中20—30 cm土壤pmoA基因丰度与AM差异显著(P<0.05)。统计结果显示,整个生长季节中,AG的平均pmoA基因丰度高于MM和AM,差异显著(P<0.05)。
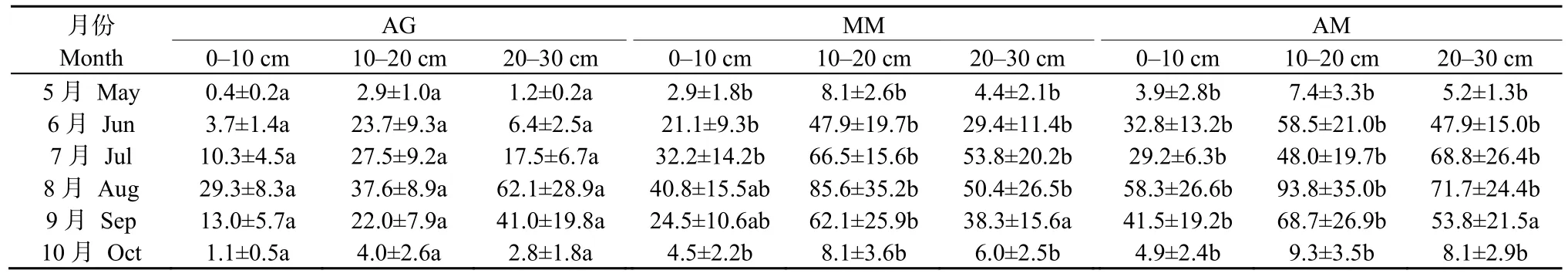
表1 不同植被类型的mcrA基因丰度的差异Table1 The differences of mcrA gene abundance in different vegetation types from May to October 105 copies·g−1
2.4 CH4通量与环境因子的关联
CH4通量与气象因子、营养元素和生物因子密切相关,图5结果显示,CH4通量与土壤湿度、有机碳、总氮、生物量和mcrA显著正相关(P<0.05),相关系数分别为 0.81、0.66、0.55、0.58和 0.55,表明这些因子升高有利于 CH4排放。土壤温度与mcrA和pmoA显著正相关,相关系数分别为0.79和0.64(P<0.05),土壤湿度仅与mcrA显著正相关,相关系数为0.64,表明温度和湿度是影响微生物的因子,通过增强微生物活性来影响CH4通量。
3 讨论
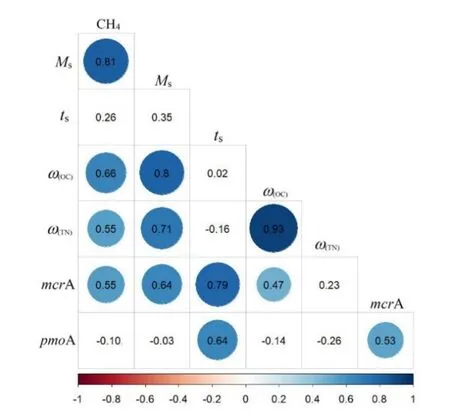
图5 CH4通量与土壤温度、土湿度、有机碳、总氮、生物量和微生物丰度等因子之间的相关系数Fig. 5 The correlation coefficient of CH4 flux related with soil humidity,soil temperature, organic corban, total nitrogen and microbial abundance
CH4通量在植被类型和物种之间差异较大(Li et al.,2016),本研究发现,高寒草地的 CH4通量小,MM和AM的CH4通量大,AG与MM和AM之间存在显著差异,Christensen et al.(2000)也发现在格陵兰东北部扎肯伯格 5种不同植被类型的CH4通量存在差异,低丘沼泽、连续沼泽和草地是CH4源,岩须和北极柳生态系统则为CH4汇。在隆宝滩3种植被类型中,AG是CH4的汇,尤其是在温度较高的8月有吸收峰值,Wei et al.(2015b)结合青藏高原及周边地区的观测数据确定青藏高原高寒草地是重要的甲烷汇,认为以往全球生物地球化学模型对同一地区的模拟值严重低估了高寒草地的甲烷吸收。MM和AM则是CH4的源,MM的CH4排放量略低于AM,这与Zhang et al.(2019)发现发现若尔盖湿地中不同物种之间的CH4通量不同的结果一致。青藏高原沼泽草甸内CH4通量有明显的微尺度空间异质性,洼地释放CH4,丘岗吸收CH4(Wei et al.,2015a),而北高纬度地区莎草覆盖层地点的 CH4排放量也高于其他地点(Olefeldt et al.,2013),这些研究都证实了不同植被类型CH4排放存在差异,受到土壤因子、生物因子和微地形的影响。

表2 不同植被类型的pmoA基因丰度的差异Table 2 The differences of pmoA gene abundance in different vegetation types from May to October 107 copies·g−1
甲烷通常由产甲烷菌无氧呼吸分解有机物产生(Thauer et al.,2008),因此底物数量对于CH4通量很重要。本研究中MM和AM的有机碳质量分数显著高于AG,而CH4通量也呈相似的变化,相关系数结果显示有机碳质量分数与CH4通量显著正相关,表明高寒湿地生态系统土壤里储存的有机碳是CH4潜在的碳源。除了土壤有机碳,土壤氮素也是影响生态系统CH4通量的因素之一,添加少量无机氮有助于刺激CH4吸收,但CH4氧化会被过量无机氮抑制(Peng et al.,2019)。在本文中,AG与MM、AM的硝态氮无显著差异但铵态氮差异显著,先前研究中也发现氮素中的硝态氮对CH4排放的作用不显著,主要是铵态氮降低土壤甲烷净吸收量(Yang et al.,2017),这与本文结果相一致。隆宝滩湿地的CH4通量与全氮之间关系紧密,相关系数达到0.55,可能是隆宝滩地势较低,雨水通过径流将周边氮素带来后沉降,但氮沉降是否能降低土壤甲烷净吸收量还需要进一步研究。
超过80%的甲烷来源于微生物活动,产甲烷菌群和甲烷氧化菌群是厌氧土壤微生物中的主要功能菌群(Aronson et al.,2013),产甲烷菌普遍存在于厌氧环境中,有机物质易形成较低氧化还原电位而进行无氧呼吸产生 CH4,mcrA基因丰度与 CH4通量密切相关(Yang et al.,2018;Zhang et al.,2018)。在本研究中,CH4通量与mcrA丰度呈显著正相关,AM和MM的mcrA基因丰度显著高于AG,从而导致前二者的CH4通量增加。长期的低水位会导致 CH4排放和产生潜力降低(Yrjälä et al.,2011),AG由于土壤含水量较低,土壤中氧气含量增加,使得mcrA基因丰度变小,CH4通量相应减小。基于mcrA末端限制性片段长度多态性,Yang et al.(2018)发现产甲烷菌群落结构与CH4排放量和植物盖度存在较好的相关关系,本研究中AM和MM的生物量显著高于 AG,也印证了这一结果。甲烷氧化菌在有氧条件下将CH4氧化生成CO2,AG表层土壤的pmoA基因丰度显著高于其他2种植被类型,其CH4通量在3种植被类型中最低。由于pmoA菌群的存在,甲烷氧化菌在浅层土壤(<10 cm)中将消耗 25%—34%环境产生的 CH4(Miller et al.,2019),AG的CH4通量为负值,表现为CH4汇,主要原因是甲烷氧化菌氧化消耗的CH4大于产甲烷菌产生的CH4造成的。通过pmoA的多样性分析,王世全等(2015)发现有通气结构的芦苇床更能有效氧化CH4,有利于减少CH4的排放,AG土壤含水量低通气性好,比其他2种植被更能氧化CH4。
水平衡是生态系统土壤中CH4动态变化的最重要影响因素之一(Chen et al.,2018)。AM和MM土壤含水量高CH4通量亦高,二者显著相关。同时,mcrA基因丰度与土壤湿度显著正相关,表明无氧环境增加了产甲烷菌数量。土壤水分决定了土壤中氧化层和缺氧层的相对程度,导致CH4产生与氧化比例发生变化(Feng et al.,2020),当湿地水位下降,温室气体排放量就会发生较大的变化(Kwon et al.,2017)。AG由于地势高,土壤含水量较低,氧气充足,其pmoA基因丰度高而mcrA基因丰度低,总体表现为吸收,Christiansen et al.(2016)也发现CH4的空间变异性从湿润土壤的净排放变为旱地土壤的净吸收,其CH4通量季节变化均与土壤水分密切有关,尤其干旱生态系统对水分的变化更敏感(Olefeldt et al.,2013)。
温度是生物地球化学过程的关键驱动力,可能影响土壤中CH4的产生和氧化,Yvon-Durocher et al.(2014)发现 CH4通量依赖于微生物的温度,对全球变暖有积极的反馈。在本研究中土壤温度较高的7—9月,AM和MM的CH4通量高和AG的CH4通量低。3类植被中mcrA丰度和pmoA丰度的峰值均出现在8月,此时地温较高,相关系数结果显示,土壤温度与mcrA和pmoA基因丰度呈显著正相关,证实了土壤温度升高增加了甲烷氧化菌和产甲烷菌活性,同时也使产CH4底物(产氢细菌或产乙酸细菌)活性增加,从而促进AM和MM土壤CH4产生和AG的CH4的吸收。全球变化导致的土壤温度升高可能造成地球北部地区和青藏高原的永久冻土融化,导致CH4排放量增加(Voigt et al.,2019)。AM、MM 的 CH4排放峰值与 AG的 CH4吸收峰值出现时间并不一致,这主要是因为CH4通量还受到温度以外的多种因素综合控制。Olefeldt et al.(2013)发现地下水位、土壤温度和植被组成对CH4排放有强烈地影响,且具有相互协同作用。土壤微生物对CH4通量影响非常重要,AM和MM的mcrA和pmoA的峰值与CH4排放峰值不一致,其原因可能有2个,一是除微生物活动影响外,CH4排放还与维管植物(段晓男等,2005)、冒泡和水位等有关,含水量增加会促进湿地CH4排放(Bansal et al.,2016),而AM和MM的土壤含水量在9月最高;二是当地9月气象条件变化较大,从中旬开始降温,月底降到冰点以下,CH4通量是9月中3次测定的均值,微生物取样是中旬一次性取样,取样时间不匹配也是导致结果不完全一致的原因之一,今后研究中尽可能保证取样的一致性以减少结果的不确定性。
4 结论
在生长季节中,沼泽化草甸和高寒沼泽中的CH4通量较高,在9月达到峰值,是CH4的源,高寒草地则表现为 CH4吸收,在 8月达到峰值,是CH4的汇。高寒草地有机碳、总氮、铵态氮、全钾、生物量等与沼泽化草甸和高寒草地存在显著差异,土壤中产甲烷菌mcrA基因丰度显著低于其他2种植被类型,而甲烷氧化菌pmoA丰度则相反。相关分析显示,CH4通量与土壤湿度、有机碳、总氮、mcrA显著正相关,土壤温度与mcrA和pmoA基因丰度显著正相关。总之,隆宝滩高寒草地CH4通量与其他2种植被不同,这是由于碳源、微生物和土壤温度湿度等因素的差异造成的,高寒湿地中不同类型植被CH4通量差异能微精确模拟青藏高原高寒地区的CH4排放提供数据支持。
