增温和外源碳输入对泥炭地土壤碳氮循环关键微生物功能基因丰度的影响
2020-08-19高思齐宋艳宇宋长春马秀艳
高思齐,宋艳宇,宋长春,马秀艳,蒋 磊
1 中国科学院东北地理与农业生态研究所,湿地生态与环境重点实验室, 长春 130102 2 中国科学院大学, 北京 100049
土壤微生物是植物-土壤物质循环过程中的重要组分[1],对其周围的环境变化具有较强的敏感性,能通过调节其数量、功能和种群结构来适应环境变化,对湿地生态系统的健康状况具有指示作用[2]。温度和外源碳均是影响微生物代谢的重要因素。Song[3]等研究表明,温度和活性基质能通过调节土壤微生物丰度和酶活性对增温的响应,从而影响碳氮耦合关系。在气候变暖背景下,温度升高会通过改变北方泥炭地土壤微生物群落结构和代谢途径,进而改变土壤有机碳分解速率[4]。而外源碳输入能够通过提高土壤细菌活性,进而促进土壤碳的周转和释放[5]。有研究表明,外源碳输入有利于土壤微生物量和呼吸速率的增加,但碳源组成及浓度的不同会影响温室气体排放[6-7]。葡萄糖是植物根系分泌的最常见的代谢物,也是微生物重要的可溶性有机碳源,进入土壤可以被微生物分解利用[8]。可溶性碳的添加有利于土壤微生物呼吸速率的提高以及土壤养分的有效化过程[9]。同时,地上植物与地下微生物的竞争可能导致不同土壤深度的微生物丰度不同。已有研究表明0—20 cm土壤微生物生物量、活性和多样性较深层土壤更高[10]。
温度升高和外源碳输入可能会改变参与土壤碳氮循环相关微生物基因丰度[11],进而影响土壤呼吸,从而导致土壤碳氮循环和温室气体排放的变化[12]。土壤细菌、产甲烷菌、甲烷氧化菌、氨氧化细菌以及反硝化细菌是参与土壤碳氮循环的主要功能微生物。土壤细菌、产甲烷菌和甲烷氧化菌群落在温室气体排放过程中起重要作用[13-14],其中编码甲基辅酶M还原酶(mcrA)和微粒甲烷单氧合酶(pmoA)的基因是参与产甲烷过程和甲烷氧化过程的重要基因。氨氧化细菌和反硝化细菌是土壤氮循环的重要组成部分,编码氨单加氧酶活性位点多肽(amoA),参与硝化过程[15],亚硝酸还原酶基因nirK和nirS作为反硝化微生物最重要的功能基因参与反硝化过程[16]。已有研究表明,微生物丰度的变化对土壤有机碳的分解有重要影响[3]。而微生物丰度的变化影响土壤活性有机碳和有效氮含量,土壤活性有机碳和有效氮的变化影响土壤有机质的微生物降解能力,从而影响土壤碳氮循环过程。因此,在全球变暖背景下,研究土壤碳氮循环关键微生物功能基因丰度的变化对进一步探讨温度升高影响下土壤碳氮循环的微生物机制具有重要意义。
泥炭地作为一个重要的碳汇,对陆地生态系统有重要作用,能调控全球气候变化,但随着全球温度的持续升高,北方冻土泥炭地冻融过程发生变化,从而导致泥炭地释放出大量CO2,可能使泥炭地改变其碳汇功能,显著影响该地区碳氮生物地球化学循环过程[17-18]。因此,本研究通过模拟增温和外源碳输入模拟实验,分析大兴安岭冻土区泥炭地表层土壤在增温和外源碳输入条件下土壤碳氮循环关键微生物功能基因丰度变化及其与土壤碳氮组分的关系,探讨温度升高影响下泥炭地土壤碳、氮转化的微生物驱动机制,以期为准确预测北方高纬度泥炭地碳氮平衡对气候变暖的响应提供重要的理论依据。
1 材料与方法
1.1 研究区概况
研究区位于大兴安岭图强林业局奋斗林场(52.94°N, 122.86°E),该区为多年冻土区,属于寒温带季风性气候,海拔约467 m,年平均温度(1991—2010年)为-3.9℃,年平均降雨量为450 mm(7—8月占全年降水量的45%)。该区主要植被类型为常绿灌木、落叶灌木,草本植物[19],以及地被植物,主要植物类型为细叶杜香(Ledumpalustre)、笃斯越橘(Vacciniumuliginosum)、羊胡子草(Eriophorumvaginatum)、泥炭藓(Sphagnumpalustre),属于寒温带针叶林区,土壤类型为泥炭土。0—10 cm和10—20 cm土壤初始总碳含量分别为366.33、384.45 mg/g,总氮含量分别为15.65、18.68 mg/g,总磷含量分别为2.74、3.43 mg/g,溶解性有机碳(DOC)含量分别为620.25、338.42 μg/g。
1.2 样品采集与培养
2017年7月,选取大兴安岭冻土区典型泥炭地,随机设置4块采样地,采样地之间的距离至少为10 m。在每块采样地随机选取5个采样点,利用土钻在每个采样点采集0—10 cm和10—20 cm的土壤样品,将样品混合均匀后立即送往实验室。人工挑出植物根系、新鲜凋落物和石块等杂物,过4 mm筛。取一部分土样,于阴凉处风干,研磨后,过0.25 mm筛,测定土样的初始总碳、全氮和全磷,剩余土壤于4℃下冷藏保存测定溶解有机碳含量和用于培养实验。
将新鲜土样(相当于10 g干重)置于500 mL广口瓶中,预培养3天,尽量减少温度突变对微生物活性的影响。用保鲜膜密封广口瓶,并扎4个孔,以保持里面的有氧环境,同时减缓水的蒸发损失[20]。在10、15℃两个温度下开展为期42d的增温模拟试验。同时设置葡萄糖添加处理(添加浓度为1000 μg Glu/g 干土)和对照两组处理,每一种处理都由来自两层的土壤样品组成,每个处理重复四次。实验过程中,每周使用蒸馏水补充挥发水分。42d培养结束后,分析测定土壤微生物功能基因丰度和土壤溶解性有机碳、微生物量碳、铵态氮、硝态氮含量。
1.3 样品测定方法
按照土壤DNA快速提取试剂盒(Fast DNA SPIN(MPbio,USA))说明提取0.3 g土壤DNA样品[21]。提取后用0.5%低熔点琼脂糖凝胶纯化DNA提取物,然后用苯酚-氯仿-丁醇萃取。为了获得更具代表性的DNA样本,对每个样本重复3次处理[22]。通过使用荧光定量PCR仪(7500,ABI,美国)定量测定总细菌16SrRNA,mcrA,pmoA,amoA,nirK和nirS基因丰度[3]。扩增所用引物见表1,实时荧光定量PCR的反应体系为25 μL,包括:12.5 μL 1×SYBR缓冲液(TaKaRa, Japan),0.4 μL引物(10 μM),0.5 μL ROXΙΙ(TaKaRa),0.875 μL 3%BSA,0.625 μL二甲亚砜(DMSO),10 ng DNA模板。
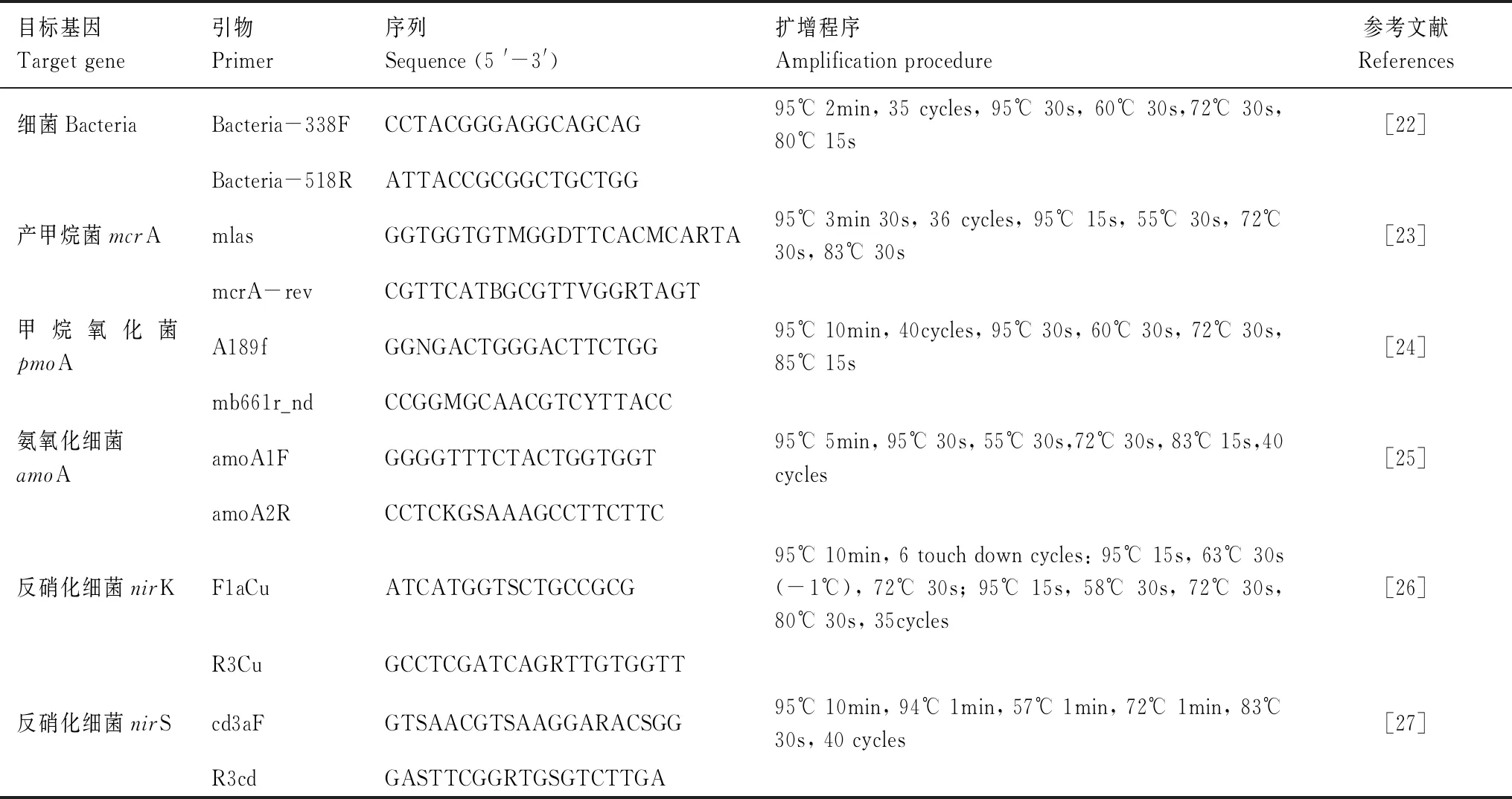
表1 土壤微生物功能基因引物及扩增程序
利用Multi N/C 2100 TOC仪(Analytik Jena, 德国)采用高温燃烧法测定土壤全碳含量;土壤样品经硫酸湿法消解后,采用AA3连续流动分析仪(Seal Analytical,德国)测定总氮、总磷含量[28]。采用氯仿熏蒸浸提法测定土壤微生物量碳含量[29],将土壤样品用CHCl3熏蒸24 h,用K2SO4溶液(0.5 mol/L)振荡30 min,分别对熏蒸和非熏蒸土壤样品进行抽提,过滤后采用Multi N/C 2100 TOC仪(Analytik Jena, 德国)测定提取液中碳浓度。土壤微生物量碳含量的计算公式:[MBC]=Ec/0.45。其中Ec为熏蒸土壤提取的有机碳与未熏蒸土壤提取的有机碳之差[30]。按照Ghani等[31]的方法测定土壤溶解性有机碳含量,将土壤样品用去离子水在常温下振荡提取30 min,然后以8000 r/min的速度高速离心20min,上清液通过0.45 μm滤膜过滤后,用Multi N/C 2100 TOC仪(Analytik Jena, 德国)测定溶液中总碳和无机碳浓度,土壤溶解性有机碳含量即为土壤浸提液中总碳与无机碳浓度的差值。用2 mol/L KCl溶液从土壤样品中提取无机氮,过滤后用AA3连续流动分析仪(Seal Analytical, 德国),测定滤液中铵态氮和硝态氮含量。
1.4 数据处理与分析
运用SPSS 19.0软件,采用双因素方差分析(two-way ANOVA)和显著性差异(LSD)以及Pearson系数等方法分别对不同温度和不同葡萄糖添加情况以及不同土壤深度下泥炭地土壤碳氮循环关键微生物基因丰度、活性碳组分含量以及无机氮含量进行差异显著分析,检验温度和外源碳输入对土壤碳氮循环相关微生物数量和土壤碳氮含量的影响,并运用Excel 2007及minitab进行绘图。
2 结果
2.1 泥炭地土壤碳氮循环关键微生物丰度变化
由荧光定量 PCR测得的土壤细菌丰度表明:10—20 cm土壤细菌丰度小于0—10 cm土壤细菌丰度(图1)。温度和外源碳输入对10—20 cm土壤细菌丰度均有显著影响(表2),在无外源碳输入的情况下,温度升高使得10—20 cm土壤细菌丰度增加了32.77%(图1)。在10℃和15℃条件下,外源碳输入使得10—20 cm土壤细菌丰度分别增加了15.97%和49.79%。温度和葡萄糖的交互作用对两种土壤深度的细菌丰度均有显著影响(表2),在增温和外源碳输入条件下,0—10 cm和10—20 cm土壤细菌丰度分别显著增加了36.28%和71.50%(图1)。
图1结果表明:10—20 cm土壤产甲烷菌(mcrA)丰度大于0—10 cm土壤产甲烷菌(mcrA)丰度。温度对两种土壤深度的甲烷氧化菌丰度均有显著影响(表2),温度升高使得0—10 cm土壤甲烷氧化菌丰度降低了45.22%,10—20 cm土壤甲烷氧化菌丰度增加了58.39%。葡萄糖添加对10—20 cm土壤甲烷氧化菌和产甲烷菌均有显著影响(表2),在10℃和15℃条件下,葡萄糖添加使得10—20 cm土壤产甲烷菌丰度分别增加了45.02%和22.89%,10—20 cm土壤甲烷氧化菌丰度分别增加了39.05%和24.47%,温度和葡萄糖的交互作用对0—10 cm土壤产甲烷菌和甲烷氧化菌丰度均有显著影响(表2),在葡萄糖添加条件下,温度增加5℃导致0—10 cm土壤产甲烷菌和甲烷氧化菌丰度分别增加了47.66%和41.79%。

图1 温度升高和葡萄糖添加对土壤碳氮循环关键微生物功能基因丰度的影响Fig.1 Effects of temperature rise and glucose addition on gene abundance of key microbes in soil carbon and nitrogen cycling
对于硝化和反硝化细菌,在无增温和外源碳输入条件下,10—20 cm土壤硝化和反硝化细菌丰度均小于0—10 cm土壤硝化和反硝化细菌丰度。温度升高使得0—10 cm土壤氨氧化细菌(amoA)丰度显著降低了96.11%,10—20 cm土壤氨氧化细菌丰度显著增加。葡萄糖添加以及温度和葡萄糖的交互作用对10—20 cm土壤氨氧化细菌丰度均有显著影响(表2)。在有外源碳的条件下,10℃时10—20 cm土壤氨氧化细菌丰度降低了39.22%,15℃时10—20 cm土壤氨氧化细菌丰度增加了150.16%。温度升高导致0—10 cm和10—20 cm土壤反硝化细菌丰度增加,其中0—10 cm土壤nirK和nirS基因丰度分别增加了33.97%和28.75%。温度对10—20 cm土壤nirS基因丰度有显著影响(表2),温度升高使得10—20 cm土壤nirS基因丰度增加了16.43%。温度和葡萄糖的交互作用对10—20 cm土壤nirS基因丰度有显著影响(表2),在10℃和15℃条件下,葡萄糖添加使得10—20 cm土壤nirS基因丰度分别增加了22.07%和74.40%。在添加葡萄糖的条件下,温度升高使得0—10 cm土壤nirS基因丰度降低3.31%,10—20 cm土壤nirS基因丰度增加66.35%,葡萄糖添加对10—20 cm土壤nirS基因丰度有显著影响(表2)。
2.2 土壤活性有机碳和有效氮含量变化及其与碳氮循环关键微生物丰度的关系
在增温和外源碳输入条件下,0—10 cm和10—20 cm土壤溶解性有机碳含量分别为756.6—847.5 μg/g和702.5—862.5 μg/g,0—10 cm和10—20 cm土壤微生物量碳含量分别为4298—4779 μg/g和3064 —4770 μg/g(表3)。在无外源碳输入的情况下,10—20 cm土壤溶解性有机碳与微生物量碳含量均小于0—10 cm土壤溶解性有机碳与微生物量碳含量。温度对10—20 cm土壤溶解性有机碳和微生物量碳含量有显著影响(表2),温度升高使得10—20 cm土壤微生物量碳含量降低了25.16%。葡萄糖添加对10—20 cm土壤溶解性有机碳和微生物量碳含量有显著影响,在10℃和15℃两种温度条件下,葡萄糖添加使得10—20 cm土壤溶解性有机碳含量分别呈现下降和上升的趋势,10—20 cm土壤微生物量碳含量分别提高了16.49%和46.47%。温度和葡萄糖的交互作用对10—20 cm土壤溶解性有机碳含量有显著影响,在有外源碳输入的条件下,温度升高5℃使得10—20 cm土壤溶解性有机碳含量增加了22.31%。由person相关性分析表明,土壤细菌(Bacteria 16S rRNA)、甲烷氧化菌(pmoA)以及反硝化细菌(nirK、nirS)丰度均与溶解性有机碳含量呈正相关(P<0.01,P<0.05,表4)。

表2 温度升高和葡萄糖添加对土壤微生物功能基因丰度及碳氮含量影响的方差分析结果
如表3所示,在增温和添加外源碳的条件下,0—10 cm和10—20 cm土壤铵态氮含量分别为231.61—756.99 μg/g和582.36—1072.91 μg/g,0—10 cm和10—20 cm土壤硝态氮含量分别为1.03—7.13 μg/g和2.98—32.29 μg/g。10—20 cm土壤铵态氮和硝态氮含量明显高于0—10 cm土壤铵态氮和硝态氮含量。温度对两种土壤深度的铵态氮、硝态氮含量有显著影响(表2),温度升高使得两种土壤深度的铵态氮含量分别增加了90.39%和13.18%。葡萄糖对两种土壤深度的铵态氮以及0—10 cm土壤硝态氮均有显著影响(表2),在10℃和15℃两种温度条件下,葡萄糖添加使得0—10 cm土壤铵态氮含量分别降低了41.75%和34.28%,同时使得0—10 cm土壤硝态氮含量分别降低了56.90%和50.63%。温度和葡萄糖添加的交互作用对10—20 cm土壤铵态氮、硝态氮含量有显著影响(表2),在外源碳输入的条件下,温度升高使得10—20 cm土壤铵态氮、硝态氮含量显著增加,10—20 cm土壤铵态氮含量增加了84.23%。同时,我们发现,产甲烷菌(mcrA)丰度与铵态氮和硝态氮含量均呈正相关(P<0.01,P<0.05,表4)。氨氧化细菌(amoA)丰度与铵态氮含量呈负相关(P<0.01,表4),铵态氮含量与微生物量碳含量呈负相关(P<0.05,表4)。

表4 Person相关性分析
3 讨论
3.1 土壤微生物对温度升高与外源碳输入的响应
本研究发现,在无增温和外源碳添加的情况下,0—10 cm土壤细菌、甲烷氧化菌以及反硝化细菌丰度高于10—20 cm土壤细菌、甲烷氧化菌以及反硝化细菌丰度,并且在增温和外源碳输入的情况下,土壤细菌、甲烷氧化菌以及反硝化细菌丰度与溶解性有机碳含量呈显著正相关(图1,表4)。已有研究表明,10—20 cm土壤碳比0—10 cm土壤碳更加稳定[32-33]。鲁博权等[34]研究表明,土壤溶解性有机碳和微生物量碳含量随土壤深度的增加而降低,这与本文结果一致,进一步证实了下层土壤难溶解性有机碳抑制了土壤相关微生物丰度的增长。葡萄糖添加使得10—20 cm土壤微生物量碳和15℃条件下土壤溶解性有机碳含量均显著增加。对于这一现象,Fontaine 等[35]提出了新鲜碳源的缺乏使得深层土壤有机碳稳定。倪玉雪等[36]研究表明,加入碳源能够使微生物量显著增加。外源碳输入增加了10—20 cm土壤活性有机碳含量,进一步促进深层土壤微生物丰度的增长。
土壤细菌丰度是反映土壤微生物活性的重要指标之一[37]。本研究发现温度对土壤细菌有显著影响,温度升高使得0—10 cm土壤细菌丰度降低(图1),温度升高会改变土壤细菌的生理和活性[38],也有研究表明温度升高使得碳氮等活性基质有效性降低,从而导致土壤细菌丰度下降[39]。Wang等[22]和Hayden等[40]的研究结果与本文一致,细菌丰度会随温度升高而降低。但也有其他研究表明,细菌丰度在变暖条件下变化不大或没有变化[41-42],这主要与土壤微生物所处的生态系统类型、地理位置、土壤类型和植物的影响有关[43-44]。本研究中葡萄糖添加使得10—20 cm土壤细菌丰度显著增加,这主要是由于葡萄糖作为可溶性有机碳为土壤微生物提供了充足的可利用的碳源[45]。Bastida等[46]也发现可溶性有机碳含量可以影响土壤细菌活性,与本文观点一致,这可能与土壤微生物受碳基质限制有关。
甲烷是重要的温室气体,产甲烷菌(mcrA)和甲烷氧化菌(pmoA)参与甲烷循环过程[47],对北方高纬度泥炭地生态系统有重要作用。Conrad等[48]研究表明,产甲烷菌的丰度和群落结构功能与温度有关。本研究中,温度升高导致10—20 cm土壤产甲烷菌和甲烷氧化菌丰度增加(图1)。Høj等[49]研究表明,温度升高使得产甲烷菌多样性和数量增加,加快产甲烷速率。产甲烷菌增加所产生的甲烷可能会导致甲烷氧化菌丰度的增加[42],进而加速土壤甲烷氧化过程,抑制土壤甲烷的排放[50]。葡萄糖添加对产甲烷菌有显著影响。Vizza等[51]研究表明,甲烷产生与底物有关,底物充足能促进产甲烷菌丰度增加。有外源碳输入的情况下,温度升高有利于土壤产甲烷菌以及甲烷氧化菌丰度的增加,说明温度和葡萄糖的交互作用可能会促进土壤甲烷循环过程。

3.2 土壤活性有机碳和有效氮对温度升高和葡萄糖添加的响应
土壤溶解性有机碳(DOC)和土壤微生物量碳(MBC)是土壤活性有机碳的重要组分[60-61]。温度升高导致10—20 cm土壤微生物量碳含量显著降低了25.16%,说明增温条件下,微生物首先利用活性碳组分,尤其是在室内培养环境下,微生物快速分解活性有机碳,由于培养试验缺少外来新鲜碳源的供给,温度升高能通过提高微生物活性和分解速率,从而增加微生物对活性碳组分的消耗利用,引起土壤微生物碳限制。微生物的代谢活动也会因增温幅度过大而受到抑制,进而导致微生物生物量碳降低[16]。可利用有机碳输入显著提高了10—20 cm土壤微生物量碳和15℃条件下溶解性有机碳含量,说明外源碳输入有利于土壤活性有机碳的增加。
土壤有效氮主要有铵态氮和硝态氮等,是土壤中最易被吸收利用的氮[62],对土壤氮循环有重要意义。土壤有效氮的变化能够通过改变碳的生物化学过程而对碳蓄积能力产生显著影响[63]。已有研究发现,温度升高加速了氮周转率,从而导致冻土、草地和森林土壤中无机氮含量升高[64-66]。我们的研究结果也发现温度升高显著提高了冻土区泥炭地土壤氨氮和硝氮含量,促进土壤氮周转速率,从而导致有效氮含量增加。施瑶等[67]研究发现,氮的有效性越强,土壤微生物活性越高。我们也发现产甲烷菌丰度与铵态氮和硝态氮含量均呈正相关,氨氧化细菌丰度与铵态氮含量呈负相关,因此温度升高使得土壤有效氮含量增加,进而间接使得相关微生物丰度发生变化,从而影响泥炭地碳氮平衡。而外源碳输入降低了10℃条件下0—10 cm和10—20 cm以及15℃条件下0—10 cm土壤氨氮和硝氮含量,这主要是由于碳源的输入增加了微生物对有效氮的吸收和利用,进而导致微生物受氮限制。
4 结论
通过研究温度升高和外源碳输入条件下,北方泥炭地土壤微生物碳氮循环关键微生物基因丰度、活性碳组分含量以及无机氮含量的变化特征,我们发现:在温度升高和外源碳输入的条件下,0—10 cm土壤微生物比10—20 cm土壤微生物更加敏感。温度升高能够通过改变微生物的生理活性,也可以通过改变碳氮等活性基质间接影响土壤微生物丰度。外源碳输入为土壤微生物提供了更多可利用的碳源,整体提高深层土壤微生物丰度,使得10—20 cm土壤细菌、产甲烷菌、甲烷氧化菌、氨氧化细菌以及反硝化细菌丰度显著增加。有外源碳输入的情况下,温度升高有利于土壤产甲烷菌和甲烷氧化菌丰度以及10—20 cm土壤氨氧化细菌丰度增加。同时,相关性分析结果表明,在增温和外源碳输入条件下,土壤微生物受碳氮等可利用性活性基质的限制。然而,我们的研究结果只是基于短期的室内培养实验,对于北方泥炭地土壤微生物对温度升高的长期响应模式仍需要开展长期的野外监测及模拟研究。
