杀鱼爱德华氏菌非编码小RNA sR082的功能研究
2020-08-19周海珍李墨非
周海珍 , 李墨非
(1.中国科学院海洋研究所 实验海洋生物学重点实验室, 青岛 266071; 2. 中国科学院大学 地球科学学院, 北京 100049)
杀鱼爱德华氏菌(Edwardsiellapiscicida),原名迟缓爱德华氏菌(Edwardsiellatarda)是一种革兰氏阴性病原菌,可感染鱼类、爬行动物、鸟类和人类[1]。由杀鱼爱德华氏菌引发的爱德华氏菌病给我国多种重要经济鱼类养殖,如牙鲆、大菱鲆、鳗鲡和真鲷等造成了巨大的经济损失[2]。近年来,对于杀鱼爱德华氏菌致病机制的研究取得了一系列进展,已发现多种毒力系统和致病因子,如,Ⅲ型分泌系统(T3SS)[3]、Ⅵ型分泌系统(T6SS)[4]、群体感应系统[5]等。这些毒力因子在杀鱼爱德华氏菌黏附、侵染及在宿主细胞中存活起着重要的作用[6]。但是目前我们对杀鱼爱德华氏菌的感染机制,包括在宿主细胞内的生存与复制机制等,仍不清楚。
细菌sRNA长度约为50~500 nt,能转录但不能翻译,通过碱基配对的方式调控靶基因mRNA的翻译及稳定性[7]。近年来研究发现细菌非编码小RNA(Small non-coding RNA,sRNA)作为一种调控因子在转录后水平调节基因表达,参与调控细菌环境应答、生物膜形成、运动性和致病性等生物学过程[8-9]。在爱德华氏菌的研究中,Sun等[10]通过RNA测序和qRT-PCR法鉴定了E.tardaS08的10个sRNA (ET_sRNA_1至ET_sRNA_10)。TargetRNA2靶基因预测结果表明这10个sRNA的靶基因均直接或间接与毒力相关,说明它们可能参与调控迟缓爱德华氏菌的毒力[10]。
本实验室前期研究发现杀鱼爱德华氏菌TXD1在不同生长环境(正常LB培养、酸性胁迫、缺铁胁迫和氧化胁迫)下共有148个sRNA表达。相比正常LB培养组,共有103个sRNA在3种胁迫环境下有显著差异表达。IntaRNA预测结果表明,这103个sRNA共调节769个靶基因,这些潜在靶基因广泛参与细菌的致病性调节与抗逆性等多种生物学过程。根据前期RNA测序结果,对数据进行分析整理,选取在酸性条件下具有差异表达的一个sRNA即sR082进行深入研究[11]。通过比较sR082敲除株TXΔsR082与TXD1在不同pH值条件下的生长速率、侵染牙鲆鳃细胞系(FG cell lines)和对牙鲆致死能力的差异,探讨sR082在杀鱼爱德华氏菌感染鱼类过程中发挥的作用,以期为阐明杀鱼爱德华氏菌的胞内生存机制和致病机理提供理论依据。
1 材料与方法
1.1 菌株及培养条件
杀鱼爱德华氏菌TXD1为本实验室保存[12],敲除株TXΔsR082利用同源重组方法(In-frame deletion)构建[11],使用Luria-Bertani(LB)培养基于28 ℃培养。所用抗生素为多黏菌素B(polyB)。
1.2 实验动物
健康牙鲆购自青岛胶南(青岛龙湾生物科技有限公司古镇营养殖场)养殖场,牙鲆均重约30 g,在实验室条件下(充气海水,21 ℃,每日换水1次,每日喂食商品化颗粒饲料)暂养2周后,用于实验。所有鱼在实验之前用鱼安定麻醉。
1.3 sR082在不同pH值条件下的表达分析
E.piscicidaTXD1划线于固体LB平板上,28 ℃培养24 h,挑取单菌落于含polyB的LB培养基中,28 ℃,180 r/min培养至对数中期,离心收集菌体,用PBS清洗2遍,分别接种至pH 7、pH 6和pH 5的LB培养基中,终浓度为1×106CFU/mL,28 ℃、180 r/min培养。使用分光光度计进行测量,收集OD600=0.2,OD600=0.4,OD600=0.7和OD600=0.9的细菌。每个样品取2×109CFU细菌,离心去培养基,加入500 μL Trizol(InvitrogenTM),放入液氮速冻,-80 ℃冰箱保存。样品全部收集完后,提取总RNA,NanoDrop2000测定纯度和浓度。每个样品取1000 ng RNA用Toyobo反转录试剂盒(ReverTra Ace qPCR RT Master Mix with gDNA Remover)反转录为cDNA,用sR082RTF(5′-AACGGGCGGTGCTACTAAATC-3′)和sR082RTR(5′-TGGCTTTGTGGTTGTGATGTTG-3′)引物进行荧光定量PCR检测,同时使用引物16S rRNA F(5′-ACTGAGACACGGTCCAGA CTCCTAC-3′)和16S rRNA R(5′-TTAACGTTCACACCTTCCT CCCTAC-3′)检测内参基因16S rRNA[13]。
1.4 TXD1和TXΔsR082在不同pH值环境压力下生长曲线测定
按上述方法培养TXD1和TXΔsR082,接种于pH 7、pH 6和pH 5的LB培养基,28 ℃、180 r/min培养,每隔2 h测定OD600吸光值,绘制生长曲线,实验重复3次。
1.5 TXD1和TXΔsR082在FG细胞系内复制能力检测
将FG细胞用Leibovitz′s-15(L-15)培养基(含10% FBS)复苏传代后,铺于24孔细胞培养板中,23 ℃,过夜培养。用TXD1和TXΔsR082菌株以MOI为30∶1的比例侵染FG细胞2 h,用PBS洗3遍,然后用200 mg/mL庆大霉素杀胞外菌1 h,PBS洗3遍,加入胰蛋白酶消化细胞并计数,计数完的细胞用1% Triton X-100裂解,梯度稀释,涂LB固体平板,28 ℃培养24 h后计数。此为侵染实验。实验重复3次。
胞内复制实验测定方法前期与侵染实验相同,杀胞外菌结束后,向不同感染时间点的细胞中加入含30 mg/mL庆大霉素的L-15培养基,维持胞外无菌环境。孵育2、4、6和8 h后,吸干各个时间孔中的培养液,PBS洗3遍,加入胰蛋白酶消化细胞并计数,后续实验操作同上。实验重复3次。
1.6 TXD1和TXΔsR082组织侵染和致死率分析
组织侵染实验。将TXD1和TXΔsR082培养至OD600≈0.6。用PBS洗3遍,并用PBS重悬至1×107CFU/mL。将60条牙鲆随机分为2组,每组30条鱼,分别肌肉注射100 μL(注射剂量为1×106CFU/条)TXD1和TXΔsR082。感染12、24和48 h后,每个时间点取9条鱼的肾脏和脾脏,3条鱼的样品混为1组,共3组,加入无菌PBS研磨后,梯度稀释涂到固体LB平板上。28 ℃培养24 h后菌落计数。实验重复3次。
致死率分析。将40条牙鲆随机分为2组,每组20条鱼,按照上述方法分别人工感染TXD1和TXΔsR082,每日监测牙鲆死亡数目,共监测15 d,计算每组鱼的累积死亡率。
1.7 统计学处理
应用 SPSS 20.0 统计学软件进行数据分析,采用Graphpad Prism 7.0软件作图。样本间比较采用t检验,以P<0.05为有统计学差异。
2 结果与分析
2.1 不同pH值条件下sR082的表达情况
我们在前期研究中发现sR082可能与杀鱼爱德华氏菌耐受酸性环境胁迫的能力有关[11]。为分析sR082在酸性条件下的转录情况,用qRT-PCR方法检测不同pH值环境条件下,sR082在细菌不同生长时期的转录水平。结果显示,sR082在细菌培养至OD600= 0.2时含量最高,随着细菌培养时间的增加,含量逐渐降低。在细菌培养至OD600= 0.4时,sR082在pH 5条件下含量比在pH 7时上调约1.8倍;在细菌培养至OD600= 0.9时,sR082在pH 5条件下含量比在pH 7时上调1.9倍,而在pH 6的条件下含量相比pH 7条件下没有明显变化(图1)。
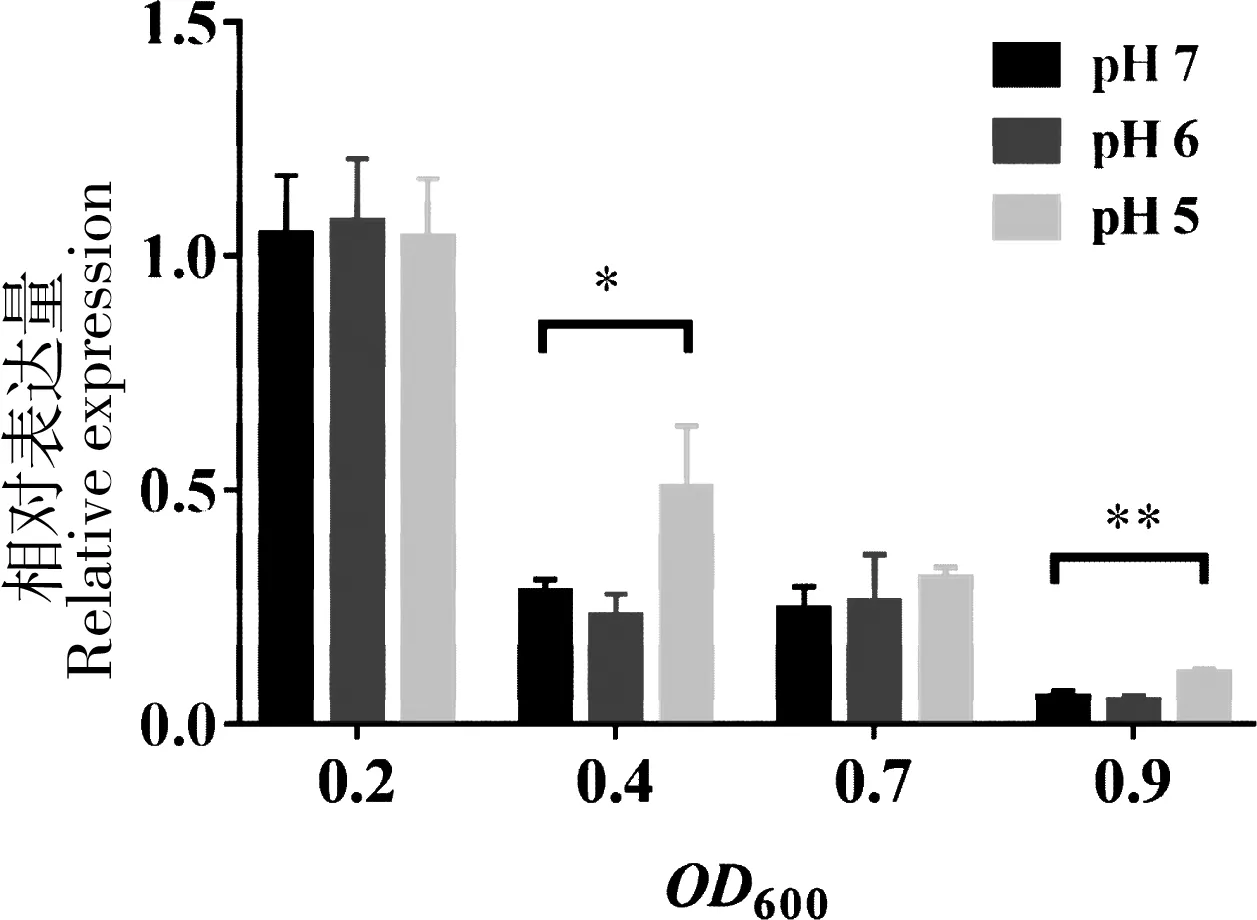
“*”表示在OD600= 0.4时,sR082在pH 5中的含量与pH 7相比存在显著差异(P<0.05);“**”表示在OD600= 0.9时,sR082在pH 5中的含量与pH 7相比存在极显著差异(P<0.01)
2.2 TXD1和TXΔsR082在不同pH值条件下的生长情况
为进一步探究sR082与杀鱼爱德华氏菌酸性环境适应性之间的关系,我们采用前期研究中构建的杀鱼爱德华氏菌sR082敲除株TXΔsR082[19],检测其与野生株在不同pH值下的生长情况。结果显示,在pH 7时,敲除株TXΔsR082和野生株TXD1相比生长曲线趋势基本一致(图2-A);在pH 6时,8 h之后,TXΔsR082生长速度降低(图2-B);在pH 5时,TXΔsR082与TXD1相比生长速度显著降低(图2-C)。
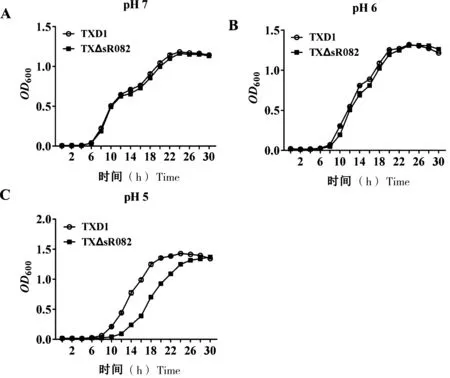
A:pH 7时TXD1和TXΔsR082的生长情况; B:pH 6时TXD1和TXΔsR082的生长情况; C:pH 5时TXD1和TXΔsR082的生长情况
2.3 TXD1和TXΔsR082感染牙鲆鳃细胞(FG)及胞内复制能力分析
为研究sR082对杀鱼爱德华氏菌侵染宿主细胞能力的影响,我们采用FG细胞检测 TXD1和 TXΔsR082侵染细胞能力和在宿主胞内复制能力的差异。结果表明,与TXD1相比,TXΔsR082侵染至FG细胞的数量显著降低(图3-A);同时在FG细胞内复制能力显著降低(图3-B)。在感染6 h时,TXD1与TXΔsR082的胞内菌量最多,并且两者之间的差异也达到最大值(图3-B)。
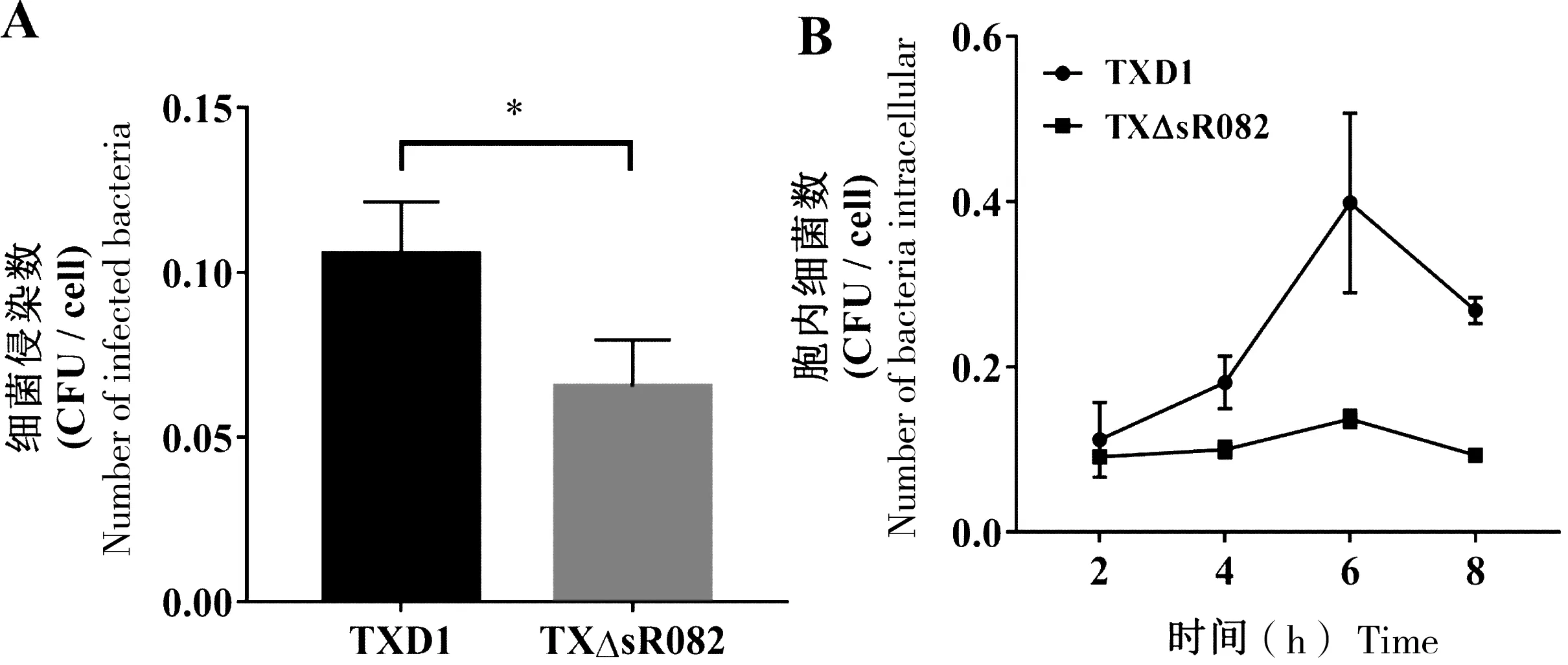
A:TXD1和TXΔsR082侵染FG细胞,“*”表示与TXD1相比,TXΔsR082侵染FG细胞能力显著降低(P<0.05);B:TXD1和TXΔsR082在FG细胞中的复制能力
2.4 TXD1和TXΔsR082在牙鲆组织中的侵染能力以及对宿主的致死率比较
为分析sR082对杀鱼爱德华氏菌侵染鱼体的影响,本研究用TXD1和TXΔsR082肌肉注射牙鲆。结果表明,在感染12 h,TXΔsR082在牙鲆肾脏中的数量极显著低于TXD1,而在感染24 h和48 h后,TXΔsR082在牙鲆脾脏和肾脏中的数量均显著低于TXD1(图4)。
致死率实验结果表明,在感染TXD1后,牙鲆在第6天死亡率为100%,而TXΔsR082的感染致死率为20%,与TXD1相比,TXΔsR082致死率显著降低(图5)。
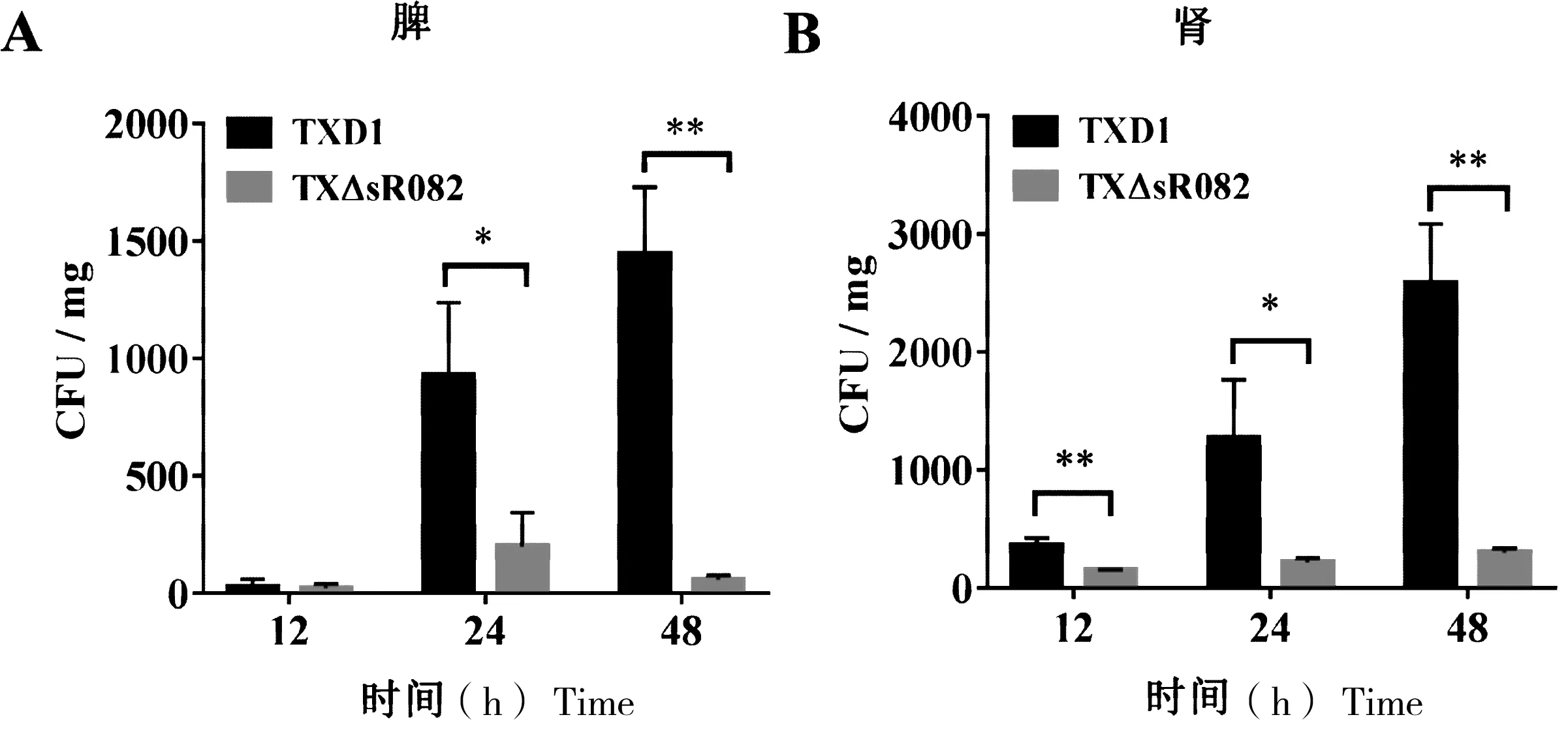
“*”表示与TXD1相比有显著性差异(P<0.05);“**”表示与TXD1相比有极显著差异(P<0.01)
3 讨论与结论
近年来研究发现sRNA参与调节细菌的多种生理活动,在细菌适应环境刺激(如氧化压力、温度和酸碱等)和毒力方面发挥重要作用[14]。细菌侵染宿主后,宿主吞噬细胞对侵染的病原菌进行吞噬,产生对病原菌不利的酸化环境、进而产生自由基如活性氧和活性氮等对病原菌进行杀伤[15]。细菌为了应对这些不利环境,产生一些sRNA调节基因表达从而增加其在宿主细胞内的生存。例如过量表达酸性相关sRNA可以增强沙门氏杆菌的酸性耐受、致死率和对于上皮细胞系的黏附和侵染[16];在乳酸链球菌中,敲除sRNA s042和s015能够显著抑制乳酸链球菌在酸性条件下的生长[17-18];大肠杆菌通过sRNA ArcZ、DsrA和 RprA调控rpoS基因增强其在酸性条件下存活能力[19]。前期测序分析发现了杀鱼爱德华氏菌在酸性、缺铁和过氧化氢胁迫条件下差异表达的103个sRNA, 这些sRNA预测调控769个靶基因的表达,根据预测靶基因功能推测sRNA参与细菌抗逆性和致病性等多种生理进程[11]。本研究根据测序结果对酸性环境下差异表达的sR082进行qRT-PCR验证,发现无论是在正常环境条件还是在酸性环境条件下,sR082都是在早期表达量最高,而在对数期和稳定期表达量逐渐下降;在pH 5的条件下,sR082在细菌生长的各个时期表达量均显著增加,说明sR082可能与杀鱼爱德华氏菌耐受酸性环境胁迫的能力有关。为了进一步探究sR082与细菌应对酸性环境关系,我们检测了sR082敲除株和野生株在不同pH值情况下生长情况。研究发现杀鱼爱德华氏菌TXΔsR082在pH 6时生长速度减缓;而在pH 5时,TXΔsR082的生长速度显著降低。这些结果表明sR082通过调控靶基因参与杀鱼爱德华氏菌适应吞噬细胞的酸性环境,抵抗吞噬细胞的杀伤作用进而在宿主吞噬细胞内存活和复制。根据以上结果推测sR082可能在杀鱼爱德华氏菌感染鱼类细胞和组织中发挥重要作用。
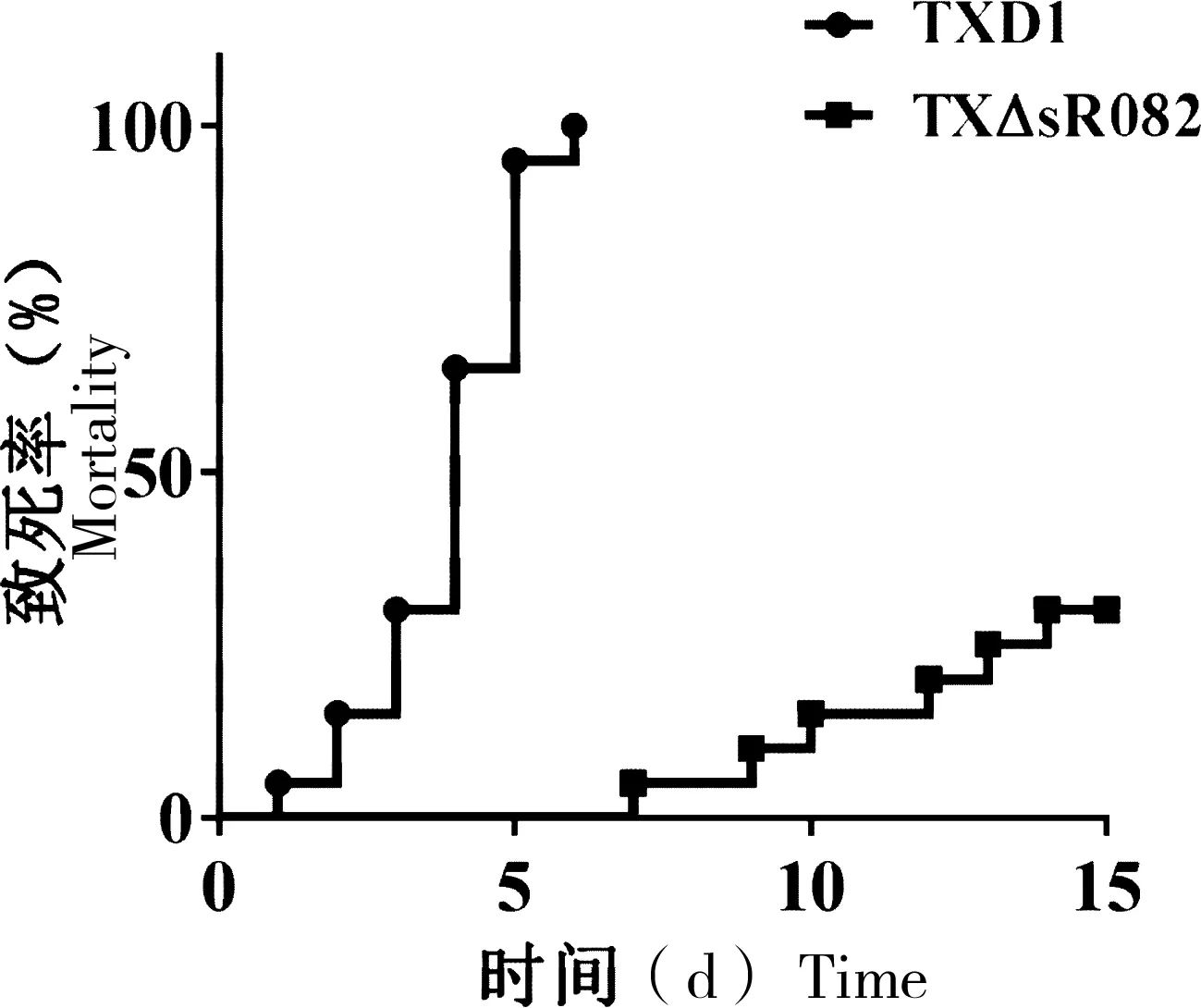
图5 TXD1和TXΔsR082感染牙鲆的致死率
细菌sRNA能够通过调控自身毒力基因表达,有效地促进细菌在细胞内生长、繁殖,从而有利于其在宿主体内的侵染和存活。大肠杆菌sRNA Teg41通过调控靶基因的表达来影响细菌的毒力[20];在金黄色葡萄球菌中,Teg49敲除株失去调控sarA基因表达的能力,从而降低对人类皮肤的感染能力[21]。另外有研究报道sRNA能够调控包括霍乱弧菌、副溶血弧菌和创伤弧菌在内的多种人类病原菌[22],但是对于sRNA调控鱼类病原菌的毒力机制鲜有报道。本研究发现杀鱼爱德华氏菌sR082和哺乳动物病原菌sRNA有相似的功能。通过比较TXΔsR082与TXD1对FG细胞的侵染,发现TXΔsR082侵染FG细胞能力显著降低,同时在FG细胞内复制能力降低,说明sR082对杀鱼爱德华氏菌感染细胞和胞内存活能力有显著影响。组织侵染结果表明,TXΔsR082侵染至牙鲆脾和肾组织中的数量均显著降低,说明sR082对杀鱼爱德华氏菌的体内感染能力有显著影响。致死率实验结果表明,TXΔsR082对于牙鲆的致死率降低。这些结果表明杀鱼爱德华氏菌sR082是一个关键的调控毒力相关sRNA,能够调控杀鱼爱德华氏菌适应吞噬细胞内的酸性环境,进而发挥感染细胞、组织和鱼体的能力。
综上所述,在本研究中,我们通过体内与体外实验,证明杀鱼爱德华氏菌的sRNA sR082在细菌应对酸性环境压力和致病性方面起着重要的作用。这些研究结果揭示了sRNA在细菌感染过程中的重要性,加深了对杀鱼爱德华氏菌的致病机制的理解。
