采用泡沫铜电极的热再生氨电池性能数值模拟
2020-08-19张永胜张亮李俊付乾朱恂廖强石雨
张永胜,张亮,李俊,付乾,朱恂,廖强,石雨
(1 低品位能源利用技术与系统教育部重点实验室,重庆400030; 2 重庆大学工程热物理研究所,重庆400030)
引 言
工业生产过程中余热损失约占总能量的10%~50%,具有较大的能源回收前景[1-2]。目前,中高温余热可被有效回收利用,而低温余热(温度<130℃)资源总量大但面临能量密度低、回收难度大、效率低等挑战[3-5]。然而,从能源利用的格局来看,低温余热作为产能与用能的关键环节,对实现节能减排战略目标具有举足轻重的作用。为此,研究学者针对低温余热回收技术开展了大量研究,其中产生高品位电能的低温余热产电技术更是得到了快速发展,其主要包括以下几种方法,如有机朗肯循环发电技术[6-7]、基于半导体材料塞贝克效应的固态热电技术[8-9]、液态热电化学技术[10-11]和盐度梯度能量技术[11-12]。然而,这些技术往往存在着效率低和成本高等问题,限制了其未来的发展应用[13-15]。
近期,研究学者提出了一种新型低温废热再生氨 电 池[16](thermally regenerative ammonia-based battery,TRAB),主要包括两个过程:产电过程,阳极铜与氨发生络合反应,失去电子,阴极铜离子得到电子发生沉积,电子经外电路形成电流,由此将化学能转化为电能;热再生过程,阳极产物铜氨络合物经低温废热分解,重新生成氨和铜离子,用于下一循环,由此将废热转化为化学能[17]。TRAB由于其反应条件温和、系统简单、成本低等优势,引起了研究学者的广泛关注,现有研究主要集中在电池产电。Zhang 等[18]针对不同操作参数对TRAB 性能的影响进行了实验研究。为了获得高功率输出,Rahimi 等采用了聚苯氧基阴离子交换膜(BTMAAEMs)来降低电池的内阻[19],并提出流动式热再生氨电池强化传质,同时为了提高阳极库仑效率和发电效率,采用乙二胺作为阳极反应物代替氨[20],并采用银电极实现了多个循环稳定发电[21]。Wang 等[22]利用铜和锌金属电极构建双金属TRAB,显著增加了开路电位,从而提高电池的最大功率。为提高TRAB 能量密度,王福添等[23]采用高浓度电解液,对电极电势进行了实验研究,对TRAB 系统进行了基本循环的热力学分析。在拓展应用方面,TRAB 已被应用于去除含高浓度铜离子废水中的铜离子[24-25]。此外,张绍志等[26-27]将TRAB 用作第二类吸收式热泵系统中的蒸发器,实现TRAB 与制热、制冷系统的耦合应用。针对热再生过程,Vicari等[28]结合TRAB 系统的实际应用,对操作参数的影响进行了初步研究。此外,王福添[29]对再生循环热物理机理进行了研究,提出了电极电势理论计算模型,并研究了温度等参数对再生循环性能的影响。然而,TRAB 尚不能满足实际应用,其中一个根本的原因是其性能还较低。
在众多电池性能影响因素中,电极比表面积是一个关键因素。为进一步提高电池性能,Zhang等[30]提出了一种具有高比表面积的泡沫铜三维多孔电极,获得了更高的功率密度,并研究了电极厚度的影响。研究发现随着电极厚度的增加,电池性能增加到峰值后反而开始下降,分析原因主要是由于采用三维多孔电极虽提高了电极比表面积,但是会导致电极内物质传输阻力增大,导致电池性能下降。前期研究中,李彦翔等[31]通过实验研究了不同传质方式对采用泡沫铜电极TRAB 性能的影响。Zhang等[32]通过构建新型电池和电极结构强化泡沫铜电极TRAB内物质传输。可见,物质传输对TRAB性能影响较大,尤其是采用多孔电极的电池,而通过理论模拟研究电池内部物质传输规律更为重要。目前仅有一篇基于铜片电极的理论模拟研究[33],而采用泡沫铜多孔电极的TRAB理论模型尚未见报道。
本文以采用泡沫铜电极的TRAB 为研究对象,建立了耦合多孔介质内物质传输与电化学反应的稳态数学模型,计算获得了电池性能和多孔电极内物质传输特性,研究了阳极氨浓度、阴极铜离子浓度、硫酸铵浓度和电极孔隙率对电池性能的影响。
1 数值模拟
1.1 物理模型
本研究中计算模型及网格划分如图1所示。模型结构由阳极腔室(AL)、泡沫铜阳极(AC)、阴离子交换膜(AEM)、泡沫铜阴极(CC)和阴极腔室(CL)五部分组成。其中计算区域包括泡沫铜阳极、泡沫铜阴极和阴离子交换膜,计算域采用矩形网格划分。模型几何尺寸与反应器实际尺寸一致,电极宽度为30 mm,其余几何参数如表1所示。

图1 采用泡沫铜电极的TRAB计算模型及网格划分Fig.1 Calculation model and meshing of the TRAB with copper foam electrodes

表1 几何区域尺寸参数Table 1 Dimensional parameters of geometrical domain
由于本模型中没有电解液的流动,沿着垂直于阴离子交换膜方向的物质传输才是影响性能的关键,而沿电极宽度方向没有差异,所以计算模型采用二维模型。已知电极宽度,通过反应面积换算可得到采用泡沫铜多孔电极的TRAB 的性能。模拟计算中,阴极电解液为硫酸铵和硫酸铜混合溶液,阳极电解液为氨、硫酸铵和硫酸铜混合溶液。氨在阳极腔室中由主流区向多孔电极内部扩散,在多孔电极骨架表面发生电化学反应,与铜反应生成四氨合铜,失去电子;阴极铜离子同样由阴极腔室主流区向泡沫铜内部扩散,得到电子,发生沉积;阴离子可自由通过AEM,电子流经外电路产生电流。在上述过程中所涉及的相关计算参数见表2。为验证计算结果的准确性,实验测试须保持与模拟条件一致。采用有阴/阳极腔室的双室反应器,中间由阴离子交换膜隔开,阴阳极泡沫铜电极紧贴膜两侧以降低阴阳极之间的内阻。电解液都为硫酸铜(1 mol/L)和硫酸铵(0.5 mol/L)混合溶液,并在阳极液中通入浓度为1 mol/L 的氨。将电池连接外电阻箱,改变电阻进行极化测试,采用数据采集仪记录电极电势,得到极化曲线,并由此计算得到电池的性能曲线,详细测量与计算方法参考前期文献[30]。
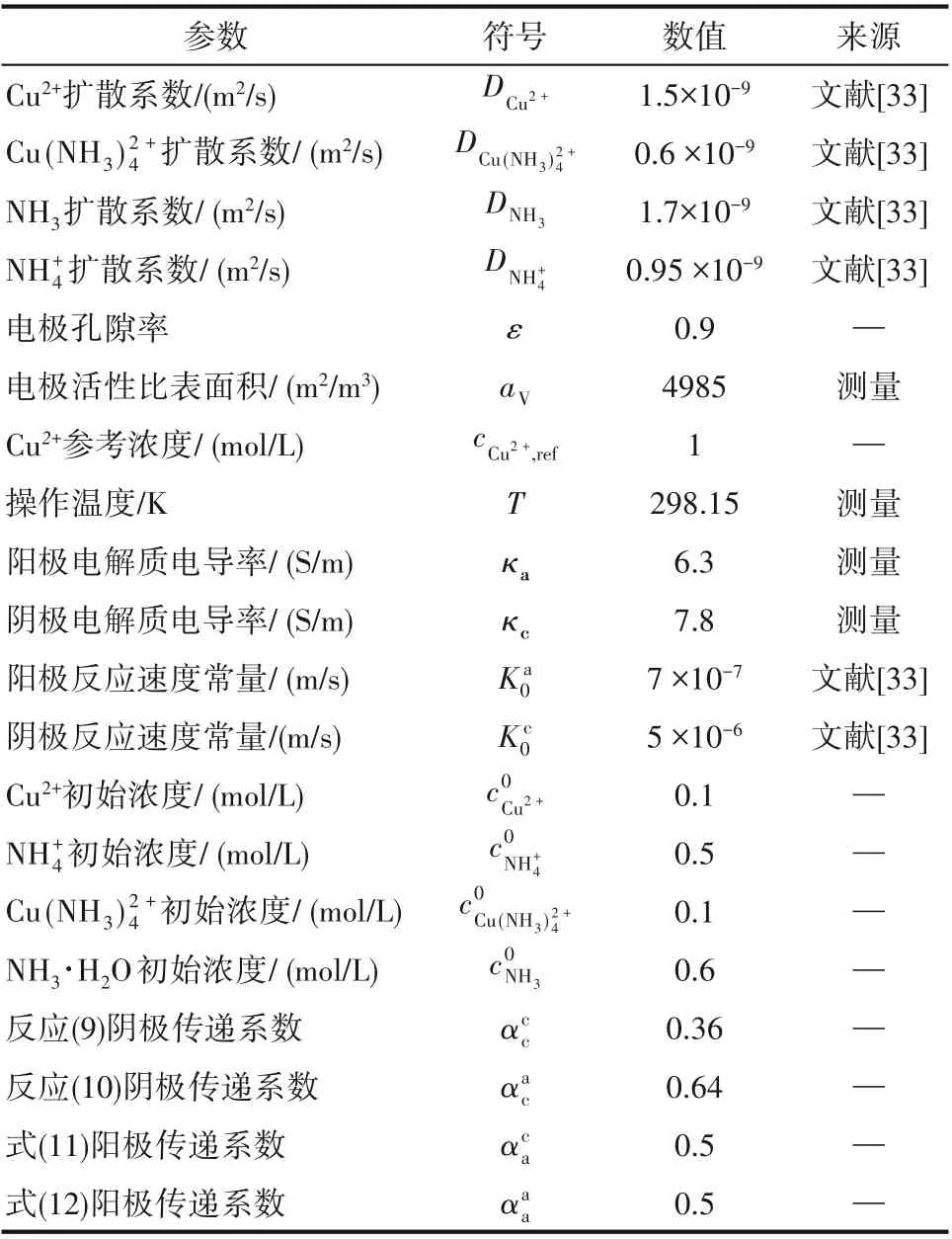
表2 模型中所使用的参数Table 2 Parameters used in the model
1.2 基本假设
本模型主要对电池中的传质、电极反应动力学和电荷传递进行了耦合,并对模型做出了以下假设:
(1)电池工作处于等温稳态条件;
(2)电极、电解液和膜的物理性质均为各向同性和均匀性;
(3)随着反应进行,阴阳极腔室主流区中各离子浓度保持不变;
(5)忽略氨渗透现象以及铜腐蚀和沉积导致电极产生变化的影响;
(6)忽略重力的影响。
1.3 控制方程及边界条件
1.3.1 物质传输 电池内部各组分物质传输受改进Nernst-Planck方程控制:

式中,Si表示电极区域电化学反应的速率,与之对应的表达式如表3所示。非电化学反应物质以及非电极区域物质守恒方程源项为零。物质在多孔电极内传输采用有效扩散系数Bruggeman 模型进行修正:


表3 物质守恒方程源项Table 3 Source items of the mass conservation equation

其中,下角标e 和s 分别代表电解液和电极,上角标eff代表有效值。
边界条件:阴阳极泡沫铜与主流区接触处设置集电体,分别给定恒定电势,即相当于给定恒定电池电压;其余壁面为零通量边界条件。
1.3.3 电化学反应 热再生氨电池工作过程中,在阴阳极分别发生铜还原沉积和铜氨络合反应,反应方程式如下:
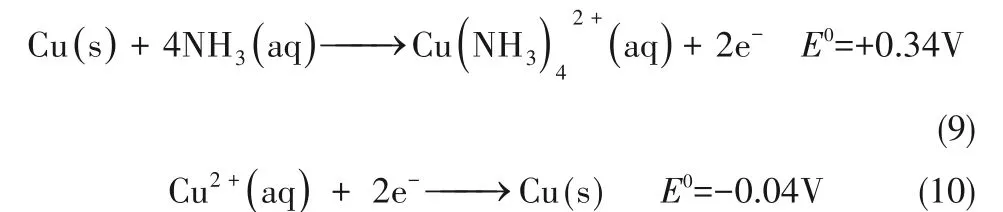
氧化还原反应发生在泡沫铜多孔电极骨架表面,多孔电极体积电流密度由Butler-Volmer 方程确定:
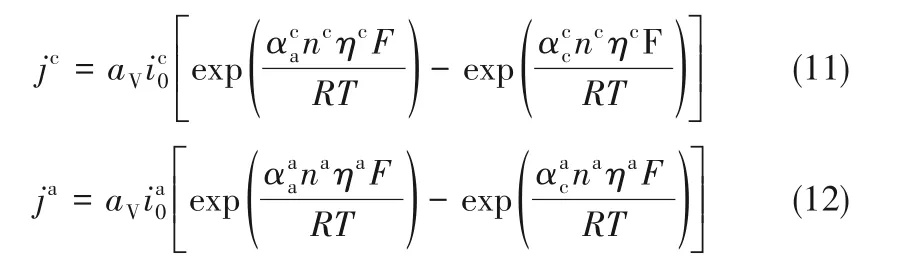
式中,jc、ja分别表示阴极和阳极电流密度,aV为电极活性比表面积,n 表示参与反应的电子数(n=2),η 表示反应中的过电位,阴阳极交换电流密度i0由式(13)、式(14)确定:

1.4 求解步骤
采用COMSOL Multiphysics 软件对所建立的模型进行求解,计算区域采用矩形网格(图1),计算前对模型网格进行独立性检查。在原有网格(9272)的基础上,分别对网格数量进行了30%的减少和30%的增加,在其他参数相同的情况下,相对误差设为1× 10-5,三种网格数量(6426、9272、12896)下得到的结果差异可忽略。为节省计算成本,最终采用的网格数量为6426,计算得出多孔电极内物质浓度分布及电池性能曲线。
2 结果与讨论
2.1 采用泡沫铜电极的TRAB性能及传输特性
2.1.1 模型验证 为了验证模型的准确性,将计算得到的性能曲线与实验测试结果作比较。如图2所示,极化曲线模拟计算值与实验值相比,偏差可控制在18%以下。可见,本文建立的采用泡沫铜电极的TRAB模型与实验结果吻合良好,具有较好的可靠性。从功率曲线可以看出,在输出电压为0.18 V时电池获得最大功率9.8 mW,比实验获得的最大功率(10.8 mW)低约9.3%,分析可能是因为在实验过程中,随着反应进行,泡沫铜电极表面铜腐蚀和沉积会导致电极骨架表面结构发生微变化,可提高电极反应活性比表面积,而在模拟计算中忽略了这一影响。

图2 模拟结果与实验结果对比图Fig.2 Verification of proposed model against experimental results
2.1.2 采用泡沫铜电极的TRAB 物质传输特性 传质是影响TRAB 性能的重要因素,特别是对于具有三维多孔电极的TRAB 而言,而明晰电极内物质传输特性对指导物质传输强化尤为重要。本模拟计算获得了TRAB 在不同输出电压下多孔电极内物质浓度分布,如图3 所示。图3(a)为泡沫铜多孔阳极内氨浓度分布。当电压V1为0.36 V 时,电流(16.8 mA)较小(图2),电化学反应缓慢,氨消耗量较小,泡沫铜阳极内氨浓度变化较小;当电压降低为0.18 V 时,电流增加到58.4 mA,此时电池获得最大功率(9.8 mW),由于电化学反应速率增大,阳极氨消耗增加,在多孔电极内存在一个明显的氨浓度梯度,从主流区界面到电极内部,氨浓度逐渐降低;当电压继续降低到0.06 V,电池电流增加到101.9 mA,电化学反应速率剧增,致使氨消耗量较大,多孔电极内氨浓度梯度进一步增大。图3(b)为阴极Cu2+浓度分布,在不同输出电压下其分布规律与阳极氨分布规律类似,即沿着主流区界面向电极内方向,反应物浓度逐渐降低,且电流越大,浓度梯度越大。可见,物质传输直接影响电池多孔电极内反应速率,在高电流工况下对多孔介质电极最内层的反应影响更大。由此,为提高电池性能,以下模拟得到了各反应物浓度对电池性能的影响。
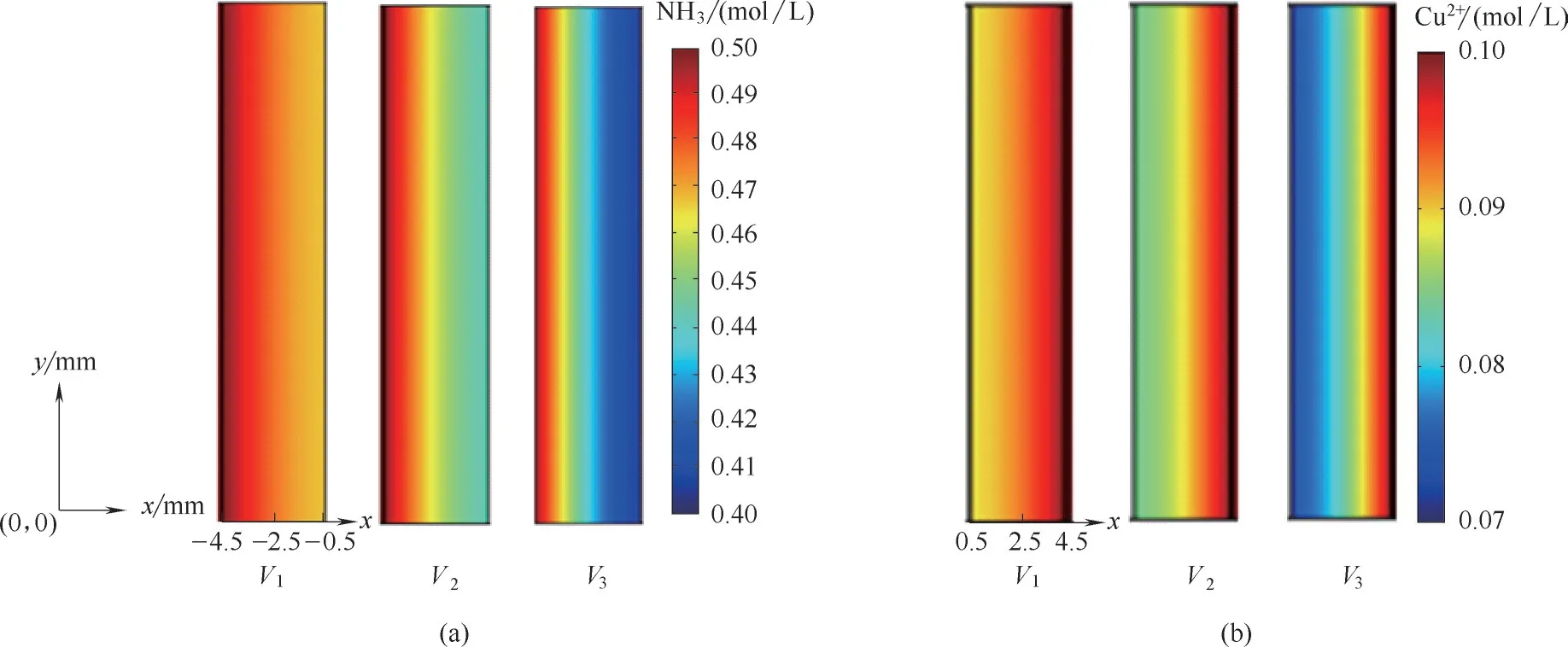
图3 不同输出电压下阳极氨浓度分布(a)和阴极铜离子浓度分布(b)Fig.3 Distribution of ammonia concentration(a)and Cu2+concentration(b)at different voltages
2.2 阳极氨浓度对电池性能的影响
在阳极多孔介质电极内发生氨与电极铜的络合反应,产生相对较低的阳极电势,与较高的阴极电势间构成电压差[18]。因而,氨浓度会对电池阳极性能产生较大的影响。为了研究氨浓度对电池性能的影响,在0.1 mol/L 铜离子和1 mol/L 硫酸铜浓度下模拟了不同氨浓度(0.1、0.5、1、2和3 mol/L)TRAB输出功率和阳极氨浓度分布,结果如图4 所示。如图4(a)所示,当氨浓度为0.1 mol/L,最大功率最低为7.1 mW。当阳极氨浓度逐渐增加时,电池性能不断升高,这与泡沫铜电极TRAB 实验结果获得的变化规律一致[27]。当氨浓度提高到3 mol/L 时,电池最大功率(13.7 mW)相比氨浓度为0.1 mol/L 时提高了约93%。分析可知,当氨浓度较低时,增大浓度可有效提高氨从主流区向泡沫铜多孔介质内部表面的扩散,加快电化学反应速率,进而提升电池性能。此外,计算获得了在最大功率(电压为0.18 V)情况下阳极泡沫铜电极内氨浓度分布,如图4(b)所示。可见,从主流区界面到阳极多孔电极内部,阳极氨浓度逐渐降低,存在浓度梯度;初始氨浓度越大,整体分布的氨浓度越高,且氨浓度梯度越大,主要是由于此时电极内电化学反应速率加快,最终电池性能得到提升。可见,增加阳极电解液氨浓度是提升电池性能的有效手段。

图4 不同氨浓度对电池性能的影响(a)及阳极氨浓度分布(b)Fig.4 Effects of different ammonia concentration on battery performance (a)and distribution of ammonia concentration(b)
2.3 阴极铜离子浓度对电池性能的影响
阴极多孔介质电极内发生铜离子的沉积,而阴极电解质中铜离子作为反应物,其浓度势必会影响电化学反应速率,进而影响阴极性能[33]。为此,在1 mol/L 氨浓度和1 mol/L 硫酸铵浓度条件下,计算获得了不同阴极铜离子浓度(0.05、0.1、0.2、0.3 和0.4 mol/L)对TRAB 性能和阴极铜离子浓度分布的影响,如图5 所示。当铜离子浓度为0.05 mol/L,最大功率最低为9.9 mW。随着铜离子浓度的不断增大,电池功率逐渐提升。当铜离子浓度增大到0.4 mol/L时,电池最大功率达到了16.5 mW,相比提高了约67%。分析可知,增加铜离子浓度可强化阴极电解液中铜离子向阴极多孔电极表面的扩散,导致阴极反应速率加快,进而提升阴极性能。同时计算获得了在最大功率(电压为0.18 V)条件下阴极多孔电极内铜离子浓度分布,如图5(b)所示。可知,从阴极主流区到多孔电极内铜离子浓度逐渐降低,存在浓度梯度。电解液中初始铜离子浓度越大,阴极整体铜离子浓度越大,且阴极电化学反应速率越大,致使铜离子浓度梯度越大。可见,通过提高阴极电解液中铜离子浓度,可提高电池阴极电化学反应速率,进而提高电池性能。
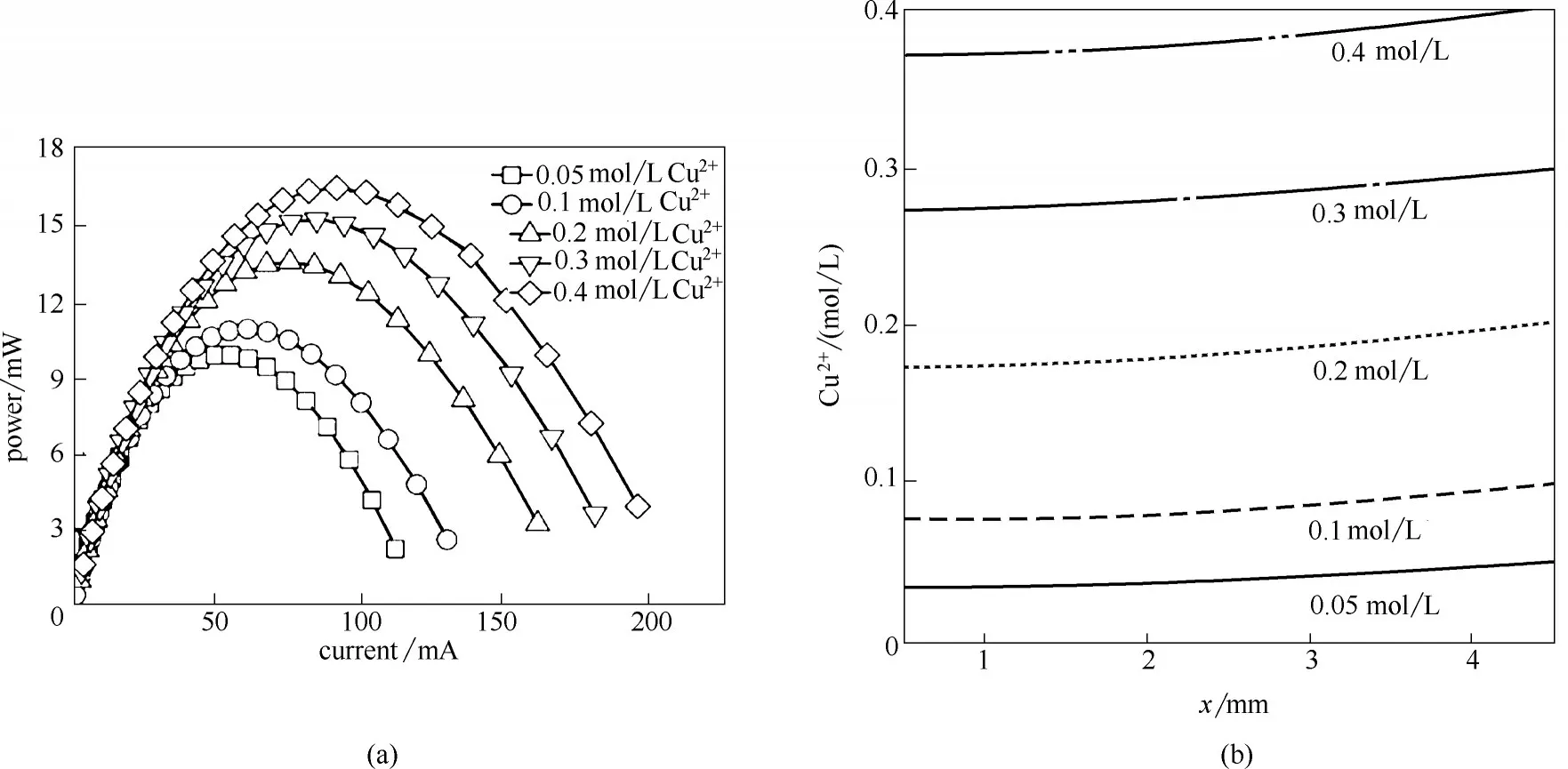
图5 不同铜离子浓度对电池性能的影响(a)及阴极铜离子浓度分布(b)Fig.5 Effects of different Cu2+concentration on battery performance(a)and distribution of Cu2+concentration(b)
2.4 硫酸铵浓度对电池性能的影响
硫酸铵作为支持电解质,一方面可以平衡pH,抑制氨的解离,提高氨的活性;另一方面还可提高电解质电导率,降低电池电阻,进而提升电池性能[33]。不同(NH4)2SO4浓度下,电解质具有不同的黏度、电导率和密度,而黏度和密度差异较小,对电池性能最大的影响在于电导率的大小[33]。由于本研究中电解液主体部分为溶剂水,采用稀物质传递,而且无电解液流动,所以忽略了黏度和密度对物质传输的影响。实验测试中,将配制的5 个硫酸铵浓度下的电解液在室温下进行电导率测试。采用哈希便携式水质分析仪(型号HQ14D),配备电导率电极(量程0.01~200.0 μS/cm,精度为读数的±0.5%,分辨率为0.01 μS/cm),将电导率探头插入电解液中,待读数稳定后记录。每个浓度的电解液重复测试共三次,每次测量前用去离子水将探头冲洗干净,最后取平均值为电导率值,结果如表4所示。可见,硫酸铵浓度增大时,阴、阳极电解液电导率逐渐增大,且在相同浓度下阳极电解液电导率略低于阴极电解质电导率。

表4 不同硫酸铵浓度的电解液电导率Table 4 Conductivity of the electrolyte with different concentration of(NH4)2SO4
基于实验测量获得的不同电导率,模拟得到了不同硫酸铵浓度下的TRAB 性能,如图6 所示。当(NH4)2SO4浓度为0.5 mol/L 时,电池最大功率为11.3 mW。随着硫酸铵浓度不断增加,电导率逐渐增大,电池功率逐渐增大。当硫酸铵浓度为2.5 mol/L 时,电池最大功率(16.2 mW)达到最高,增长了约43.4%。如图6(b)所示,随着硫酸铵浓度的增大,电池最大功率逐渐提升,但提升幅度越来越小。分析可知,在一定范围内增加硫酸铵浓度,电解质电导率增大,电池欧姆内阻减小,进而电池性能逐渐提升;而当硫酸铵浓度增加到1.5 mol/L 后,电导率不再是电池性能的限制性因素,所以再增加硫酸铵浓度电池性能提升不明显。可见,一定程度上增大硫酸铵浓度可有效提升电池性能。

图6 不同(NH4)2SO4浓度对电池性能的影响Fig.6 Effects of different(NH4)2SO4 concentration on battery performance
2.5 电极孔隙率对电池性能的影响
孔隙率作为多孔电极的一个重要结构参数,不仅会影响反应比表面积,还会影响多孔电极内物质传输,同时对电极电导率和电解质电导率产生影响[34]。在全钒氧化还原液流电池中,采用含有纳米到微尺度孔隙的梯度孔石墨毡电极可以诱导有效的传质,强化电池性能[35]。而最近TRAB 研究对泡沫铜电极TRAB 孔隙密度进行优化设计[32],获得了最佳孔隙率下的电池性能。为了研究泡沫铜电极孔隙率对电池性能的影响,在0.1 mol/L 铜离子浓度、1 mol/L氨浓度和1 mol/L硫酸铵浓度条件下计算获得了不同电极孔隙率(0.5、0.6、0.7、0.8 和0.9)的电池性能,结果如图7 所示。当电极孔隙率为0.5时,电池最大功率为14.5 mW。当电极孔隙率增大到0.6 时,电池性能提升到15.3 mW。分析可知,这主要是因为在小电极孔隙率条件下,增加孔隙率导致电极反应比表面积的增加以及多孔电极内部扩散系数的增大[由式(7)可以看出]对电池性能起主导因素。当增加电极孔隙率到0.7 时,电池最大功率反而下降到13.9 mW。当进一步增加电极孔隙率时,电池最大功率逐渐降低。这主要是因为在高孔隙率下,影响电池性能的主导因素是电极电流的有效传导,孔隙率增大,多孔电极对电子的传导率降低[由式(8)可以看出],导致电池欧姆内阻增大,降低电池性能。可见,调控电极孔隙率可有效提升电池性能,本研究中TRAB 在电极孔隙率为0.6时获得最高的最大功率(15.3 mW)。
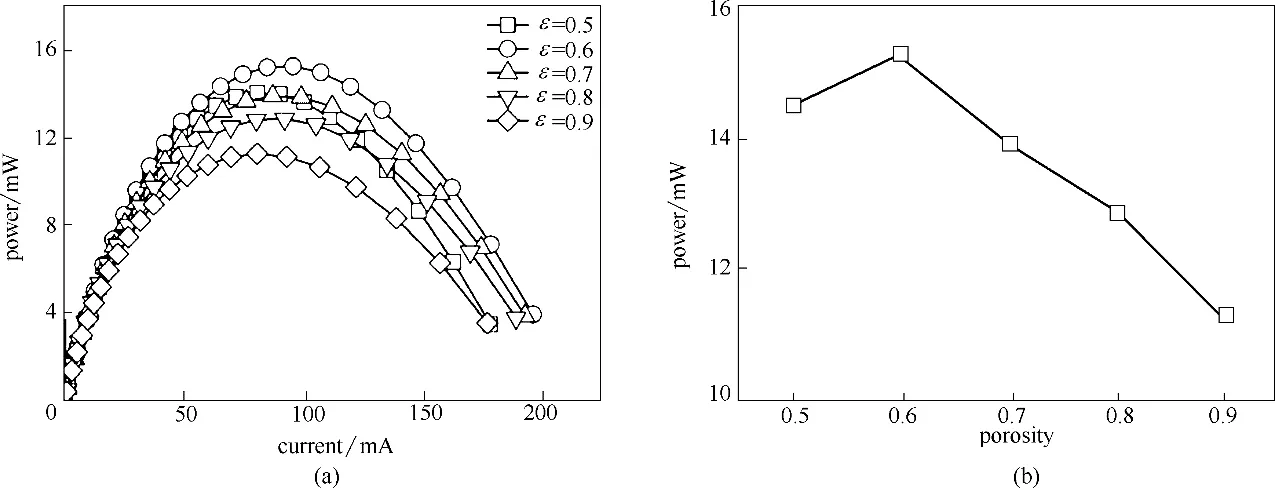
图7 不同电极孔隙率对电池性能的影响Fig.7 Effects of different electrode porosity on battery performance
3 结 论
本文以采用泡沫铜电极的TRAB 为研究对象,建立了多孔介质内物质传输与电化学反应耦合的TRAB 传输稳态模型,获取了电池性能及多孔电极内物质传输特性,研究了Cu2+浓度、NH3浓度和支持电解质(NH4)2SO4浓度以及电极孔隙率对电池性能的影响,得到了以下主要结论。
(1)沿着主流区界面向电极内方向,阴、阳极反应物浓度逐渐降低,且电流越大,浓度梯度越大。
(2)增加阳极氨浓度和阴极铜离子浓度可强化多孔电极内物质传输,从而提升电池性能;在一定范围内增加支持电解质浓度可增大电解质电导率并降低欧姆内阻,进而提升电池性能。
(3)泡沫铜多孔电极孔隙率会影响电池内部的物质传输、反应活性比表面积以及电流的有效传导,在电极孔隙率为0.6 时,本模拟中TRAB 获得最高的最大功率(15.3 mW)。
符 号 说 明
c——浓度,mol/m3
D——扩散系数,m2/s
E——电动势,V
F——法拉第常数,96485 C/mol
i——电流密度,A/m2
N——通量,mol/(m2·s)
R——气体常数,8.314 J/(mol·K)
T——温度,K
α——电荷转移系数
ε——孔隙率
η——过电势,V
κ——电导率,S/m
ν——化学计量数
上角标
eff——有效值
0——标准值
下角标
a——阳极
c——阴极
e——电解液
s——固相电极
