低氧与肿瘤治疗
2020-08-18金沉
金沉


摘 要 低氧是实体瘤的普遍现象,对肿瘤的增殖、凋亡、血管生成、浸润转移、能量代谢及放化療抵抗性都具有重要的作用。本文回顾了两类针对低氧肿瘤的药物研发策略:作用于低氧诱导因子(hypoxia-inducible factors, HIFs)及其相关信号通路的分子靶向药物,以及靶向于肿瘤低氧微环境的低氧激活前药,分别列举了各个药物的设计思路和作用机制,对各种策略所面临的挑战与机遇进行了探讨。
关键词 低氧 低氧诱导因子 低氧激活前药
中图分类号:R979.19 文献标志码:A 文章编号:1006-1533(2020)15-0097-05
Hypoxia and antitumor therapy
JIN Chen*
[Xingliu (Shanghai) Pharmaceutical Technology Co., Ltd., Shanghai 201210, China]
ABSTRACT Hypoxia is a common phenomenon of solid tumors and plays an important role in tumor proliferation, angiogenesis, invasion, metastasis, energy metabolism, resistance to chemotherapy and radiotherapy. In this paper, two approaches for targeting hypoxia in cancer therapy are reviewed. One is molecular targeted agents targeting HIFs and relative signal pathway and the other is hypoxia-activated prodrugs targeting tumor hypoxic microenvironment. Several example compounds with their design and mechanism are listed and the particular challenges and opportunities for each strategy are also discussed.
KEY WORDS hypoxia; HIF; hypoxia-activated prodrug
氧气是影响细胞生存的重要分子,线粒体在氧气存在的条件下,通过呼吸作用产生能量,为细胞的生存提供能量基础。2019年诺贝尔生理学或医学奖,授予三位科学家William G. Kaelin Jr、 Sir Peter J. Ratcliffe和Gregg L. Semenza,以表彰他们在“细胞感知和适应氧气供给机制”方面的突出贡献[1]。
早在1955年,Thomlinson Gray观测到在距离血管180 mm的肿瘤中心区域出现坏死的现象,这个距离刚好超出了血管中氧气渗透的范围。研究认为,肿瘤不受控制的快速增殖,使中心区域愈发远离血管,造成氧气和营养物质不能输送到该区域,因而出现了坏死的现象[2]。这是人类首次对肿瘤低氧现象进行的观测与研究。尽管肿瘤具有持续诱发促进血管生成的能力,但是肿瘤组织中的新生血管形态异常,微血管网对于氧气和营养物质的运输相对低效,高度增殖的肿瘤细胞的耗氧量,超出了微血管网的供氧量,从而使得远离血管的肿瘤中心区域形成低氧和坏死的现象。越来越多的研究证明,低氧对肿瘤的增殖、凋亡、血管生成、浸润转移、能量代谢及放化疗抵抗性都具有重要的作用[3-8]。
低氧肿瘤的治疗策略,目前主要包含两个方向:一是作用于HIFs及其相关信号通路的分子靶向药物[9-10],二是靶向于肿瘤低氧微环境的低氧激活前药[11-13]。
1 作用于HIFs及其相关信号通路的分子靶向药物
2019年获奖的三位科学家阐明了细胞在分子水平上感受氧气含量的基本原理,揭示了一个重要的信号机制,即低氧诱导因子HIF(hypoxia-inducible factor)。
细胞应对低氧环境而产生的生理变化,主要由低氧诱导因子HIF进行调节。低氧诱导因子能够调节多个基因的表达,驱动肿瘤细胞在低氧环境中的适应和生存。低氧诱导因子是应对低氧环境的转录因子,是由α亚基(HIF-1α,HIF-2α或HIF-3α)和β亚基(HIF-1β)组成的二聚体蛋白复合物。HIF-α的蛋白家族中,HIF-1α表达最为广泛,对氧气敏感;HIF-2α在内皮细胞中首次被检测到,只在少量组织中表达。对于HIF-3α,目前的研究尚不充分。在氧气存在的条件下,HIF-1α的脯氨酸残基经过脯氨酰羟化酶(PHD)的羟基化作用后,被蛋白酶体降解。而在低氧条件下,对氧气敏感的脯氨酰羟化酶活性降低,HIF-1α的羟基化过程不能进行,因降解被抑制而累积,进而从细胞质转移进入细胞核内,并与HIF-1β组成HIF二聚体。转录因子HIF能够识别并结合靶标基因的一段碱基序列G/ACGTG,即低氧反应元件(hypoxia response elements, HREs),由此开启相关靶标基因的转录过程。这其中包括影响血管生成、糖脂代谢、细胞生长、凋亡、转移等各方面的调节基因[14-15]。
HIF-1α和HIF-2α受到氧气敏感型脯氨酰羟化酶的调节作用,从而引起各种生理功能方面的调节,以应对氧气环境的变化。HIF-1α在多种肿瘤细胞中的高表达,被认为与低氧有着密切的关系。靶向于HIF-1α及其下游相关蛋白,成为低氧肿瘤治疗的一个研究方向。HIF-1α下游相关蛋白作用机制明确,如与血管生成相关的血管内皮生成因子(VEGF),与代谢相关的葡萄糖转运体1(GLUT1),与酸碱平衡相关的碳酸酐酶Ⅸ(CA Ⅸ),与细胞生长相关的胰岛素生长因子1(IGF1),与转移相关的赖氨酰氧化酶(LOX),这些都作为分子靶向药物开发的重要靶点[16]。
以mTOR(mammalian target of rapamycin)为中心的PI3K/AKT/mTOR信号通路是细胞能量代谢的重要通路。作为HIF-1α上游信号通路的关键蛋白,mTOR通过多种作用途径,影响和调节HIF-1α及其下游基因的表达。mTOR抑制剂在低氧肿瘤的治疗中受到广泛研究,其中,雷帕霉素类化合物表现出明显的抗肿瘤效果[17-18]。
HIF-1α是受低氧调节的关键细胞因子,然而,以HIF-1α为直接作用靶点的分子靶向药物则相对较少,其原因在于,目前的临床实验结果表明,HIF-1α的抑制与抗肿瘤活性之间没有明显的关联。此外,一些HIF-1α的选择性抑制剂,也并未表现出其对低氧肿瘤细胞的选择性杀伤。HIF-1α的作用机制与抗肿瘤效果之间的关系尚未被完全阐明,靶向于HIF-1α的研究策略仍具有相当大的挑战。
2 低氧激活前药
低氧激活前药,是利用肿瘤低氧这一特殊的环境,来设计在正常组织中无活性或活性很低,在低氧环境中能够被激活释放出活性药物,从而选择性杀伤低氧肿瘤细胞。通常,低氧激活前药是利用低氧肿瘤细胞中高表达的还原性酶还原释放药物。
腫瘤组织中的还原酶是低氧激活前药活化的关键因素。还原酶的主要种类有:心肌黄酶(DT-diaphorase)、醌还原酶(quinone reductase)、细胞色素P450还原酶(cytochrome P450 reductase)、硝基还原酶(nitroreductase)等。大多数酶对氧气敏感,以烟酰胺腺嘌呤二核苷酸(NADH)或烟酰胺腺嘌呤二核苷磷酸(NADPH)作为氢供体,参与到前药的还原过程中。
不同的化学结构,其靶向的还原酶种类各不相同。目前,已经证明有四种化学基团能够在低氧条件下被还原酶降解,它们分别是:过度金属络合物,醌类化合物,氮氧化合物(脂肪族氮氧化合物、芳香族氮氧化合物),硝基类化合物(硝基苯类化合物、硝基咪唑类化合物)。这四种结构类型为低氧激活前药的设计提供了结构基础[6]。
2.1 过渡金属络合物
过度金属络合物是利用不同价态的金属,其络合物稳定性不同的原理设计的。其中,钴是最为常用的金属元素(图1)。三价钴的氮芥络合物能稳定性强,在三价钴原子的影响下,氮芥上氮原子的电子云密度降低,细胞毒性显著低于氮芥单体。当络合物进入低氧肿瘤组织,在还原酶作用下,三价钴原子被还原为二价钴原子,导致络合物不稳定,释放出细胞毒药物氮芥,从而对低氧肿瘤细胞造成杀伤[19]。然而,过渡金属价态之间转化的可逆性仍没有解决,该类化合物作为低氧激活前药的应用仍处于探索阶段。
2.2 醌类化合物
醌类化合物的发现与应用最早可以追溯到20世纪60年代丝裂霉素C的发现。EO9作为丝裂霉素C的衍生物,是目前研究较多的代表性药物。EO9的作用机制包括单电子和双电子的还原过程,进而产生具有DNA损伤性的分子,这一过程在有氧或低氧的条件下都可以进行。双电子还原酶,包括醌还原酶和心肌黄酶,在药物降解过程中起到重要作用,直接决定了药物是靶向有氧细胞还是低氧细胞。所以,只有在含有较少双电子还原酶的细胞株上,EO9才是具有选择性的低氧激活前药。在缺少双电子还原酶的条件下,EO9被单电子还原酶还原,如细胞色素P450还原酶,生成半醌自由基中间体,这一过程是可逆的。半醌自由基中间体在低氧条件下继续被还原,生成具有DNA损伤性的苯二酚类化合物(图2)。然而,EO9在临床Ⅰ/Ⅱ期实验中对多种肿瘤无效。研究认为是由于药物无法有效输送到肿瘤部位[20]。
2.3 氮氧类化合物
氮氧键化合物作为低氧活化基团,引起了研究人员的注意。Brown[21]发现,芳香族氮氧化合物替拉扎明(TPZ)对低氧肿瘤细胞有50~200倍的选择性。这类化合物能够经过单电子还原生成具有DNA损伤性的自由基。随后,Wilson[22]发现脂肪族氮氧化合物也具有类似的性质。脂肪族氮氧键通过双电子还原形成叔胺,该过程能够受到氧气的抑制,因而该过程对氧气敏感,具有低氧选择性。该类代表化合物有AQ4N。
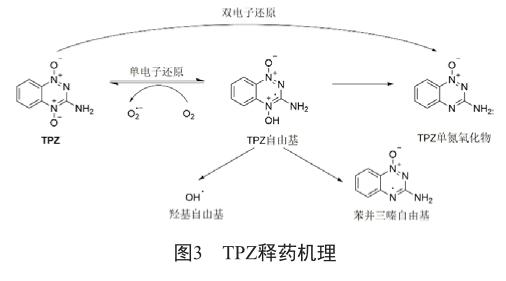
作为芳香族氮氧化合物的代表,TPZ经单电子还原酶(如细胞色素P450还原酶)的作用,可逆地形成自由基中间体,在低氧的条件下,继续还原生成具有DNA损伤性的羟基自由基和苯并三嗪自由基。TPZ也可以被双电子还原酶(如醌还原酶)还原,但代谢产物不具有细胞毒性(图3)。这样特殊的性质使得TPZ在多个细胞株上表现出了良好的低氧选择性。TPZ经历了广泛的临床实验研究,然而,TPZ水溶性差,在体内代谢速率快,穿透性差,不能有效达到低氧区域,这些缺陷最终限制了其在临床上的应用。
脂肪类氮氧化物AQ4N能够被双电子还原酶(如细胞色素P450同功酶和一氧化氮合成酶)还原,由于氧气能够竞争性与这两种酶结合,对AQ4N的还原造成抑制,因而AQ4N具有低氧选择性(图4)。经还原后生成的AQ4对DNA有着很强的非共价结合能力,并且能够同时抑制拓扑异构酶Ⅱ,进而抑制细胞的增殖。临床研究发现,AQ4N的主要问题在于安全性不足。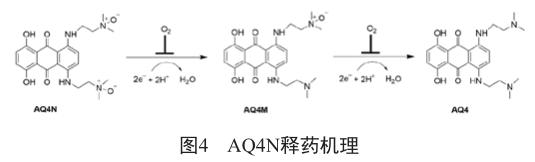
2.4 硝基苯类化合物
硝基苯类化合物是最早被验证具有低氧选择性,并应用于低氧激活前药的开发。PR-104是硝基苯类化合物的代表药物,它是一种水溶性磷酸酯的双重前药。PR-104在体内能够迅速水解形成相应的醇PR-104A,PR-104A是具有低氧选择性的化合物,硝基经过单电子或双电子还原生成羟氨(PR-104H)和胺(PR-104M),而PR-104H和PR-104M能与DNA发生交联作用发挥细胞毒性。PR-104A能够被多种氧化还原酶代谢,在有氧和低氧条件下均能降解(图5)。PR-104在动物实验中证明具有显著的活性,可抑制肿瘤的生长、减少肿瘤细胞对组织的渗透、延长小鼠的生存期。在肝癌异种移植模型中,PR-104能够抑制肿瘤的生长,并且与索拉非尼的联合治疗,效果更为显著。然而,在Ⅰ期临床实验中,PR-104对实体瘤的抑制效果较弱,且有一定的骨髓抑制和中性粒细胞减少作用[23]。

2.5 硝基咪唑类化合物
硝基咪唑类化合物起初作为放疗增敏剂广泛应用于肿瘤放射治疗(图6)。硝基作用机理与氧气类似,在硝基自由基的参与下,受电离辐射诱导生成的DNA自由基无法重新获得电子进行自我修复,造成不可逆的DNA损伤。受此机理的启发,将硝基类化合物连接上更为有效DNA损伤药物,成为低氧激活前药发展的一个重要方向。
TH-302是基于2-硝基咪唑的前药,在低氧条件下被单电子还原酶(如细胞色素P450还原酶)激活,通过氨基咪唑的自消除反应,发生分子的裂解,释放DNA烷化剂溴代异磷酰胺芥(Br-IPM)(图7)[24]。TH-302对多种肿瘤细胞展现出了抗癌活性,尤其是对存在DNA修复缺陷的细胞,如BRCA1,BRCA2或FANCA,在人肺癌H460細胞株上展现高达270倍的低氧选择性。在临床前研究中对多种实体瘤模型有效,包括胰腺癌、乳腺癌、非小细胞肺癌、骨肉瘤、急性骨髓性白血病。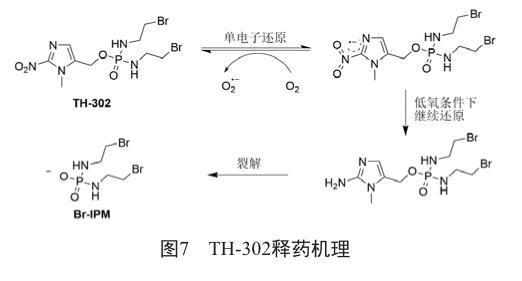
TH-302诱导产生静息和增殖细胞中的DNA交联,通过细胞周期阻滞和诱导细胞凋亡来抑制肿瘤细胞增殖和肿瘤生长。急性骨髓性白血病异种移植模型的体内研究表明,TH-302能够抑制低氧细胞,延长生存期,减少白血病干细胞。小鼠在经过注射TH-302之后,生存期延长,这表明该方法可能适用于消除化疗耐药性白血病细胞,证明了通过低氧激活前药靶向低氧肿瘤细胞的可行性。在此基础上,TH-302进行了Ⅰ/Ⅱ期临床试验,作为实体瘤和急性白血病的单一疗法。然而,结果证明其临床效果有限,只有少数短暂的积极应答。目前,研究人员更多地选择将低氧激活前药与普通抗癌药物联合用药用于肿瘤的治疗。
TH-302与常规抗肿瘤药物或分子靶向药物联合用药的治疗方法已经在多个临床前实体瘤模型和恶性血液肿瘤中应用。在不同的肿瘤异种移植模型中,TH-302显著增加了DNA损伤、凋亡和肿瘤坏死,减少了细胞内缺氧,同时没有增加毒性。在胰腺癌异种移植模型中,TH-302与吉西他滨联合用药显示了良好的效果;与放射治疗联合使用,TH-302能够增强放疗的抗肿瘤效果。在神经母细胞瘤和横纹肌肉瘤异种移植模型中,TH-302与拓扑替康的联合用药,提高了肿瘤治疗效果,延长了生存期。
然而令人失望的是,2015年12月,TH-302与吉西他滨联合用药用于软组织瘤和胰腺癌的Ⅲ期临床实验宣告失败,实验结果表明药物无法长期有效靶向肿瘤。然而,对于TH-302的研究并没有终止,其它各项临床实验仍在进行中。
3 总结与展望
靶向低氧相关信号通路的研究,如HIF-1a、mTOR,是研究的热门方向,并且已有成功上市的药物。对于低氧激活前药的开发,到目前为止,尽管不断有新的化合物进入临床研究,但是仍没有一个成功的案例。如何解决低氧激活前药靶向性不足的问题,将成为其研究和发展的关键。本单位利用2-硝基咪唑为活化基团,以7-乙基-10-羟基喜树碱(SN-38)和紫杉醇为药效基团,设计与合成了一系列低氧激活前药,以解决现有低氧激活前药靶向性不足的问题,克服低氧引起的肿瘤耐药性[25-26]。
参考文献
[1] Kaelin Jr WG, Ratcliffe PJ, Semenza GL. Out of breath: molecular description of cellular responses to hypoxia-2019 Nobel Prize for Physiology or Medicine[J]. Curr Sci, 2019, 117(9): 1418-1419.
[2] Thomlinson RH, Gray LH. The histological structure of some human lung cancers and the possible implications for radiotherapy[J]. Br J Cancer, 1955, 9(4): 539-549.
[3] Harris AL. Hypoxia - a key regulatory factor in tumor growth[J]. Nat Rev Cancer, 2002, 2(1): 38-47.
[4] Eales KL, Hollinshead KER, Tennant DA. Hypoxia and metabolic adaptation of cancer cells[J/OL]. Oncogenesis, 2016, 5(1): e190. doi: 10.1038/oncsis.2015.50.
[5] Zeng W, Liu P, Pan W, et al. Hypoxia and hypoxia inducible factors in tumor metabolism[J]. Cancer lett, 2015, 356(2 Pt A): 263-267.
[6] Wilson WR, Hay MP. Targeting hypoxia in cancer therapy[J]. Nat Rev Cancer, 2011, 11(6): 393-410.
[7] Brown JM, Wilson WR. Exploiting tumour hypoxia in cancer treatment[J]. Nat Rev Cancer, 2004, 4(6): 437-447.
[8] Sharma A, Arambula JF, Koo S, et al. Hypoxia-targeted drug delivery[J]. Che Soc Rev, 2019, 48(3): 771-813.
[9] Wigerup C, P?hlman S, Bexell D. Therapeutic targeting of hypoxia and hypoxia-inducible factors in cancer[J]. Pharmacol ther, 2016, 164: 152-169.
[10] Semenza GL. Pharmacologic targeting of hypoxia-inducible factors[J]. Annu Rev Pharmacol Toxicol, 2019, 59: 379-403.
[11] Phillips RM. Targeting the hypoxic fraction of tumours using hypoxia-activated prodrugs[J]. Cancer Chemother Pharmacol, 2016, 77(3): 441-457.
[12] Baran N, Konopleva M. Molecular pathways: hypoxiaactivated prodrugs in cancer therapy[J]. Clin Cancer Res, 2017, 23(10): 2382-2390.
[13] Liu J, Bu W, Shi J. Chemical design and synthesis of functionalized probes for imaging and treating tumor hypoxia[J]. Chem Rev, 2017, 117(9): 6160-6224.
[14] Semenza GL. Hypoxia-inducible factors: mediators of cancer progression and targets for cancer therapy[J]. Trends Pharmacol Sci, 2012, 33(4): 207-214.
[15] Giaccia A, Siim BG, Johnson RS. HIF-1 as a target for drug development[J]. Nat Rev Drug Discov, 2003, 2(10): 803-811.
[16] Poon E, Harris AL, Ashcroft M. Targeting the hypoxia- inducible factor (HIF) pathway in cancer[J]. Expert Rev Mol Med, 2009, 11: e26.
[17] Siddiqui FA, Prakasam G, Chattopadhyay S, et al. Curcumin decreases Warburg effect in cancer cells by down-regulating pyruvate kinase M2 via mTOR-HIF1α inhibition[J]. Sci Rep, 2018, 8(1): 8323.
[18] Wong KK, Engelman JA, Cantley LC. Targeting the PI3K signaling pathway in cancer[J]. Curr Opin Genet Dev, 2010, 20(1): 87-90.
[19] Hall MD, Failes TW, Yamamoto N, et al. Bioreductive activation and drug chaperoning in cobalt pharmaceuticals[J]. Dalton Trans, 2007(36): 3983-3990.
[20] Phillips RM, Hendriks HR, Peters GJ. EO9 (apaziquone): from the clinic to the laboratory and back again[J]. Br J Pharmacol, 2013, 168(1): 11-18.
[21] Brown JM. SR 4233 (tirapazamine): a new anticancer drug exploiting hypoxia in solid tumors[J]. Br J Cancer, 1993, 67(6): 1163-1170.
[22] Denny WA, Wilson WR. Tirapazamine: a bioreductive anticancer drug that exploits tumour hypoxia[J]. Expert Opin Investig Drugs, 2000, 9(12): 2889-2901.
[23] Guise CP, Wang AT, Theil A, et al. Identification of human reductases that activate the dinitrobenzamide mustard prodrug PR-104A: a role for NADPH: cytochrome P450 oxidoreductase under hypoxia[J]. Biochem Pharmacol, 2007, 74(6): 810-820.
[24] Duan JX, Jiao H, Kaizerman J, et al. Potent and highly selective hypoxia-activated achiral phosphoramidate mustards as anticancer drugs[J]. J Medl Chem, 2008, 51(8), 2412-2420.
[25] Jin C, Zhang Q, Lu W. Synthesis and biological evaluation of hypoxia-activated prodrugs of SN-38[J]. Eur J Med Chem, 2017, 132: 135-141.
[26] Jin C, Wen S, Zhang Q , et al. Synthesis and biological evaluation of paclitaxel and camptothecin prodrugs on the basis of 2-nitroimidazole[J]. ACS Med Chem Lett, 2017, 8(7): 762-765.
