淮山药RS3抗性淀粉制备及其消化特性
2020-08-18谢三都陈惠卿谢小伟吴秀清
谢三都,陈惠卿,谢小伟,吴秀清
(闽南科技学院,福建泉州 362332)
淮山药(Dioscorea opposita),又称淮山,为多年生藤本植物薯蓣(Dioscorea opposita Thunb.)的块茎,在我国有2 000多年的种植历史,是卫生部公布的药食两用食物[1-3],是福建省主要栽培的经济作物之一[4],富含淀粉。淀粉是由直链淀粉和支链淀粉组成的高分子化合物,是大多数谷物的主要成分[5]。根据淀粉在人体内不同消化速度,淀粉可分为RDS、SDS和RS[6]。根据不同制备方法RS可分为RS1型(物理包埋法)、RS2型(天然抗性淀粉颗粒)、RS3型(老化淀粉)、RS4型(化学改性淀粉)。目前,制备淮山药抗性淀粉的方法主要以压热处理、湿热处理、韧化处理等物理方法为主[7-15]。
以淮山药为研究对象,采用酶解-压热法制备淮山药RS3抗性淀粉(Chinese Yam Resistant Starch-RS3,简称CYRS-RS3),在考查了淮山药淀粉乳pH值、普鲁兰酶用量、酶解时间、加热温度、加热时间及老化时间对淮山药RS3抗性淀粉得率影响的基础上,采用正交试验优化淮山药RS3抗性淀粉的制备工艺条件,并研究其消化特性,为将淮山药RS3抗性淀粉作为低热量、低糖量等食品的良好原料提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 试验材料
淮山药,福建省山格农业综合开发有限公司提供,经去皮、护色、切片、烘干、打磨成粉后得淮山药粉。
1.1.2 试验试剂
普鲁兰酶(10万U/g),恒锐食品生物科技有限公司提供;α-淀粉酶(9 U/mg)、糖化酶(10万U/mL),上海源叶生物科技有限公司提供;C6H12O6、NaOH、 Na2HPO4·12H2O、 CuSO4·5H2O、 KOH、NaKC4H4O6·4H2O,天津市福晨化学试剂厂提供;KH2PO4,国药集团化学试剂有限公司提供;HCl,兰溪旭日化工有限公司提供;K4Fe(CN)6·3H2O、C16H18CIN3S,西陇科学有限公司提供。以上均为分析纯。
1.1.3 仪器与设备
HH4型数显恒温水浴锅,国华电器有限公司产品;上海雷磁PHS-3CpH计,上海仪电科学仪器股份有限公司产品;FA2004型电子天平,上海衡平仪器仪表厂产品;BCD-168E/C型冰箱,海信科龙电器股份有限公司产品;101-1AB型电热鼓风干燥箱,天津泰斯特仪器有限公司产品;Autoclave·GI36D型高压灭菌锅,厦门精艺兴业科技有限公司产品;TDL-60C型低速台式离心机,上海安亭科学仪器厂产品;SHA-B型恒温振荡器,国华企业有限公司产品。
1.2 试验方法
1.2.1 抗性淀粉制备流程
参考聂凌鸿等人[16]、阮思莲等人[17]、李宝瑜等人[18]、对淮山药RS3抗性淀粉制备方法的研究。准确称量2.00 g淮山药粉,转移至烧杯中,并按1∶9的比例(m/V) 加入蒸馏水配成淀粉乳。待搅拌均匀,用浓度为1 mol/L的盐酸溶液调节pH值至4.5,再加入一定酶底比(普鲁兰酶活力与底物质量比,U/g) 的普鲁兰酶液,在60℃恒温水浴锅中脱支处理一定时间。调节淮山药粉乳pH值在一定梯度范围内,放入90℃水浴锅中预糊化,同时灭酶处理5 min,在设定一定温度的高压灭菌锅中加热处理一段时间。取出后室温冷却,放于4℃的环境中,老化回生一段时间,取出样品涂片干燥、磨粉,过100目筛,即得CYRS-RS3成品。
1.2.2 抗性淀粉含量的测定
参考张丽芳等人[19]、Goni等人[20]抗性淀粉测定方法大致模拟人体内环境条件,先去除易消化淀粉,再用抗性淀粉溶解和酶解,最后测量样液的葡萄糖含量,以此计算CYRS-RS3得率。
式中:Q——淮山药抗性粗淀粉中CYRS-RS3得率,%;
X——测得试样中酶解葡萄糖的含量,g/g;
I——未经处理的淮山药粉还原糖含量,g/g;
m——称取的抗性淀粉样品,g;
0.9 ——葡萄糖质量与淀粉质量转换系数。
1.2.3 葡萄糖含量的测定
参考王启军[21]直接滴定法测定食品中还原糖含量:
式中:X——试样中酶解葡萄糖的含量,g/g;
A——碱性酒石酸铜溶液(甲、乙各5 mL)相当于葡萄糖的质量,mg;
m——样品的质量,g;
V1——测定时平均消耗未经酶处理样品溶液的体积,mL;
V2——测定时平均消耗经酶处理样品溶液的体积,mL。
1.2.4 消化率的测定
参考李涛等人[22]、琚长霄[23]根据In-vitro消化模型模拟人体的内环境,进行适当修改。在37℃恒温水浴环境中模拟人体体温环境,用胰α-淀粉酶以及糖化酶同时酶解CYRS-RS3,2种酶之间协同作用可抑制胰α-淀粉酶产物环糊精在模型中堆积导致酶活性的降低。再利用透析袋的半透膜特性使酶解的葡萄糖扩散于整个模型体中,以模拟人体肠道功能。再用直接滴定法测定烧杯中缓冲液葡萄糖含量,以此计算CYRS-RS3的消化率。
式中:V(平均)——5 h内CYRS-RS3平均每1 h样品消化的量,%;
I——未酶解的淮山药粉还原糖含量,g/g;
X——在整个模型取出的样品液中葡萄糖含量,g;
P——模型中取出的样品液体积,mL;
W——所用CYRS-RS3的质量(干基),g;
0.9 ——葡萄糖质量与淀粉质量转换系数。
1.2.5 单因素试验设计
(1) 普鲁兰酶用量。在淀粉乳中按酶底比为(0,90,180,270,360,450,540 U/g) 加入普鲁兰酶,酶解时间20 min,调节pH值6,在100℃压热温度下,加热处理时间20 min,待冷却后,4℃环境下老化时间16 h,测CYRS-RS3得率。
(2)酶解时间。在淀粉乳中按酶底比为180 U/g加入普鲁兰酶,分别酶解(0,5,10,15,20,25,30 min),调节pH值6,在100℃压热温度下,加热处理20 min,待冷却后,4℃环境下老化时间16 h,测CYRS-RS3得率。
(3) 淀粉乳pH值。在淀粉乳中按酶底比为180 U/g加入普鲁兰酶,酶解时间5 min,将淀粉乳pH 值调至 (5.5,6.0,6.5,7.0,7.5,8.0,8.5),在100℃条件下,加热处理20 min,待冷却后,4℃环境下老化处理16 h,测CYRS-RS3得率。
(4)压热温度。在淀粉乳中按酶底比为180 U/g加入普鲁兰酶,酶解时间5 min,调节pH值至6,分别在(90,95,100,105,110,115,120℃) 温度下,加热处理20 min,待冷却后,于4℃环境下老化处理16 h,测CYRS-RS3得率。
(5)压热时间。在淀粉乳中按酶底比为180 U/g加入普鲁兰酶,酶解时间5 min,调节pH值至6,在100℃温度下,分别加热处理(0,10,20,30,40,50,60 min),待冷却后,4℃环境下老化处理16 h,测CYRS-RS3得率。
(6)老化时间。在淀粉乳中按酶底比为180 U/g加入普鲁兰酶,酶解时间5 min,调节pH值至6,在100℃下加热20 min,待冷却后,于4℃环境下分别老化处理 (0,6,12,18,24,30,36 h),测CYRS-RS3得率。
1.2.6 CYRS-RS3制备工艺优化
基于上述单因素试验,以CYRS-RS3得率为指标,采用正交试验对淀粉乳pH值(A)、普鲁兰酶用量(B)、酶处理时间(C)、压热温度(D)、压热时间(E)、老化时间(F) 进行优化,确定制备CYRS-RS3最佳工艺参数。
正交试验制备CYRS-RS3工艺因素与水平设计见表1。
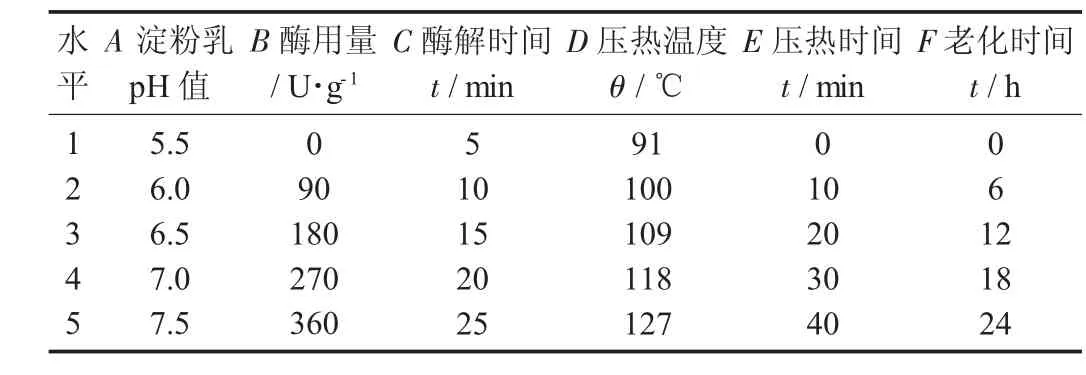
表1 正交试验制备CYRS-RS3工艺因素与水平设计
2 结果与分析
2.1 淀粉乳pH值对CYRS-RS3得率的影响
不同淀粉乳pH值对CYRS-RS3得率的影响见图1。
由图1可知,CYRS-RS3得率随着pH值的上升先增后减,当pH值6时其产率达到最大值,为11.6%±0.096%(p<0.01);继续增大pH值,淀粉乳溶液逐步变为碱性,不利于抗性淀粉的形成,导致CYRS-RS3得率下降。因此,制备淮山药RS3抗性淀粉时其溶液pH值6.0为宜。
2.2 普鲁兰酶用量对CYRS-RS3得率的影响
采用普鲁兰酶处理淮山药粉时,其主要作用于淮山药淀粉的支链转化为直链淀粉,从而促进抗性淀粉的生成。
不同普鲁兰酶用量对CYRS-RS3得率的影响见图2。
由图2可知,CYRS-RS3得率随着普鲁兰酶用量的增加呈先增大后减少的趋势,当酶用量达到180 U/g时,CYRS-RS3得率最高为14.7%±0.15%(p<0.01)。但继续增加普鲁兰酶用量时,支链淀粉脱支产生的短直链淀粉增加,不利于抗性淀粉的形成,CYRS-RS3得率反而下降。因此,制备淮山药RS3抗性淀粉时普鲁兰酶用量选择180 U/g左右为宜。
2.3 普鲁兰酶酶解时间对CYRS-RS3得率的影响
不同普鲁兰酶酶解时间CYRS-RS3得率的影响见图3。
由图3可知,采用180 U/g普鲁兰酶处理淮山药粉所得CYRS-RS3得率为13.6%±0.19%,明显高于未经酶处理的CYRS-RS3得率为9.5%±0.13%(p<0.01),说明普鲁兰酶处理有利于抗性淀粉的生成。但酶处理时间过长,由于短直链淀粉的生成量加大,反而不利于抗性淀粉的生成,CYRS-RS3得率持续下降。因此,制备淮山药RS3抗性淀粉时普鲁兰酶处理时间选择5min左右为宜。
2.4 压热温度对CYRS-RS3得率的影响
压热温度足够高有助于淀粉的糊化,从而强化抗性淀粉的生成,但温度过高可能会使淀粉结构被破坏,从而弱化抗性淀粉的生成。
不同压热温度对CYRS-RS3得率的影响见图4。
由图4可知,当压热温度达到100℃时,CYRSRS3得率最高为14.9%±0.21%(p<0.05);增加压热温度,CYRS-RS3得率呈下降趋势。因此,制备淮山药RS3抗性淀粉时压热温度选择100℃左右为宜。
2.5 压热时间对CYRS-RS3得率的影响
热处理时间是保证淀粉能否完全糊化的主要因素之一。
不同压热时间对CYRS-RS3得率的影响见图5。
由图5可知,当压热时间达到20 min时,CYRS-RS3得率最高为16.9%±0.24%(p<0.05);继续增加压热时间,CYRS-RS3得率反而下降。因此,制备淮山药RS3抗性淀粉时压热时间选择20 min左右为宜。
2.6 老化时间对CYRS-RS3得率的影响
淀粉糊化后的老化在低温下进行,是一个淀粉分子链重排的过程,该过程进行相对缓慢。
不同老化时间对CYRS-RS3得率的影响见图6。
由图6可知,当老化时间达到18 h时,CYRSRS3得率增至最高值17.8%±0.21%,但与12 h时CYRS-RS3得率17.4%±0.20%无显著差异(p>0.05);继续延长老化时间,CYRS-RS3得率无显著变化(p>0.05)。因此,制备淮山药RS3抗性淀粉时老化时间至少应该12 h以上为宜。
2.7 正交试验结果分析
CYRS-RS3制备工艺条件优化正交试验结果与分析见表2,正交试验结果方差分析见表3。

表2 CYRS-RS3制备工艺条件优化正交试验结果与分析
由表2可知,通过比较各因素极差R值大小,可知各因素对CYRS-RS3得率影响大小依次是E>F>C>B>D>A,确定制备最佳因素水平为A1B3C1D3E3F4,即淮山药淀粉乳pH值5.5,普鲁兰酶用量为180 U/g,酶解时间5 min,压热温度109℃,压热时间20 min,老化时间18 h。
由表3可知,对CYRS-RS3制备的正交试验进行方差分析,其中加热温度因素在试验水平内对CYRS-RS3得率影响极显著(p<0.01),老化时间因素在试验水平内对CYRS-RS3得率影响显著(p<0.05),其他因素影响不显著。

表3 正交试验结果方差分析
以淮山药淀粉乳pH值5.5,普鲁兰酶酶用量为180 U/g,酶解时间5 min,压热温度109℃,压热时间20 min,老化时间18 h为制备CYRS-RS3的工艺参数进行验证试验,所得CYRS-RS3得率为20.7%±0.26%。
2.8 CYRS-RS3消化率
淮山药粉与CYRS-RS3在5 h内的平均消化率见表4。
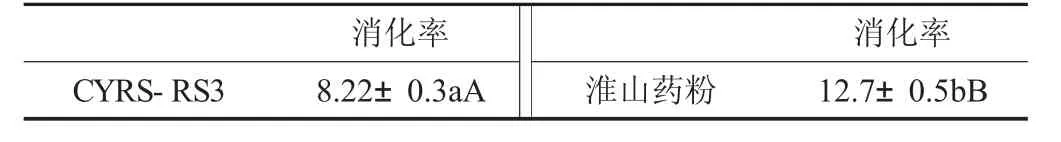
表4 淮山药粉与CYRS-RS3在5 h内的平均消化率/%
由表4可知,CYRS-RS3平均消化率为8.22%±0.3%,比淮山药粉的平均消化率为12.7%±0.5%明显降低(p<0.01),说明酶解-压热法所制备的抗性淀粉比原淮山药粉具有更强的抗消化能力。
3 结论
采用普鲁兰酶处理淮山药粉以制备淮山药RS3抗性淀粉过程中,淀粉溶液的pH值、酶用量、酶解时间等因素会影响CYRS-RS3得率。其中,当淀粉溶液处于适当的酸碱度时能提高淀粉乳中直链淀粉的释放,从而提高抗性淀粉得率,而碱性环境下,由于短直链淀粉的生成增多而不利于抗性淀粉的生成[24];所采用的普鲁兰酶为脱支酶,作用对象为支链淀粉侧链脱支转化为直链淀粉,但酶处理过度,侧链脱支过多,产生短直链淀粉增多反而不利于抗性淀粉的生成[25];酶解时间太长,同样会由于短直链淀粉生成量多而不利于抗性淀粉的生产[26]。
在抗性淀粉的制备过程中,需要将原淀粉进行充分的糊化,以利于淀粉分子链解绕释放直链淀粉,而淀粉糊化与其热处理温度和热处理时间息息相关。适当的热处理温度,能有效地将淀粉分子链打乱而后发生重新聚合、卷曲、折叠现象,同时有助于糖苷键断裂,以提高直链淀粉溶出率,从而增加抗性淀粉得率,但温度过高容易引起淀粉二级螺旋结构遭到破坏,内部疏水基团暴露,从而影响抗性淀粉生成[27];而研究发现热处理时间不足,不利于直链淀粉从淀粉中分离,热处理时间太长,容易产生大量的短直链淀粉,其运动相对激烈,不容易结晶凝沉,不利于抗性淀粉生成[28]。
经糊化后的淀粉在低温条件下其直链淀粉分子之间会发生自动重排,形成双螺旋结构的结晶,从而制备出抗性淀粉,但此过程相对缓慢,需要较长时间才能完成,但老化时间太长也无助于生成更多的抗性淀粉[29]。
综上所述,采用酶解-压热法制备淮山药RS3抗性淀粉的最佳工艺条件为淮山药淀粉乳pH值5.5,酶用量180 U/g,酶处理时间5 min,压热温度109℃,压热时间20 min,老化时间18 h,且在该参数条件下的淮山药RS3抗性淀粉得率为20.7%±0.26%。运用In-vitro消化模型,测得最佳工艺下的HYRS-RS3在5 h内平均消化率为8.22%±0.3%显著低于原淮山药粉的平均消化率为12.7%±0.5%,结果表明以HYRS-RS3的为原料开发的新产品虽然具有一定抗消化特性,但试验过程发现该方法制得的抗性淀粉容易使成产品风味变得干涩、质地较硬,整体口感变差,且可能不利于保证新产品的色泽,因此在实际运用中需要进一步探究淮山药RS3抗性淀粉理化性质的改进。
