鲜牛奶中丙酸杆菌的筛选、鉴定及特性分析
2020-08-17范小飘高文文李欣芮赵鹏昊尚佳萃孟祥晨
范小飘,高文文,李欣芮,赵 桉,赵鹏昊,尚佳萃,赵 乐,周 雪,孟祥晨
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江哈尔滨150038)
丙酸杆菌是无芽孢、革兰氏阳性的兼性厌氧菌,主要存在于干酪、生牛奶及其他乳制品、青贮饲料、土壤中,最近有人在酒曲和窖泥中也分离到了丙酸杆菌[1]。丙酸杆菌作为益生菌的应用极其广泛,如食品发酵剂、抑制病原微生物、维持肠道菌群平衡、促进其他益生菌增殖、抗炎、提高机体免疫力等益生功能[2-4],因此,研究人员常将丙酸杆菌作为微生态制剂添加到食品、药品、饲料等多种领域以发挥多种益生作用。传统上,丙酸杆菌被用作瑞士干酪的发酵剂,特别是费氏丙酸杆菌(Propionibacteriumfreudenreichii),在瑞士干酪成熟过程中,赋予干酪典型的大孔质地和特征性的风味[2],费式丙酸杆菌谢氏亚种(P.freudenreichiisubsp.shermanii)JS最初分离自瑞士干酪,几十年来一直作为芬兰Jarlsberg干酪的发酵剂使用,该菌株还与鼠李糖乳杆菌 LC705联合用作保护性发酵剂,用于发酵食品的生物防腐[5]。除此之外,丙酸杆菌能通过促双歧杆菌生长来调节肠道微生物菌群,并通过产生细菌素来保护机体免受病原微生物的侵染[6]。其与嗜酸乳杆菌、动物双歧杆菌亚种组合,可用于生产益生菌饮料,感官评价表明上述微生物组合发酵可以生产风味更好的饮料[7]。最新研究表明丙酸杆菌可粘附于肠上皮细胞具有调节肠粘膜的重要功能,并且其表面蛋白参与抗炎特性[4]。因此,丙酸杆菌是极具潜力,并对人们有利的益生菌。
丙酸杆菌的主要代谢产物为丙酸,又被称作甲基乙酸,是一种重要的天然有机弱酸。美国食品药品监督管理局认为丙酸及其钙、钠和钾盐是一般公认安全(Generally recognized as safe,GRAS)的食品添加剂,广泛应用于抗微生物剂[8]、抗炎剂[9]、食品防腐剂[10]、除草剂[11]和人造香料[12]等。近年来,由于人们对天然食品和绿色添加剂需求的日益增加,通过微生物发酵生产丙酸获得更多关注。Wang等[13]筛选到的一株费氏丙酸杆菌,以葡萄糖为碳源时,丙酸生成量为0.39 g/g,叶文彬等[14]获得的一株丙酸杆菌,丙酸初始生成量为1.2 g/L。由此可见,获得高产丙酸的菌株对生产非常重要。因此,本实验旨在分离筛选获得高产丙酸的菌株,并分析其基本生物学性质,以期为后续高产丙酸菌株的育种以及生物防腐菌种的开发奠定基础。
1 材料与方法
1.1 材料与仪器
新鲜生牛乳 黑龙江省哈尔滨市农户家奶牛;金黄色葡萄球菌(S.aureus)ATCC25923 中国药品生物制品检定所;丙酸(色谱纯) 西亚试剂;细菌基因组DNA提取试剂盒 天根生化科技有限公司;细菌微量生化反应管 青岛海博;药敏纸片 上海源叶生物科技有限公司;引物合成 吉林库美生物科技有限公司;其余试剂 均为分析纯。
Opticlean-1300垂直流洁净工作台 力康精密科技(上海)有限公司;3K15离心机 美国Sigma公司;光学显微镜 上海光学仪器厂;Uvmini-1240紫外分光光度计 日本岛津公司;HPX-87H色谱柱 美国Bio-Rad公司;Waters2695高效液相色谱仪 美国Waters公司。
1.2 实验方法
1.2.1 培养基的配制 分离纯化培养基参考文献[15]。
葡萄糖培养基:葡萄糖10 g,胰蛋白胨10 g,酵母浸粉10 g,加蒸馏水至1000 mL。固体培养基则添加1.8%~2.0%的琼脂。调pH至6.9~7.0,121 ℃灭菌15 min。
甘油培养基:甘油10 g,胰蛋白胨10 g,酵母浸粉10 g,加蒸馏水至1000 mL。调pH至6.9~7.0,121 ℃灭菌15 min。
1.2.2 产丙酸菌的初筛 参照李燕波等[15]的方法,将新鲜生牛乳用磷酸盐缓冲液(PBS)梯度稀释并涂布于固体培养基上初步筛选产丙酸的菌株。
1.2.3 菌株的复筛 以总细菌数为1×108CFU/mL的接种量将初筛中获得的菌株接种于葡萄糖液体培养基中,30 ℃厌氧培养120 h,取1.5 mL发酵液于EP管中,12000 r/min离心10 min,小心吸取上层发酵液,经0.22 μm滤膜过滤后,采用高效液相色谱分析方法测定发酵液中丙酸含量。
1.2.4 高效液相色谱 高效液相色谱条件参照Liu等[16]的方法稍作修改:色谱柱:Biorad Aminex HPX-87H 300 mm×7.8 mm;检测器:紫外检测器(210 nm);流动相:5 mmol/L稀硫酸溶液;流动相流速:0.5 mL/min;柱温:50 ℃;进样量:10 μL。测定丙酸标准品的保留时间为20.5 min,质量浓度(g/L)与峰面积的回归方程为:y=559847x+29157(式中,x代表质量浓度g/L,y代表峰面积),其决定系数R2=0.9998。
1.2.5 分离株菌种鉴定
1.2.5.1 形态学特征 将筛选得到的产丙酸含量最高的菌株B1以总细菌数为1×108CFU/mL的接种量接种于葡萄糖液体培养基中,于30 ℃厌氧培养60 h,连续活化两代后,梯度稀释涂布于固体培养基中,30 ℃厌氧培养5 d后观察其菌落形态,并在超净工作台中挑取单菌落进行革兰氏染色后,置于光学显微镜下进行观察。
1.2.5.2 生理生化及糖发酵实验 参照《伯杰细菌鉴定手册》,对分离株进行硝酸盐还原试验、过氧化氢酶试验、明胶水解试验、产气、运动性试验以及糖发酵试验。
1.2.5.3 16S rDNA同源性分析 细菌基因组DNA的提取:按照天根细菌基因组DNA提取试剂盒说明书稍作修改进行基因组DNA的提取;16S rDNA基因片段扩增反应的上下游引物、PCR扩增反应总体系以及扩增条件参照张秋雪等[17]的方法。
PCR扩增完成后,进行1.5%琼脂糖凝胶电泳,若扩增产物长度在1500 bp左右且无杂带,则将其送至测序公司进行双向测序。将测序结果在NCBI数据库中进行BLAST比对后,使用MEGA 7软件并采用Neighbor-Joining方法将Bootstrap设置为1000,对分离株构建系统发育树。
1.2.5.4 多位点序列分型(MLST) 本试验选取了在丙酸杆菌菌株鉴定中常用的7个管家基因[18]:pf169、fumC、pf1637、recA、gtf、rpoB、adk,其上下游引物信息见表1。

表1 丙酸杆菌MLST扩增引物Table 1 The MLST primers for Propionibacterium
管家基因的PCR扩增体系与16S rDNA基因的扩增体系相同。其扩增反应条件如下:95 ℃预变性3 min;95 ℃变性30 s,58/59/60 ℃退火30 s,72 ℃延伸30 s,循环40次;最后72 ℃末端延伸10 min。其中管家基因pf169退火温度为59 ℃,管家基因gtf退火温度为60 ℃,其余管家基因退火温度都为58 ℃。将7个管家基因的测序结果顺序拼接并进行Blast对比,构建系统发育树,进一步分析分离株间的亲缘关系。
1.2.6 分离株B1在不同培养基中生长及丙酸生成量的测定
1.2.6.1 生长曲线 以总细菌数为1×108CFU/mL的接种量将活化后的菌株分别接种于葡萄糖液体培养基以及甘油液体培养基中,30 ℃厌氧培养120 h,每间隔12 h取1次发酵液,紫外分光光度计测其OD600、pH计测其pH,然后以时间为横坐标,OD600、pH分别为纵坐标绘制生长曲线。
1.2.6.2 丙酸生成量的测定 以总细菌数为1×108CFU/mL的接种量将活化后的菌株分别接种于葡萄糖液体培养基以及甘油液体培养基中,30 ℃厌氧培养120 h,每间隔12 h各取发酵液1.5 mL,将发酵液离心处理(12000 r/min 10 min),仔细吸取发酵上清液,经过0.22 μm滤膜过滤后置于棕色进样瓶中,采用高效液相色谱(HLPC)方法测定丙酸含量。
1.2.6.3 葡萄糖残留量的测定 以总细菌数为1×108CFU/mL的接种量将活化后的菌株接种于葡萄糖液体培养基中,30 ℃厌氧培养120 h,每间隔12 h取发酵液,参照彦繁鹤等[19]的试验方法测葡萄糖残留量。测定葡萄糖标准曲线为y=0.8941x-0.0179(式中,x代表质量浓度g/L,y代表吸光度值),其决定系数R2=0.9991。
1.2.6.4 甘油残留量的测定 以总细菌数为1×108CFU/mL的接种量将活化后的菌株接种于甘油液体培养基中,30 ℃厌氧培养120 h,每间隔12 h取发酵液,参照张永生等[20]的试验方法测定甘油残留量。测定甘油标准品的标准曲线为y=0.0266x+0.0222(式中,x代表质量浓度g/L,y代表吸光度值),其决定系数R2=0.9997。
1.2.7 分离株B1体外安全性评价
1.2.7.1 溶血性实验 通过血平板培养法检测Propionibacteriumfreudenreichiisubsp.shermanii是否具有溶血性。将连续活化两代的分离株划线于含质量浓度为5%人血的哥伦比亚血琼脂培养基,放置厌氧罐中于30 ℃连续培养6 d,观察菌落周围是否有透明的溶血圈出现(β溶血)或绿色晕圈出现(α溶血)或无反应(γ溶血),以此判断受试菌株是否具有溶血性,同时以金黄色葡萄球菌(S.aureusATCC23957)作为阳性对照菌株。
1.2.7.2 抗生素抗性实验 本试验采用药敏纸片扩散法。将待测菌株以总细菌数为1×108CFU/mL的接种量接种于葡萄糖液体培养基中,30 ℃厌氧培养48 h后,在超净工作台中吸取0.1 mL菌悬液均匀涂布于固体培养基上,待培养基表面干燥后,分别镊取含有不同抗生素的药敏纸片贴于培养基表面(每个平板贴3张同一药敏试纸并保持一定间距),30 ℃厌氧培养48 h后,用游标卡尺测量抑菌圈直径。依据美国临床和实验室标准协会(NCCLS)的药敏试验标准执行。不同抗生素的浓度及判定标准见表2。
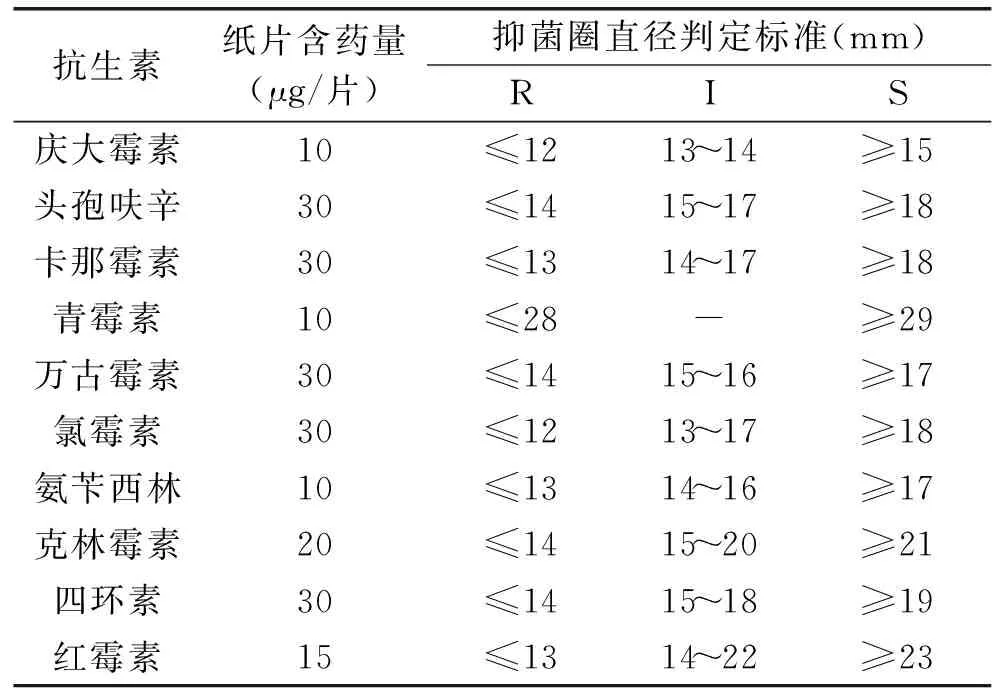
表2 药敏判定标准Table 2 Criterion of drug susceptibility
1.3 数据处理
以上所有试验均进行3次重复。运用Origin 2018对试验所得数据绘图,运用SPSS 23进行差异性分析(P<0.05)。
2 结果与分析
2.1 菌株筛选
采用高效液相色谱方法检测了54株分离菌株培养上清中的丙酸含量,部分结果见表3,大多数菌株的丙酸含量在1.8~3.2 g/L,只有一株菌(B1)的含量达到7.38 g/L,显著高于其他分离株(P<0.05),使用该菌株作为后续试验菌株。

图2 基于16S rDNA基因构建的系统发育树Fig.2 Phylogenetic tree constructed based on 16S rDNA gene

表3 部分分离株培养上清中丙酸含量Table 3 Content of propionic acid in theculture supernatant of some isolates
2.2 分离株B1的鉴定
2.2.1 形态学特征 分离株在固体培养基中30 ℃厌氧培养6 d后,形成直径1 mm左右、乳黄色菌落,微突起,不透明,边缘整齐,表面湿润光滑(图1A)。菌体革兰氏染色阳性,多为短杆状,单在或成对存在,呈“v”字和“y”字形(图1B)。
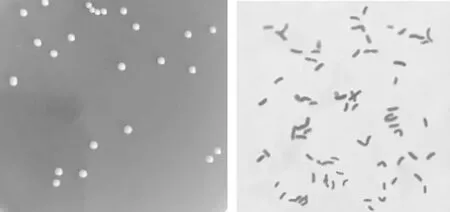
图1 分离株B1菌落(A)及菌体(B)形态Fig.1 Colony(A)and cell morphology(B)of isolated strain B1
2.2.2 生理生化及糖发酵试验 经过生理生化及糖发酵试验,结果比对《伯杰氏细菌鉴定手册》,初步鉴定分离株为费氏丙酸杆菌(表4)。费氏丙酸杆菌有两个亚种:费氏丙酸杆菌谢氏亚种(P.freudenreichiisubsp.shermanii)和费氏丙酸杆freudenreichiisubsp.freudenreichii),前者可以利用乳糖但不还原硝酸盐,而后者不能利用乳糖但可以还原硝酸盐[18],利用这一特性可以区分两个亚种,据此分析,本实验获得的为P.freudenreichiisubsp.shermanii。

表4 分离株的生理生化和糖发酵试验结果Table 4 Physiological biochemical and sugar fermentation identification results of isolated strains
2.2.3 16S rDNA序列同源性分析 以分离株B1的DNA为模板,采用通用引物进行PCR扩增,PCR扩增产物片段达1500 bp后送至测序公司进行测序,将测序结果进行同源性分析并构建系统发育树,结果显示分离株B1与费氏丙酸杆菌亲缘关系最近,同源性为100%(图2)。
2.2.4 多位点序列分型(MLST) 以分离株B1的DNA为模板,对7个管家基因(pf169、fumC、pf1637、recA、gtf、rpoB、adk)进行PCR扩增,获得7个300~600 bp左右长度的扩增产物(图3)。将7个管家基因序列依次串联起来,得到的片段长度大约为3000 bp,经Blast比对后构建系统发育树(图4),结果显示:分离株B1与Propionibacteriumfreudenreichiisubsp.shermaniiPFREUDJS1的同源性达到100%,结果进一步表明:分离株B1为费氏丙酸杆菌谢氏亚种。
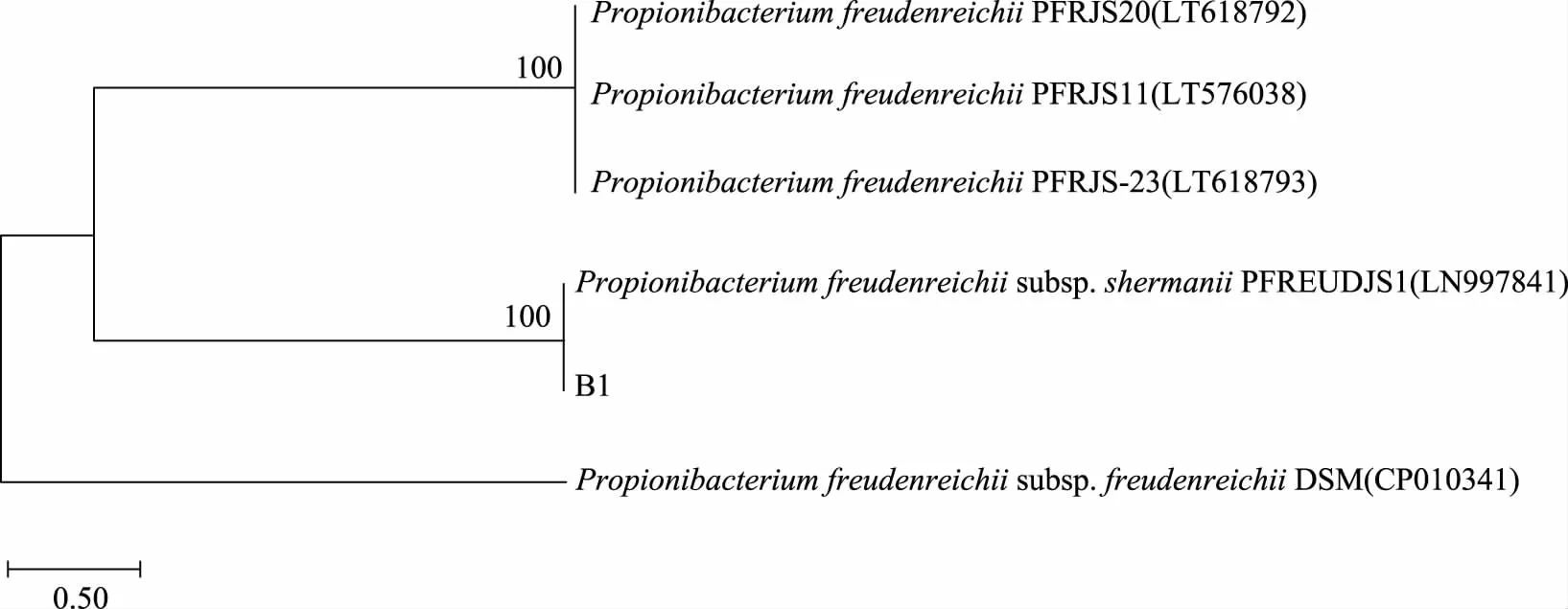
图4 基于七个等位基因构建的系统发育树Fig.4 Phylogenetic tree constructed based on seven alleles
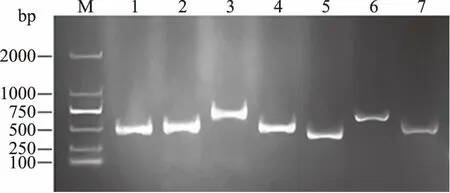
图3 等位基因扩增产物的琼脂糖凝胶电泳结果Fig.3 Agarose gel electrophoresis resultsof allele amplification prod注:M:D2000;1~7:管家基因1~7。
2.3 分离株B1的生长及丙酸生成量
2.3.1 B1在含葡萄糖培养基中生长及产酸情况 菌株B1在0~36 h为对数生长期,36 h后趋于稳定期,到达稳定期后,菌体量基本不变,其OD最终稳定在2.4左右,当培养时间在84 h左右时,pH最终稳定在4.1左右(图5A),而丙酸生成量此时达到7.0 g/L左右(图5B)。培养120 h后,丙酸生成量达到7.38 g/L(图5B)。
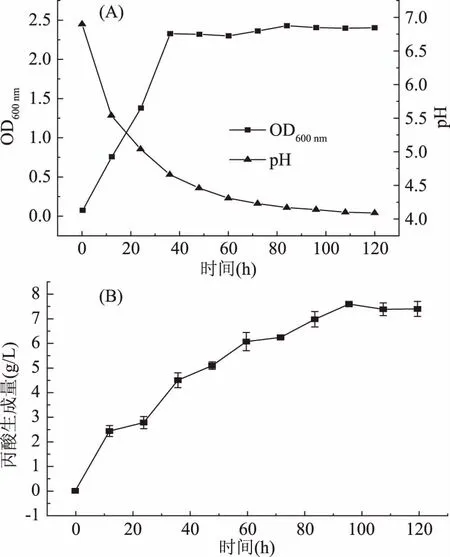
图5 费氏丙酸杆菌B1在含葡萄糖培养基中的生长(A)和产丙酸(B)情况Fig.5 Growth(A)and propionic acid production(B)ofPropionibacterium freudenreichii B1 in glucose-containing medium
分析生长期间葡萄糖的消耗发现,0~72 h葡萄糖消耗速度较快,在第72 h时,葡萄糖消耗了88%,其后的72~120 h葡萄糖消耗放缓,在发酵120 h结束时,消耗了98.5%的葡萄糖(图6)。
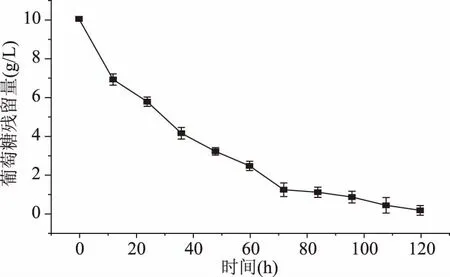
图6 丙酸杆菌B1葡萄糖残留量Fig.6 Glucose residue of Propionibacterium B1
2.3.2 B1在含甘油培养基中生长及产酸情况 菌株B1在0~36 h为对数生长期,36 h后稳定一段时间,在60 h后又有短暂的生长,72 h后到达稳定期后,菌体量基本不变,其OD最终稳定在1.5左右,最终pH在4.75左右(图7A),丙酸生成量最终达到5.45 g/L左右(图7B)。
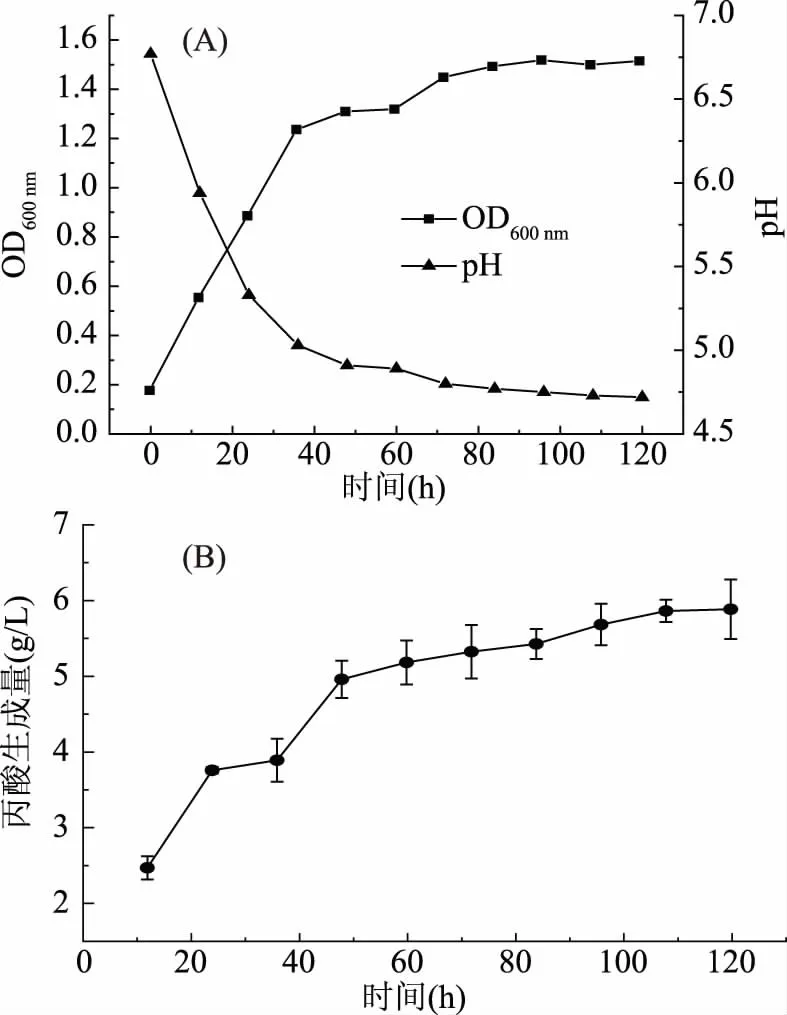
图7 费氏丙酸杆菌B1在含甘油培养基中的生长(A)和产丙酸(B)情况Fig.7 Growth(A)and propionic acid production(B)ofPropionibacterium freudenreichii B1 in glycero-containing medium
分析生长期间甘油的消耗得出(图8),在0~36 h内,甘油被迅速消耗。其后甘油消耗缓慢,在发酵120 h后,甘油残留量仍在5.9 g/L,仅消耗41%的甘油。说明分离株B1在同等时间及培养条件下利用甘油生长及生成丙酸的能力较弱。
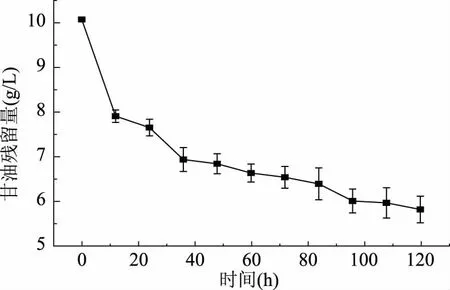
图8 丙酸杆菌B1甘油残留量Fig.8 Glycerin residue of Propionibacterium freudenreichii B1
2.4 分离株B1安全性的体外评价
2.4.1 溶血性 阳性对照菌S.aureusATCC25923在血琼脂平板上菌落较大,凸起,淡黄色不透明,菌落周围出现明显的透明溶血圈(图9B);而费氏丙酸杆菌B1在血琼脂平板上无反应现象,菌落较小,表明该菌株不具有溶血性(图9A)。
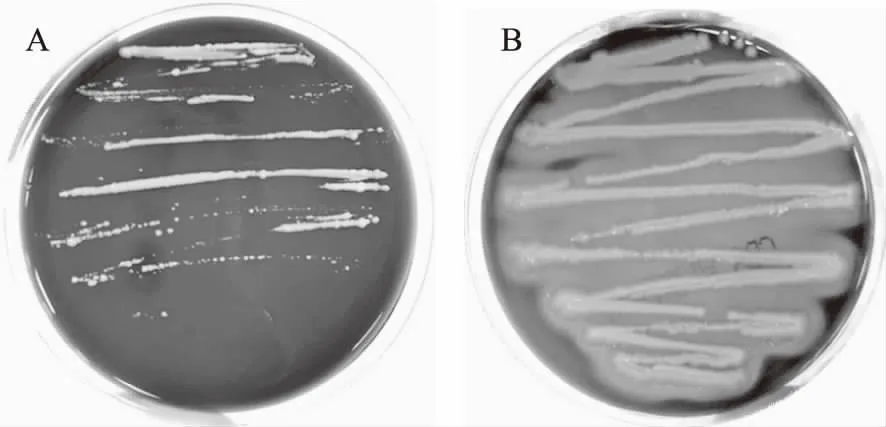
图9 丙酸杆菌B1(A)和S. aureus ATCC25923(B)在血琼脂平板上的生长Fig.9 Hemolytic test of Propionibacterium B1(A)and S. aureus ATCC25923(B)
2.4.2 抗生素敏感性 本试验检测了费氏丙酸杆菌B1对10种抗生素的敏感性,并将S.aureusATCC25923作为质控菌株。结果表明:该菌对氨苄西林、四环素、万古霉素、氯霉素、克林霉素敏感,对卡那霉素、庆大霉素等氨基糖苷类抗生素具有抗性,此外对头孢呋辛、青霉素也具有抗性(表4),需要进一步评价其抗生素抗性机制及抗性转移风险。
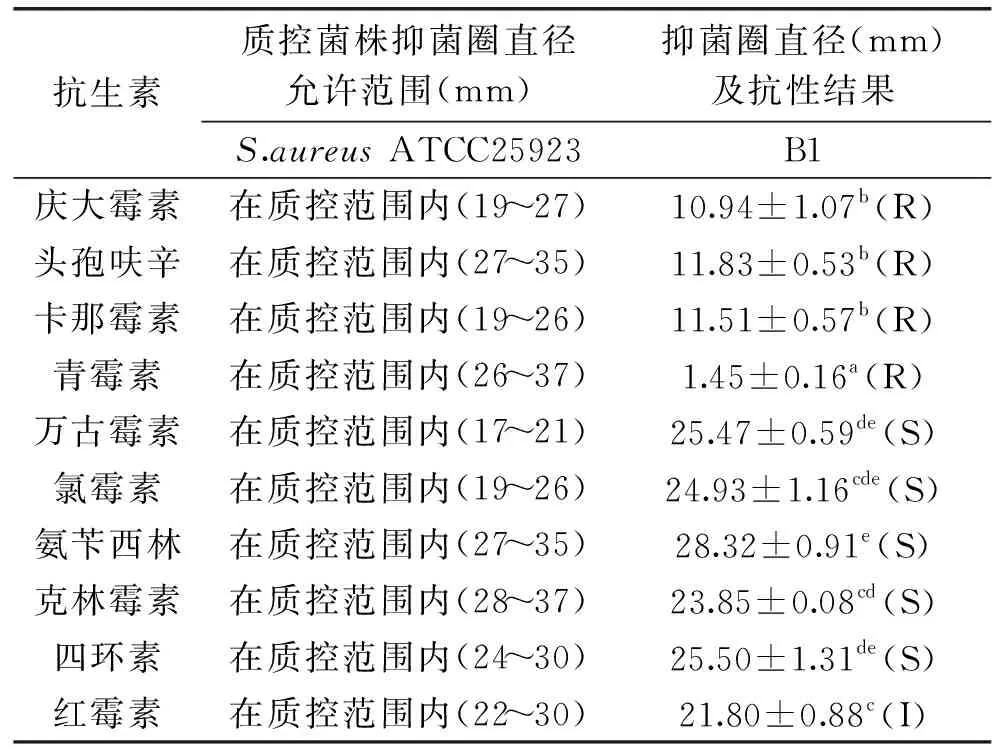
表5 丙酸杆菌B1对抗生素的敏感性Table 5 Sensitivity of Propionibacterium B1 to antibiotics
3 讨论
从新鲜生牛奶中通过选择性培养基,分离得到一株产丙酸的费氏丙酸杆菌B1,除分析了其形态特征、生理生化和糖发酵特性之外,还采用MLST方法分析了这株菌的系统发育特点。基于MLST方法构建的系统发育树与16S rRNA基因构建的系统发育树相比,可以更精确地反映出物种及物种间的进化关系[21]。Delmasso等[18]将113种不同起源的费氏丙酸杆菌亚种通过MLST分型分为46种序列类型(ST),说明费氏丙酸杆菌的分子多样性和种群结构。Mekadim等[21]针对11株丙酸杆菌,比较了16S rRNA同源性分析和选取3个管家基因进行的MLST分析,分别构建系统发育树,发现三种基因的可变区具有更高的分辨力。本实验选取了7个管家基因,分辨效果更好。
碳源种类显著影响丙酸杆菌的丙酸生成量,Wang等[13]筛选到的一株费氏丙酸杆菌,以葡萄糖为碳源时,丙酸生成量为0.39 g/g,叶文彬[14]获得的一株酸性丙酸杆菌,在以葡萄糖为碳源时,丙酸初始生成量为1.2 g/L。本试验获得的费氏丙酸杆菌,同样以葡萄糖为碳源时,丙酸产量最高达到7.59 mg/mL,显著高于现有文献报道。丙酸杆菌代谢产物中主要抑菌物质即为丙酸,郑丽雪等[22]研究发现费氏丙酸杆菌在乳酸钠培养基发酵时,该菌株代谢产物的抑菌活性结果要优于山梨酸钾的抑菌活性。因而筛选一株高产丙酸的菌株十分重要。
理论上,培养基中葡萄糖和甘油在重量相同时,甘油发酵可生成更多的丙酸,通常,1 mol甘油通过EMP途径产生1 mol丙酸而不产生乙酸,理论上丙酸产量为0.80 g/g;而1 mol葡萄糖通过EMP途径产生4/3 mol丙酸和2/3 mol乙酸,理论上丙酸产量为0.55 g/g[13]。但由于甘油发酵会出现氧化还原失衡,导致细胞生长减少和丙酸生成量下降[23],因此,分离株B1在葡萄糖培养基中生长状况较好,并且产生更多的丙酸。
菌株抗生素抗性具有转移风险,因此对于具有应用潜力的菌株需要评价其抗生素抗性。Suomalainen等[24]评价了P.freudenreichiissp.shermaniiJS和P.freudenreichiisubsp.freudenreichii131的抗生素抗性,结果显示菌株对氨苄青霉素、红霉素、维吉霉素、四环素、氯霉素、万古霉素、甲基盐霉素、杆菌肽敏感;对链霉素、庆大霉素和卡那霉素具有抗性。Monika等[25]也发现菌株P.jensenii对庆大霉素、卡那霉素、链霉素具有抗性,对其他类抗生素都敏感。Derya等[26]发现29种丙酸杆菌菌株都对萘啶酸(naldixic acid)有抗性,对庆大霉素、卡那霉素、利福平、多粘菌素耐药性低,对其它抗生素敏感。上述研究结果表明:丙酸杆菌对卡那霉素等氨基糖苷类抗生素的抗性是厌氧细菌的共同特征,因为它们缺乏细胞色素介导的药物转运系统[27]。本研究的费氏丙酸杆菌B1也具有这一特点,但同时也发现该菌对头孢呋辛及青霉素也具有抗性,需要进一步分析耐药机制以及耐药性转移的风险。
4 结论
从生牛奶中分离得到一株费氏丙酸杆菌,生长周期大约为120 h,0~36 h为对数生长期,36 h后趋于稳定期。发现其对葡萄糖的利用率大于对甘油的利用率,在含葡萄糖的培养基中于30 ℃厌氧培养120 h后丙酸产量达到7.38 g/L。该菌株无溶血性,对卡那霉素等氨基糖苷类抗生素有耐药性,对青霉素和头孢呋辛也具有抗性,而对氨苄西林、万古霉素、氯霉素、克林霉素、四环素敏感。需进一步评价其耐药基因的转移风险。以上初步研究结果表明丙酸杆菌B1具有潜在的应用价值,但在使用之前应更全面地评估该菌株的安全性和益生功能。
