5种食用菌多糖的结构特征及抗氧化活性对比
2020-08-17,*,*
,*,*
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
食用真菌具有丰富的营养价值和功能,多糖作为食用菌中的主要活性成分之一,不仅参与了食用菌的生长,还具有多种生物活性[1]。多糖是几乎存在于所有生物体的生物大分子[2],具有多种生物活性,如抗糖尿病[3]、抗肿瘤[4]、免疫调节活性[5]、保肝作用[6]、抗氧化活性等,其在功能性食品、药理学和生物化学领域引起了广泛关注。
近年来,食用真菌和其多糖的抗氧化活性引起了人们的广泛关注。例如从冬虫夏草[7]、牛肝菌[8]、羊肚菌[9]和猴头菇等食用真菌中分离得到的各种多糖对ABTS+·和DPPH·都具有明显的清除作用[10]。但是尽管天然来源的多糖具有多种生物活性,但大多数活性多糖由于组成复杂、分子量大,使其结构特征尚不明确,限制了其应用[11]。生物大分子的生物活性与其结构有着紧密的联系,多糖的分子量[12]、官能团[13]、分支以及构象等结构特征对多糖的生物活性有着影响[14]。朱晓冉等[15]对比了野生黑木耳多糖的三组分子量多糖(Sp1>100 ku;100 ku>Sp2>30 ku;30 ku>Sp3)的抗氧化活性,结果显示,小分子量的Sp3对ABTS+·、DPPH·、·OH的清除效果最好。伯继芳等[16]对比了硫酸化修饰的杏鲍菇多糖(SPEP)和未修饰的杏鲍菇多糖(PEP)的体外生物活性,结果显示,在相同剂量下,SPEP较PEP表现出更好的抗氧化活性及对α-淀粉酶和α-葡萄糖苷酶具有抑制作用。以上结果表明,多糖的分子量、硫酸化修饰等与真菌多糖的抗氧化能力有关,但是目前,关于食用真菌多糖结构与抗氧化活性之间关系的研究尚少。
本研究为了探讨真菌多糖结构与抗氧化活性的构效关系,选取了银耳(Tremellafuciformis)、黑木耳(Auriculariaauricula-judae)、杏鲍菇(Pleurotuseryngii)、金针菇(Flammulinavelutipes)和猴头菇(Hericiumerinaceus)这5种食用菌作为多糖的提取原料,利用高效液相色谱法(HPLC)测定了其单糖的组成,采用傅里叶变换红外光谱、刚果红实验及X-射线衍射(X-ray diffraction,XRD)对它们的结构特征进行分析,同时测定它们的抗氧化活性,比较它们的结构特征、抗氧化活性、50%抑制浓度(half maximal inhibitory concentration,IC50)和单糖的组成,分析其结构与抗氧化的相关性,阐明具有较高抗氧化活性的食用真菌多糖的结构特征,以期为开发多糖功能性食品及抗氧化真菌多糖提供理论依据。
1 材料与方法
1.1 材料与仪器
金针菇、杏鲍菇鲜品 市售;银耳、黑木耳、猴头菇干品 哈尔滨北大荒提供;氯化硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT)、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)、吩嗪硫酸甲酯(phenazine methosulfate,PMS) 美国Sigma公司;单糖 标准品,上海源叶生物有限公司;乙腈 色谱纯,德国默克公司;其他试剂 均为国产分析纯。
HH-4水浴锅 常州赛普实验仪器厂;Alpha 2-4 LSCplus真空冷冻干燥箱 德国Marin Christ公司;YRE-5299旋转蒸发器 予华仪器有限责任公司;Avanti J-E离心机 美国Backman Coulter有限公司;D-8紫外-可见分光光度计 南京菲勒仪器有限公司;Agilent 1260高效液相色谱仪 美国Agilent科技有限公司;Nicolet傅里叶变换红外光谱仪 美国尼高力公司;2700 X射线衍射仪 丹东方圆仪器有限公司。
1.2 实验方法
1.2.1 多糖的提取 采用热浸醇沉的方法对5种食用真菌的多糖进行提取。将5种食用菌在55 ℃烘箱中烘至恒重,粉碎,过80目筛。称取一定质量的食用真菌粉末,按照料液比1∶20加入蒸馏水,浸泡过夜。85 ℃条件下水浴2 h,过滤得滤液。将滤渣再次热水浸提、过滤,将两次滤液混合后,蒸发浓缩至原体积的1/3,4000 r/min离心15 min,上清液中加入无水乙醇,使体系中乙醇浓度为65%,4 ℃过夜。4500 r/min离心20 min,沉淀依次用无水乙醇和95%乙醇洗涤,得食用真菌粗多糖。通过Savge法脱蛋白,重复操作五次后,利用活性炭去除色素,透析(截留分子质量8000~14000 Da)72 h,冷冻干燥得银耳多糖(Tremellafuciformispolysaccharides,TFP)、黑木耳多糖(Auriculariaauricula-judaepolysaccharides,AAP)、杏鲍菇多糖(Pleurotuseryngiipolysaccharides,PEP)、金针菇多糖(Flammulinavelutipespolysaccharides,FVP)和猴头菇多糖(Hericiumerinaceuspolysaccharides,HEP)。
1.2.2 多糖化学组成的测定 采用苯酚-硫酸法测定总糖含量[17];采用考马斯亮蓝法测定蛋白质含量[18];采用间羟基联苯法测定多糖糖醛酸含量[19];采用氯化钡-明胶比色法测定多糖中硫酸基的含量[20];灰分根据GB 5009.4-2016进行测定。
多糖的单糖组成采取柱前衍生化高效液相色谱法测定[21],称取多糖样品2 mg,加入0.5 mL 2 mol/L三氟乙酸溶液,120 ℃温度条件下水解120 min,氮吹吹干。向水解后的单糖样品中加入0.5 mol/L的PMP溶液(溶于无水甲醇)和0.3 mol/L的NaOH溶液各0.5 mL,充分混匀后,70 ℃温度条件下反应30 min。冷却至室温,加入0.3 mol/L HCl溶液0.5 mL,充分混匀。加入0.5 mL氯仿,充分振荡萃取,5000 r/min离心5 min去除氯仿层,萃取3次,0.22 μm滤膜过滤后,待上机。单糖标准品包括葡萄糖、半乳糖、甘露糖、岩藻糖、木糖、鼠李糖、阿拉伯糖、葡萄糖醛酸及半乳糖醛酸,单糖标准品前处理方法与样品相同。
仪器条件:色谱柱:Agilent Extend C18柱(4.6 mm×250 mm,5 μm);流动相:0.1 mol/L pH7.0磷酸盐缓冲溶液-乙腈82.2∶17.8;流速:1.0 mL/min;进样量:10 μL;柱温:25 ℃;波长:245 nm。
1.2.3 结构特征的测定
1.2.3.1 傅里叶变换红外光谱分析 称取干燥多糖样品1~2 mg和KBr研磨均匀,压片,在4000~400 cm-1波长范围内进行红外光谱扫描,记录光谱图。
1.2.3.2 刚果红实验 取1.0 mL 2 mg/mL多糖样品溶液,分别加入3 mL浓度为0.1、0.2、0.3、0.4、0.5 mol/L的NaOH溶液,并加入1.5 mL刚果红溶液以及0.5 mL蒸馏水,充分混匀后,静置1 h。运用紫外分光光度计对反应液进行200~800 nm全波长扫描,记录最大吸收波长,蒸馏水作空白对照。
1.2.3.3 X-射线衍射分析 多糖的X-射线衍射分析的测定条件为:Cu辐射、扫描步长为0.05 °、扫描范围为2θ=5 °~80 °;管流为25 mA,管压为35 kV;发射狭缝(DS)为1 °、接收狭缝(RS)为8 mm,采集后的数据经MDJ Jade 6.0软件进行分析。
1.2.4 多糖抗氧化活性的测定
1.2.4.1 对DPPH·清除活性的测定 将25 mg的DPPH溶于1 L甲醇中,制备浓度为60 mmol/L的DPPH工作液。取1.0 mL不同浓度样品溶液加入3.9 mL DPPH工作液,混合均匀,室温避光反应30 min,于517 nm处测定吸光度[22]。以维生素C作对照,按下式计算DPPH·清除率:
式中:A0为蒸馏水代替样品按上述步骤测定的吸光度;A1为按上述步骤测定的多糖样品的吸光度。
1.2.4.2 对ABTS+·清除活性的测定 将7 mmol/L ABTS溶液加入到等体积的2.45 mmol/L 过硫酸钾溶液中,室温黑暗中放置12 h后,用0.1 mol/L pH7.4磷酸缓冲液稀释,使其在734 nm处的吸光值为0.7±0.02,得ABTS工作液。取1.0 mL不同浓度样品加入4 mL ABTS工作液,摇匀,于734 nm处测定吸光度[23]。以维生素C作对照,按下式计算对ABTS+·清除率:

式中:A0为蒸馏水代替样品按上述步骤测定的吸光度;A1为按上述步骤测定的多糖样品的吸光度;A2为蒸馏水代替ABTS工作液按上述步骤测定的吸光度。
1.2.4.3 对·OH清除活性的测定 取0.5 mL 9 mmol/L的FeSO4溶液和1.0 mL 8.8 mmol/L H2O2溶液混合,使其发生Fenton反应,生成·OH。取1 mL不同浓度样品溶液加入Fenton反应体系中,后加入0.1 mL 9 mmol/L水杨酸溶液,混合均匀,37 ℃水浴1 h,于510 nm处测定吸光度[22]。以维生素C作对照,按下式计算·OH清除率:
式中:A0为蒸馏水代替样品按上述步骤测定的吸光度;A1为按上述步骤测定的多糖样品的吸光度;A2为蒸馏水代替水杨酸溶液按上述步骤测定的吸光度。
1.2.4.4 对超氧阴离子清除活性的测定 取1.0 mL不同浓度样品溶液和1.0 mL 300 μmol/L NBT溶液混合,加入1.0 mL 936 μmol/L NADH溶液和1 mL 120 μmol/L PMS溶液(溶解于10 mmol/L pH7.4 磷酸缓冲液),室温放置5 min,于569 nm处测定吸光度[1]。以维生素C作对照,按下式计算超氧阴离子清除率:
式中:A0为蒸馏水代替样品按上述步骤测定的吸光度;A1为按上述步骤测定的多糖样品的吸光度。
1.3 数据处理
2 结果与分析
2.1 5种食用真菌多糖的化学组成
5种食用真菌多糖的化学组成见表1。5种食用真菌多糖经5次Sevag法脱蛋白之后均含有蛋白质,可能是由于Sevag法除去的蛋白为多糖中游离的蛋白质,一些与糖基结合的蛋白质不易被去除。某些表现出特殊生理活性的多糖中糖醛酸含量较高,而具有糖醛酸结构的多糖一般为植物多糖,所以测定本研究中5种食用真菌多糖的糖醛酸含量具有极为重要的意义[24]。通过分析得出5种食用真菌多糖中AAP的糖醛酸含量显著高于其他4种多糖(P<0.05),其次是TFP,此结果与吴小燕[25]的研究相比,糖醛酸含量较低,可能是原材料的品种和产地不同导致的。硫酸基含量指多糖糖基所带硫酸基的个数,多糖的许多生物活性功能与硫酸基含量有直接关系[26]。通过分析得出5种食用真菌多糖中PEP中的硫酸基含量显著高于其他4种多糖(P<0.05)。
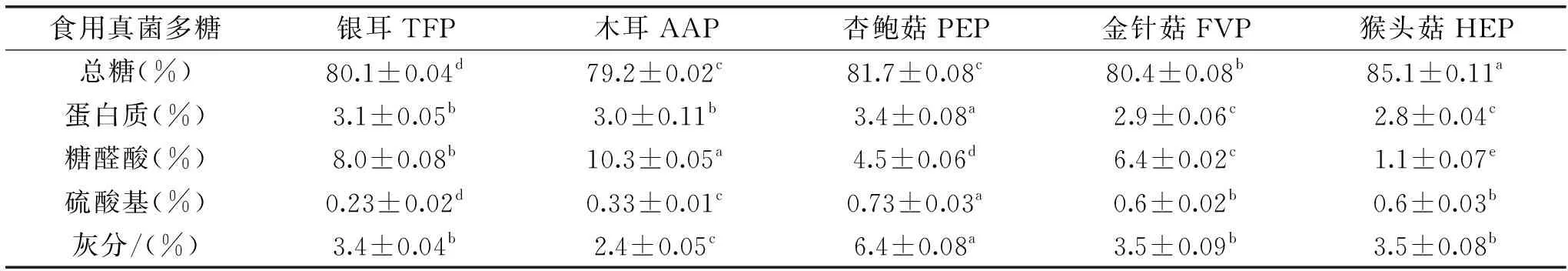
表1 5种食用真菌多糖的化学组成Table 1 Chemical composition of polysaccharides from five species of edible mushrooms

表2 5种食用真菌多糖的单糖组成Table 2 Monosaccharide composition of polysaccharides from five species of edible mushrooms
2.2 5种食用真菌多糖的单糖组成
5种食用真菌多糖的单糖组成见表2。5种食用真菌多糖均含有葡萄糖、半乳糖、甘露糖和岩藻糖。其中TFP和AAP主要以葡萄糖(28.2%、24.4%)和甘露糖(38.4%、44.4%)为主,还含有少量的木糖、鼠李糖和葡萄糖醛酸,银耳中还含有20.9%的阿拉伯糖,此结果与吴振亚和王雪[27-28]的研究结果一致。PEP、FVP和HEP主要以葡萄糖(51.5%~59.9%)和半乳糖(18.9%~28.4%)为主,还含有少量葡萄糖醛酸,PEP中含有少量的半乳糖醛酸,此结果与闫晶敏[29]的研究结果一致。
2.3 结构特征
2.3.1 傅里叶变换红外光谱分析 由图1可知,本研究5种食用真菌多糖均具有多糖的特征吸收峰:3400 cm-1附近(3406~3417 cm-1)的宽峰为分子间或者分子内O-H伸缩振动峰;2930 cm-1附近(2926~2928 cm-1)的吸收峰为C-H的伸缩振动峰;1640 cm-1(1632~1641 cm-1)和1400 cm-1(1371~1385 cm-1)附近的吸收峰分别为C=O非对称伸缩振动峰及C-H变形振动峰。1100 cm-1(1034~1078 cm-1)附近的吸收峰表明可能存在β-吡喃型糖环结构[30]。此外,TFP和AAP中还含有1250 cm-1的吸收峰,此峰源于S-O的不对称伸缩振动[31],AAP含有1732 cm-1吸收峰,此吸收峰为酯基-COOR中C=O伸缩振动引起的[28]。

图1 5种食用真菌多糖的红外光谱图Fig.1 Infrared spectra of five speciesof edible fungus polysaccharides
2.3.2 刚果红实验结果 有关多糖生物活性和结构特征的研究发现,二者关系不仅建立在多糖的一级结构上,还与多糖分子的空间构象有关[32]。因此本研究通过刚果红实验测定5种多糖是否具有三螺旋结构。具有三股螺旋结构的多糖会与刚果红染色剂形成络合物,在碱性条件下,与空白对照相比,紫外光谱最大吸收波长会发生变化。如果多糖不具有三股螺旋结构,其与刚果红染色剂形成的络合物的最大吸收波长的变化趋势会与空白对照趋势相近。如图2所示,加入0.1 mol/L NaOH溶液的HEP样品的光吸收向长波移动,表明样品可与刚果红形成络合物,具有三股螺旋结构。当加入的NaOH溶液浓度升高,分子间氢键被破坏,三股螺旋结构被破坏[33]。除HEP外,其他4种食用真菌多糖均未与刚果红形成络合物,说明除HEP外的4种多糖均不具有三股螺旋结构。

图2 刚果红-食用真菌多糖络合物紫外光谱最大吸收波长Fig.2 UV spectrum maximum absorption wavelength ofCongo red-edible fungus polysaccharides complex
2.3.3 X射线衍射结果 X射线衍射(XRD)是一种测定高分子聚合物结晶结构的重要手段,具有直接、方便的优点。如图3可知,在2θ为10 °~80 °范围内,5种食用真菌多糖的X射线曲线最高峰都出现22 °附近。经分析得出5种食用真菌多糖的结晶度从大到小分别为:HEP>TFP>AAP>FVP>PEP。白文强[34]的研究发现,经离子液体-高压微射流改性处理后的β-葡聚糖天然的三螺旋构象被破坏后,结晶度降低。因此本实验结果可能是由于HEP具有三螺旋结构,而其他4种多糖不具有三螺旋结构,导致了5种多糖的不同结晶度。

图3 5种食用真菌多糖的X射线衍射图Fig.3 X-ray diffraction spectra offive species of edible fungus polysaccharides
2.4 5种食用真菌多糖抗氧化活性的对比
2.4.1 DPPH·清除活力的测定结果 DPPH为一种暗紫色的大棱柱形晶体,在与抗氧化剂反应后,颜色会由深变浅,吸光值也会由大变小[35]。由图4可知,随着浓度的增加,5种食用真菌多糖(TFP、AAP、PEP、FVP和HEP)对DPPH·的清除率均增加,在相同浓度条件下,不同食用真菌多糖对DPPH·的清除率均显著低于维生素C(P<0.05)。同时以IC50值衡量5种食用真菌多糖的抗氧化活性强度,发现5种食用真菌多糖种AAP的DPPH·清除能力显著高于其他4种多糖(P<0.05),IC50为6.774 mg/mL。
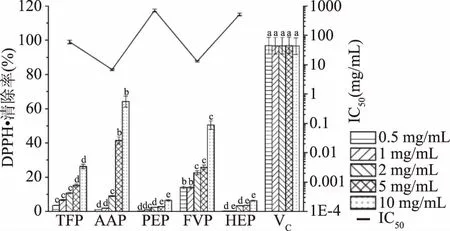
图4 5种食用真菌多糖对DPPH·的清除活力Fig.4 Scavenging ability of five species ofedible fungus polysaccharides on DPPH·注:相同浓度不同字母代表组间差异显著(P<0.05);图5~图7同。
2.4.2 ABTS+·清除活力的测定结果 ABTS+·是ABTS在过硫酸盐的条件下被氧化生成相对稳定的蓝绿色自由基。由于抗氧化剂夺取ABTS+·中的自由基从而使溶液褪色,吸光值相应值变低。由图5可知,随着浓度的增加,5种食用真菌多糖(TFP、AAP、PEP、FVP和HEP)对ABTS+·的清除率均增加,在相同浓度条件下,不同食用真菌多糖对ABTS+·的清除率均显著低于维生素C(P<0.05)。AAP的ABTS+·清除能力显著高于其他4种多糖(P<0.05),IC50为2.349 mg/mL。AAP具有较高的DPPH·清除活力和ABTS+·清除活力可能是多糖中糖醛酸含量导致,AAP的糖醛酸含量显著高于其他4种多糖(P<0.05),有研究报道,糖醛酸含量和自由基清除活力呈正相关[36]。此外,Sun等[37]的研究结果显示,糖醛酸含量越高的黑木耳子实体多糖抗清除自由基的能力越强。
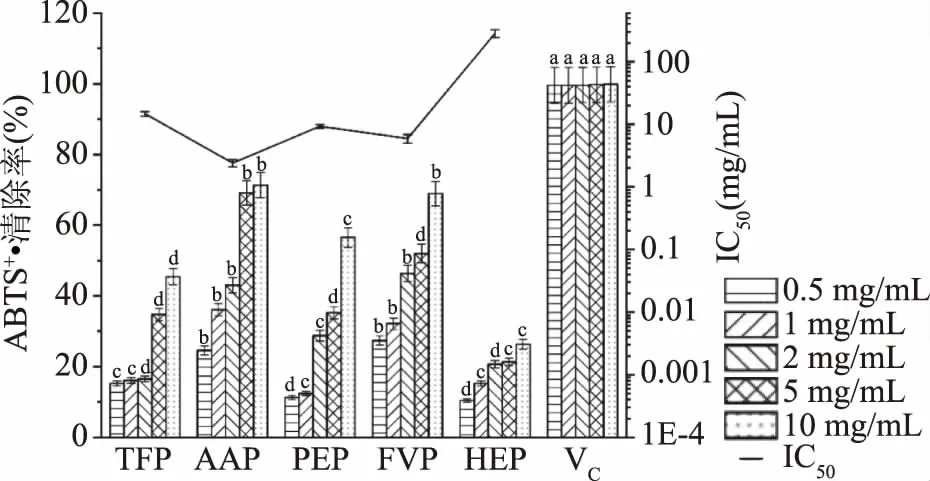
图5 5种食用真菌多糖对ABTS+·的清除率Fig.5 Scavenging ability of five species ofedible fungus polysaccharides on ABTS+·
2.4.3 ·OH清除活力的测定结果 ·OH是一种很强大的氧化剂,它几乎能与所有的生物分子(如蛋白质、脂类和碳水化合物)发生反应,产生的氧化应激可以导致多种疾病和退化[38]。由图6可知,随着浓度的增加,5种食用真菌多糖对·OH的清除率均增加,在相同浓度条件下,不同食用真菌多糖对·OH的清除率均显著低于维生素C(P<0.05)。PEP的·OH清除能力高于其他4种多糖,IC50为5.484 mg/mL。这种现象可能是由于多糖中硫酸基含量不同导致,据Guo等[39]报道,·OH清除率与样品中氨基酸基团数量有关,本文的实验结果中PEP的蛋白质含量略高于其他4种多糖,可能是因为其具有较多的氨基酸基团,进而使PEP的·OH清除活力高于其他4种多糖。
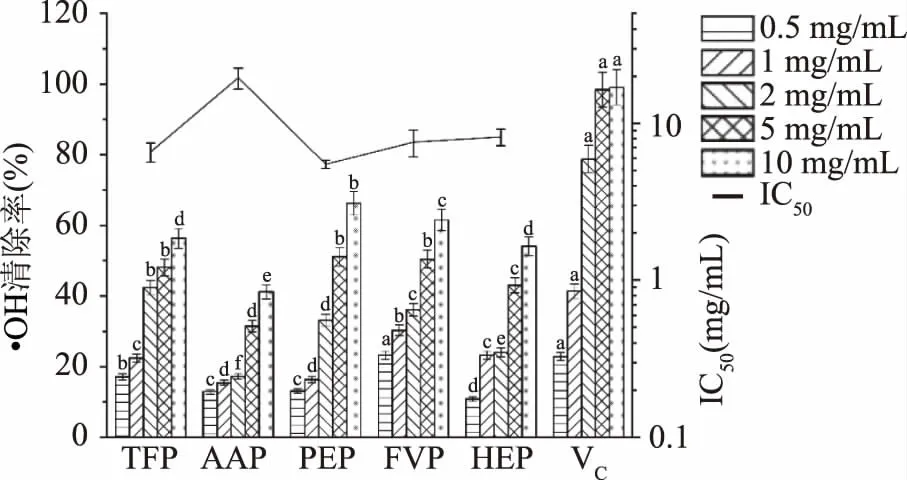
图6 5种食用真菌多糖对·OH的清除活力Fig.6 Scavenging ability of five species ofedible fungus polysaccharides on ·OH
2.4.4 超氧阴离子清除活力的测定结果 超氧阴离子是一种活性氧,是在生物体内被生产的第一个氧自由基,可以引发一系列体内自由基的产生,进而对机体产生危害[40]。由图7可知,随着浓度的增加,5种食用真菌多糖对超氧阴离子的清除率均增加,在相同浓度条件下,不同食用真菌多糖对超氧阴离子的清除率均显著低于维生素C(P<0.05)。HEP对超氧阴离子的清除活力显著强于其他4种多糖(P<0.05),IC50为3.327 mg/mL。这种现象可能是由5种多糖的空间构象不同导致的,由XRD结果和刚果红实验结果可知,HEP具有三螺旋结构且具有更好的空间构象。Zhang等[41]的研究发现,具有三股螺旋结构的香菇多糖的抗肿瘤活性明显高于单股螺旋多糖,且螺旋链一旦破坏,抗肿瘤活性会明显下降。因此多糖的三螺旋结构可能会影响多糖的生物活性,推测HEP较高的抗氧化能力可能与其具有三螺旋结构有关。

图7 5种食用真菌多糖对超氧阴离子的清除率Fig.7 Scavenging ability of five species ofedible fungus polysaccharides on superoxide anion radical
2.5 5种食用真菌多糖组分与抗氧化活性的相关性分析
多糖的生物活性受很多因素影响,包括化学成分、结构等,提取方法也会对多糖的生物活性产生影响[42]。因此将5种食用真菌多糖的化学组成及单糖组成与抗氧化活性(IC50)进行Pearson相关性分析以期探索两者之间的构效关系。
由图8可知,鼠李糖、木糖和阿拉伯糖含量对抗氧化活性均没有显著影响。对ABTS+·的IC50值影响较为显著(P<0.05)的为糖醛酸和葡萄糖醛酸含量,R2分别为-0.79和-0.82,此结果与2.4.2具有一致性,除了此之外,岩藻糖、甘露糖和半乳糖的含量也对多糖的ABTS+·清除活力有影响。大部分多糖的组成成分都对DPPH·的IC50值有显著影响(P<0.05),其中较为显著(P<0.05)的影响因素为糖醛酸和葡萄糖醛酸的含量,R2分别为-0.85和-0.84,其次为半乳糖和硫酸基的含量,且均呈正相关,R2分别为0.72和0.66。此外伯继芳等[16]的研究也发现硫酸化修饰后的杏鲍菇多糖与未修饰的杏鲍菇多糖相比,对DPPH·的清除效果相对较差,这可能是-OSO3H团未能激活异头碳上的氢原子所导致的[43]。5种多糖的蛋白质、葡萄糖和甘露糖含量对多糖的·OH清除活力有显著影响(P<0.05),其中蛋白质和葡萄糖含量与·OH的IC50值呈负相关,R2分别为-0.56和-0.52,甘露糖含量和·OH清除活力呈正相关,这与2.4.3的结果一致,Lei等[42]通过对比由一种多毛菌发酵液产生的胞内多糖和胞外多糖的·OH清除活力和单糖组成,也发现多糖的葡萄糖和甘露糖含量影响多糖的·OH清除活力。5种多糖的岩藻糖含量和多糖的超氧阴离子的IC50值呈正相关,R2为0.52。通过Pearson相关性分析分析了5种多糖的化学组成分析与抗氧化能力,发现了食用真菌多糖具有的抗氧化能力与其化学组成相关,但是是否所有食用真菌多糖的上述组成均影响其抗氧化活力,还需要大量食用真菌多糖样本进一步验证。
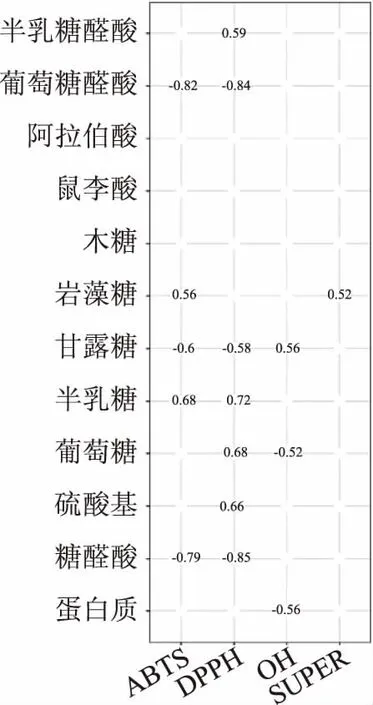
图8 5种食用真菌多糖组分与抗氧化活性的相关性分析Fig.8 Correlation of antioxidantactivities with molecular properties注:有数字标识代表抗氧化活性IC50值与组分含量显著相关(P<0.05),图中显示值代表Pearson 相关性值R2,+表示正相关,-表示负相关。
3 结论
本研究提取了5种食用真菌多糖,测定了它们的组成、结构及抗氧化活性,并对5种多糖的化学组成与其抗氧化活性进行Pearson相关性分析。结果显示,5种多糖均由大量葡萄糖、半乳糖和甘露糖组成,且AAP含有较多糖醛酸,PEP含有较多蛋白质。结构测定结果表明,5种食用真菌多糖均含有多糖特征峰,HEP具有三螺旋结构且结晶度显著高于其他4种多糖(P<0.05)。5种食用真菌多糖均具有抗氧化活性,可作为潜在的天然抗氧化剂应用于药品和食品工业中。经Pearson分析后发现多糖的各组分含量与其抗氧化活性相关,但是是否所有食用真菌多糖的组成均影响其抗氧化活力,还需要大量食用真菌多糖样本进一步验证。
