白玉龙火龙果丛芽诱导培养基中6-BA适宜浓度的筛选
2020-08-16李云海陈丽华黄升品
李云海 陈丽华 黄升品

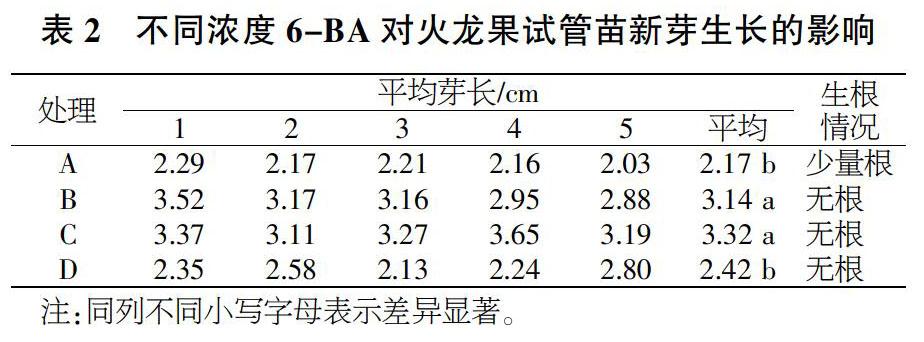
摘要 本文以白肉火龙果白玉龙的试管苗茎段为材料,设4个6-BA浓度梯度2.0、4.0、6.0、8.0 mg/L,对其丛芽诱导培养基中细胞分裂素6-BA的适宜浓度进行了筛选试验。结果表明,培养基MS+NAA 0.3 mg/L+6-BA 6.0 mg/L诱导出的新芽数量最多,平均达到了11.2芽/丛,增殖系数为11.2,新芽平均长度3.32 cm;且此时丛芽生长势也最强,没有出现生根、弱化等影响丛芽健康增殖的现象。因此,本试验最适宜的激素浓度组合是NAA 0.3 mg/L+6-BA 6.0 mg/L。
关键词 火龙果;白玉龙;组织培养;丛芽诱导;6-BA浓度
中图分类号 S667.9 文献标识码 A
文章编号 1007-5739(2020)15-0055-02 开放科学(资源服务)标识码(OSID)
火龙果(Hylocereus undatus Britt & Rose)又名红龙果、芝麻果、仙蜜果、青龙果等,为仙人掌科量天尺属果用栽培植物,原产于中美洲墨西哥等地区,属于典型的热带植物。火龙果的花和果实均可食用,是当地传统的水果和重要的经济作物[1]。火龙果营养价值极为丰富,含有丰富的蛋白质、维生素、纤维素、葡萄糖及人体所需的K、Ca、Mg、Fe、P等矿物质,且脂肪含量较低[2-3]。经常食用火龙果可促进新陈代谢、调节免疫功能等,同时火龙果具有清血、降火、降胆固醇、降血压、降血糖和血脂等效用,对高血压及糖尿病患者有较好的辅助治疗作用[4]。火龙果鲜艳美丽,果型极具观赏价值,果肉甜脆可口,深受消费者的欢迎和喜爱[5]。另外,火龙果耐干旱、耐贫瘠,抗逆性极强,能够在条件恶劣的地方生长,具有保持水土、改善生态环境等作用。火龙果自20世纪90年代初由美洲引种到我国台湾地区,随后又引种到海南、广东、广西、福建等省(区)[6]。
过去,火龙果的繁殖主要通过播种、扦插、嫁接等方式进行[7-10]。近年来,采用离体培养快速繁殖种苗的技术已在多数园艺植物上得到了广泛的应用,加之随着火龙果种植面积不断扩大,播种、扦插、嫁接等繁殖方法因速度较慢不能满足现代种植业快速发展的需求,人们开始应用植物组织培养技术来研究火龙果试管种苗的快速繁殖,对火龙果外植体的选择和处理、愈伤组织诱导和丛芽增殖、壮苗培养和试管种苗生根移栽等关键环节开展了较多的试验研究,并建立了众多火龙果品种种苗的快速繁殖技术体系[11-15]。
本试验在参考上述学者研究工作结果的基础上,以白肉火龙果白玉龙试管苗的茎段为材料,对其丛芽诱导培养及其相关激素浓度进行试验研究,以期从中筛选出适宜的丛芽诱导培养基激素组合,达到快速繁殖白玉龙火龙果优质试管种苗的目的,为白玉龙火龙果试管种苗快速繁殖技术体系的建立提供参考数据。现将试验结果总结如下,以供相关人员参考。
1 材料与方法
1.1 试验材料
本试验以白肉火龙果白玉龙的试管苗幼嫩茎段为材料。试验前,待试白玉龙火龙果试管苗经培养基MS+NAA 0.1 mg/L+6-BA 1.0 mg/L培养25 d,达到均一化。
1.2 试验设计
对火龙果丛芽诱导培养基中细胞分裂素6-BA的适宜浓度进行筛选,本试验共设计了4个处理,即在MS培养基中添加0.3 mg/L的NAA和不同浓度的6-BA形成对比试验组,6-BA浓度分别为2.0 mg/L(A)、4.0 mg/L(B)、6.0 mg/L(C)、8.0 mg/L(D)。培养基pH值调至5.8,配制完成后,于121~125 ℃高温、高压、湿热条件下灭菌25 min,取出后放置于培养室中3~5 d备用。
1.3 试验方法
试验时,选择试管苗中生长健壮、长势良好的幼嫩肉质茎段,切成3 cm左右的小段,每小段带3~4个刺座,然后均匀接种到上述4个处理的培养基中进行固态静置诱导培养。每个处理接种5瓶(重复),每瓶接种5个火龙果茎段,于组培室温度控制为23~26 ℃、光照强度1 800~2 000 lx、光照时间为每天12 h条件下,培养55 d。
1.4 调查内容与方法
对各处理试管苗丛新增芽数、平均芽长、苗壮弱、愈伤組织多少、根的生长情况等指标进行观察和测量,并对相关数据进行生物统计学分析。
2 结果与分析
2.1 不同浓度6-BA对试管苗新增芽数的影响
白玉龙火龙果试管苗茎段在4个处理的培养基中培养55 d后,各处理培养基中试管苗的新增芽数、愈伤组织多少和苗壮弱等情况如表1所示。总的趋势为,随着培养基中6-BA浓度的增加,试管苗新增芽数呈现先增加后降低的趋势;苗的壮弱程度也与新增芽数变化趋势表现一致,呈现先增加后降低的趋势。愈伤组织方面,处理A试管苗没有产生愈伤组织;处理B、C、D产生的愈伤组织则随着6-BA浓度的增加而逐渐增多。
