STC1诱导上皮-间质转化促进肺癌细胞的侵袭和迁移
2020-08-15魏丽荣滕小艳夏前林杜玉珍
魏丽荣,滕小艳,夏前林,杜玉珍,2
1.上海健康医学院附属第六人民医院东院检验科,上海 201306;2.上海市第六人民医院东院检验科,上海201306
肺癌是全球范围内发病率和死亡率最高的恶性肿瘤,导致其高病死率的主要原因是局部复发和远处转移,但目前肿瘤细胞的具体转移机制仍未完全明确[1]。肺癌等恶性肿瘤的转移与上皮-间质转化(epithelial-mesenchymal transition,EMT)的发生密切相关。斯钙素1(stanniocalcin 1,STC1)是一种激素类糖蛋白,以自分泌/旁分泌的方式产生效应。STC1的高表达与胃癌、结直肠癌、肝癌、乳腺癌等癌症的发展和不良预后相关[2-5]。在前期工作中我们发现,STC1蛋白在Ⅲ~Ⅳ期肺腺癌患者的血清和组织中显著升高,STC1过表达能够促进肺癌细胞增殖、抑制细胞凋亡;此外,我们还发现,肺癌患者组织中的STC1蛋白水平与肺癌临床分期、淋巴结转移个数呈正相关[6-7]。但STC1对肺癌细胞转移的影响及其作用机制,目前还未完全阐明。本研究通过检测STC1对肺癌细胞EMT标志物的影响,以及细胞侵袭和迁移能力的改变,探讨SCT1在肺癌细胞EMT及转移中的作用机制。
1 材料和方法
1.1 材料与试剂
TRIzol试剂和LipofectamineTM2000购自美国Invitrogen公司;pBABE-puro反转录病毒载体、pUMVC和pCMV-VSV-G包装载体购自美国Addgene公司;胰蛋白酶消化液购自美国Solarbio公司;Transwell小室购自美国Corning公司;基质胶Matrigel购自美国BD公司;反转录试剂盒和蛋白预染Marker 购自加拿大Fermentas公司;实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)引物由上海捷瑞生物工程有限公司设计合成;SYBR Green PCR试剂盒和BCA蛋白定量试剂盒购自美国Thermo公司;RIPA组织细胞快速裂解液和30%丙烯酰胺(29∶1)购自美国Solarbio公司;聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)购自美国Millipore公司;鼠抗人STC1抗体(ab239518,1∶1000)购自英国Abcam公司,鼠抗人上皮型钙黏蛋白(E-cadherin)(14472S,1∶1 000)、鼠抗人神经型钙黏蛋白(N-cadherin)(14215S,1∶1 000)、鼠抗人EpCAM(2929S,1∶1 000)、鼠抗人波形蛋白(vimentin)(49636S,1∶1 000)、兔抗人磷酸化细胞外调节蛋白激酶(phosphorylated extracellular signal-regulated protein kinase,p-ERK)1/2(4370S,1∶2 000)、鼠抗人ERK1/2(4696S,1∶2 000)、兔抗人E盒结合锌指蛋白1(zinc finger E-box-binding homeobox 1,ZEB1)(3396S,1∶1 000)、兔抗人β-连环蛋白(β-catenin)(8480T,1∶1 000)、鼠抗人锌指转录因子(Snail)(3895S,1∶1 000)和兔抗人β-actin(4970S,1∶1 000)抗体均购自美国CST公司,HRP标记羊抗鼠免疫球蛋白G(immunoglobulin G,IgG)(ab6728,1∶8 000)、HRP标记羊抗兔IgG(ab6721,1∶10 000);鼠抗E-cadherin(ab1416,1∶50)、兔抗vimentin(ab92547,1∶500)、羊抗兔IgG荧光二抗(ab150077,1∶800)和羊抗鼠IgG荧光二抗(ab150117,1∶800)均购自英国Abcam公司;4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)染料购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 细胞培养
使用实验室内已构建好的稳定过表达STC1的细胞系HLEC-STC1及其对照细胞系HLECEV,STC1沉默的A549细胞系A549-STC1 siRNA及对照细胞系A549-EV。细胞系的选择和构建过程详见本课题组前期已发表的文献[6],采用含10%胎牛血清(fetal bovine serum,FBS)的DMEM培养基,于37 ℃、CO2体积分数为5%的培养箱中培养。
1.2.2 Transwell侵袭实验
将50 mg/L的Matrigel按1∶8比例稀释,包被transwell小室底部膜的上室面37 ℃ 30 min形成凝胶,使用前加入不含血清的DMEM培养基置于37 ℃温育1 h进行基底膜水化,吸弃培养基。将细胞稀释至2×105个/mL后接种200 μL细胞悬液到transwell小室中,24孔板下室中加入750 μL含10%FBS的DMEM培养液,每组设置3个重复孔。将孔板置于37 ℃培养箱中培养48 h,小心擦净上室未侵袭细胞及Matrigel,4%甲醛溶液固定,0.5%结晶紫染色后,于显微镜下随机选取3个不同的视野进行细胞计数,取平均值,以侵袭细胞数量反映侵袭能力。
1.2.3 细胞划痕实验
取对数生长期的细胞,以105个/mL的密度接种到6孔板中,待细胞覆盖率达到90%时,用移液器吸嘴均匀划痕,磷酸盐缓冲液(phosphatebuffered saline,PBS)冲洗划下的细胞后继续培养,在0、24、48 h观察并拍照记录。使用Image J软件测量细胞划痕面积,划痕愈合率=[1-(各时间点划痕面积/起始划痕面积)]×100%。愈合率越高表明细胞迁移能力越强。
1.2.4 RTFQ-PCR检测mRNA水平
TRIzol试剂提取细胞总RNA,根据反转录试剂盒说明书合成cDNA;以β-actin为内参基因,使用SYBR Green PCR试剂盒在ABI7500上进行RTFQ-PCR,扩增程序:95 ℃ 10 min,(95 ℃15 s,60 ℃ 45 s)×40,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。ZEB1上游引物序列:5’-GCTGTAAGTGCCATTTCTC-3’,ZEB1下游引物序列:5’-GTCCCAGTGTTTCAGTTTC-3’,产物长度159bp;E-cadherin上游引物序列:5’-GAGAACGCATTGCCACATACAC-3’,E-cadherin下游引物序列:5’-AAGAGCACCTTCCATGACAGAC-3’,产物长度164bp;N-cadherin上游引物序列:5’-CATCATCCTGCTTATCCTTG-3’,N-cadherin下游引物序列:5’-AAGTCATAGTCCTGGTCTTC-3’,产物长度165bp;Vimentin上游引物序列:5’-GCGTGAAATGGAAGAGAAC-3’,vimentin下游引物序列:5’-TGGAAGAGGCAGAGAAATC-3’,产物长度217bp;EpCAM上游引物序列:5’-GAAGGCTGAGATAAAGGAGATGGG-3’,EpCAM下游引物序列:5’-AGATGTCTTCGTCCCACGC-3’,产物长度135bp;Snail1上游引物序列:5’-TCGCTGCCAATGCTCATC-3’,Snail1下游引物序列:5’-CCTTTCCCACTGTCCTCATC-3’,产物长度134bp;β-actin上游引物序列:5’-CATCGTCCACCGCAAATGCTTC-3’,β-actin下游引物序列:5’-AACCGACTGCTGTCACCTTCAC-3’,产物长度201bp。
1.2.5 蛋白质印迹法(Western blot)检测蛋白表达水平
收集细胞,PBS洗涤后加入RIPA裂解液裂解细胞,BCA蛋白定量试剂盒检测蛋白浓度,取约25 μg蛋白加入上样缓冲液,煮沸5 min变性,经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)后,转膜至PVDF膜上。将膜浸泡在5%的脱脂奶粉中封闭1 h后,一抗4 ℃温育过夜。使用洗膜缓冲液(tris-buffered saline Tween,TBST)洗膜3次,加入HRP标记的二抗于37 ℃温育1 h后,再次用TBST洗膜3次,加入配制好的电化学发光(electrochemical luminescence,ECL)底物工作液后置于成像系统中采集信号图像,使用Image J软件进行分析。
1.2.6 细胞免疫荧光实验
细胞爬片用4%甲醛溶液固定30 min;PBS冲洗后滴加一抗,湿盒中4 ℃温育过夜;PBS冲洗后,加入荧光二抗湿盒室温温育1 h;防淬灭封片剂与DAPI 1∶500稀释封片后,使用荧光显微镜拍照分析。
1.3 统计学处理
2 结果
2.1 HLEC-STC1细胞系和A549-STC1 siRNA细胞系中STC1过表达和沉默效率验证
Western blot结果见图1,使用Image J软件分析,结果显示,HLEC-STC1中STC1水平显著高于其对照细胞系HLEC-EV和HLEC细胞,HLEC-STC1中STC1水平约为HLEC-EV的4.01倍(P<0.05)。沉默的A549细胞系A549-STC1 siRNA中STC1水平显著低于对照细胞系A549-EV和A549细胞,较A549-EV下降约56.3%(P<0.05)。
2.2 STC1促进肺癌细胞的侵袭和迁移
Transwell侵袭实验结果见图2,STC1过表达的HLEC-STC1细胞侵袭数量较空载体对照细胞HLEC-EV明显增加(473±17vs646±12,P<0.05),STC1沉默的A549-STC1 siRNA细胞侵袭较空载体对照细胞A549-EV明显减少(702±11vs502±18,P<0.05)。细胞划痕实验结果见图3,HLEC-STC1细胞划痕愈合率显著高于空载体对照细胞HLEC-EV[(38.4±1.9)%vs(18.4±6.8)%,P<0.05],A549-STC1 siRNA细胞划痕愈合率显著低于空载体对照细胞A549-EV[(7.8±4.2)%vs(41.4±4.7)%,P<0.05]。
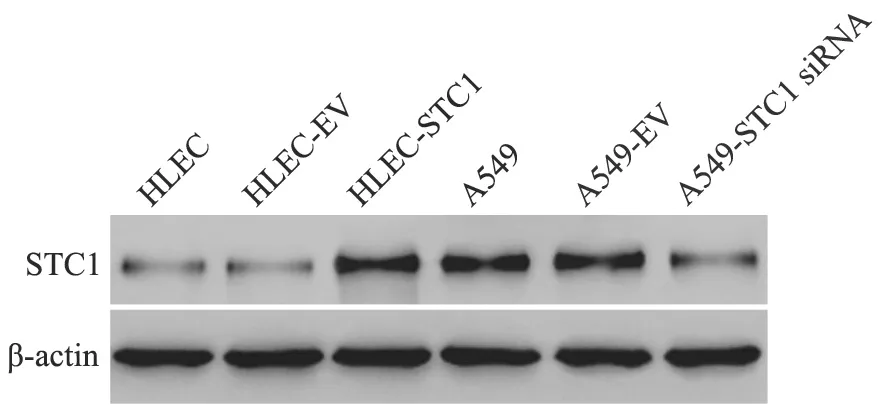
图1 Western blot实验检测HLEC、HLEC-EV、HLEC-STC1、A549、A549-EV和A549-STC1 siRNA细胞系中STC1蛋白表达水平Fig.1 Protein levels of STC1 in HLEC,HLEC-EV,HLEC-STC1,A549,A549-EV and A549-STC1 siRNA cell lines were examined by Western blot analysis
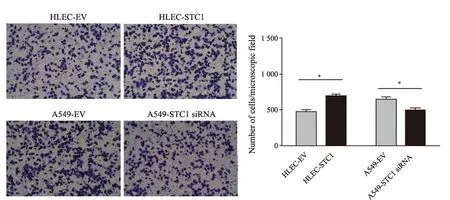
图2 Transwell实验检测HLEC-STC1和A549-STC1siRNA细胞系的侵袭能力Fig.2 STC1-overexpressed HLEC cells,STC1-silenced A549 cells and their respective control cells were examined by transwell invasion assay

图3 细胞划痕实验检测HLEC-STC1和A549-STC1siRNA细胞系的迁移能力Fig.3 The migration potentials of STC1-overexpressed HLEC cells,STC1-silenced A549 cells and their respective control cells were examined by wound healing assay
2.3 STC1促进肺癌细胞发生EMT
RTFQ-PCR检测结果见图4A,与空载体对照细胞相比,过表达STC1的HLEC-STC1细胞中上皮样细胞标志物E-cadherin表达水平下调,间质样细胞标志物N-cadherin和vimentin表达上调,EpCAM表达下调;STC1细胞沉默的A549-STC1 siRNA细胞中E-cadherin表达水平上调,N-cadherin、vimentin及EpCAM表达水平下调。Western blot结果见图4B,EMT相关基因的蛋白水平变化与RTFQ-PCR检测结果变化一致。进一步使用细胞免疫荧光技术检测A549-STC1 siRNA细胞及其对照细胞中EMT相关蛋白的变化,STC1沉默的肺癌细胞A549-STC1 siRNA中,E-cadherin含量升高,vimentin含量下降(图5),表明SCT1沉默抑制EMT过程。

图4 HLEC-STC1和A549-STC1 siRNA细胞及其对照细胞中EMT相关基因转录水平和蛋白水平的变化Fig.4 Relative expressions of EMT-related genes in STC1-overexpressed HLEC cells,STC1-silenced A549 cells and their respective control cells

图5 细胞免疫荧光检测A549-STC1siRNA细胞系及其对照细胞系中E-cadherin和vimentin的蛋白水平,使用DAPI进行核染Fig.5 E-cadherin and vimentin levels in STC1-silenced A549 cells and control A549 cells were analyzed by confocal microscopy,nuclei were stained with DAPI
2.4 STC1影响EMT相关信号转导通路和转录因子
RTFQ-PCR检测结果见图6A,HLEC-STC1中EMT相关转录因子Snail1和ZEB1的表达水平上调,A549-STC1 siRNA中Snail1和ZEB1的表达水平下调。Western blot结果见图6B,HLECSTC1细胞相较于HLEC-EV对照细胞,p-ERK1/2和β-catenin水平升高,同时EMT相关转录因子Snail1和ZEB1的表达水平也明显升高,而A549-STC1 siRNA中p-ERK1/2、β-catenin、Snail1和ZEB1的表达水平则明显下降。
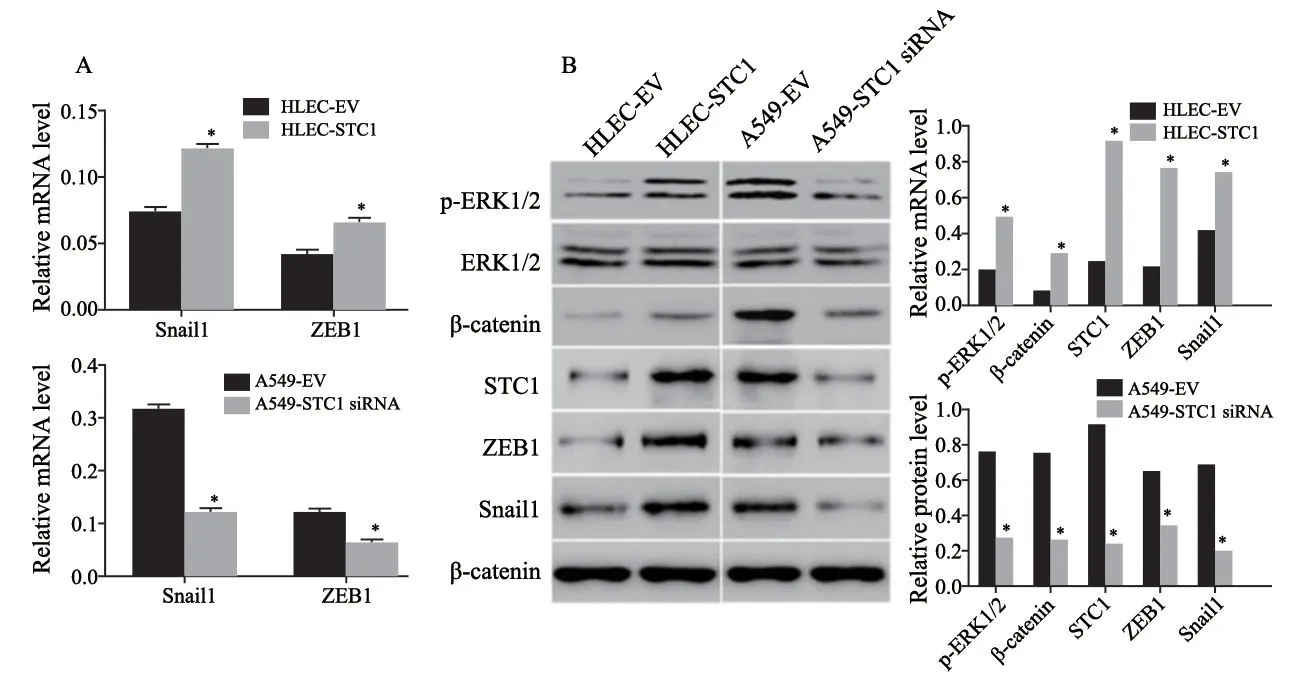
图6 RTFQ-PCR及Western blot检测HLEC-STC1和A549-STC1 siRNA细胞系及其对照细胞系中p-ERK1/2、ERK1/2、β-catenin、ZEB1、Snail1及STC1的表达水平Fig.6 The mRNA and protein levels of p-ERK1/2,ERK1/2,β-catenin,ZEB1,Snail1 and STC1 were examined by RTFQ-PCR and Western blot in STC1-overexpressed HLEC cells,STC1-silenced A549 cells and their respective control cells
3 讨 论
转移是肺癌相关死亡的主要原因,EMT被认为在肿瘤转移中起关键作用[8-9]。肿瘤细胞的EMT信号激活可增强细胞侵袭、迁移和抗凋亡能力,改变肿瘤微环境,促进其转移至其他器官[10-11]。在EMT过程中,细胞中EMT相关的上皮标志物E-cadherin等表达水平降低,而间质标志物如N-cadherin和vimentin的表达水平上调,导致上皮细胞逐渐失去极性,细胞间的黏附连接被破坏,最终转化为具有间充质表型的细胞[12]。细胞发生EMT需要外源性或内源性的诱因,外源性的诱因包括吸烟、乏氧诱导因子(hypoxia-inducible factor,HIF)、转化生长因子β(transforming growth factor-beta,TGF-β)等,内源性的诱因包括某些基因突变或过表达[13]。
STC1是一种旁分泌蛋白,其在癌组织中的表达高于癌旁组织,与肿瘤的生长和癌症转移有关[14-15]。本研究发现,STC1可促进肺癌细胞的侵袭和迁移;同时,STC1可抑制肺癌细胞E-cadherin等上皮标志物的表达,提高N-cadherin、vimentin等间质标志物的表达水平,提示STC1可以促进肺癌细胞发生EMT;此外,STC1还能够促进肿瘤干细胞标志物EpCAM地表达,已有研究[16-17]报道,肿瘤中EpCAM表达与vimentin和N-cadherin的表达呈正相关,还可通过破坏E-cadherin介导的细胞间黏附性下降,诱发EMT。因此,我们推测STC1可能是EMT的一种诱因,通过诱导EMT而促进肺癌细胞发生侵袭和迁移。
对于STC1如何作用于肺癌细胞诱导发生EMT,其内在机制目前尚未完全阐明。EMT是一个涉及许多信号通路和多种转录因子的动态复杂的过程[18-19]。本研究发现,STC1能够提高肺癌细胞中p-ERK1/2、β-catenin水平,促进EMT相关转录因子Snail1和ZEB1蛋白水平的升高;STC1水平的下调则抑制p-ERK1/2、β-catenin水平,并且Snail1和ZEB1蛋白水平下调。有研究[20]发现,肺癌骨转移过程中,Wnt/β-catenin信号通路激活,上调Snail1和ZEB1,下调E-cadherin,诱导EMT的发生。Chiu等[21]等研究发现,肺癌细胞A549中p-ERK1/2水平升高可上调ZEB1,而ZEB1又下调E-cadherin并上调纤连蛋白,诱导EMT的发生。据此,我们猜测STC1能够激活肺癌细胞的ERK和Wnt/β-catenin信号通路,上调转录因子Snail1和ZEB1的表达,而转录因子Snail1和ZEB1作为E-cadherin的重要阻遏蛋白直接抑制E-cadherin基因的表达,诱导vimentin基因的表达,从而促进EMT的发生。
综上,本研究初步阐明了STC1促进肺癌细胞EMT的分子机制。STC1可能通过激活ERK和Wnt/β-catenin信号通路,上调转录因子ZEB1和Snail1的表达水平,从而诱导EMT促进肺癌细胞的侵袭和迁移。
