一氧化氮合成酶抑制剂对宰后成熟过程中牦牛肉品质的影响
2020-08-15李雪茹师希雄王建忠张攀高田铸韩玲
李雪茹,师希雄,王建忠,张攀高,田铸,韩玲
一氧化氮合成酶抑制剂对宰后成熟过程中牦牛肉品质的影响
李雪茹,师希雄,王建忠,张攀高,田铸,韩玲
(甘肃农业大学食品科学与工程学院,兰州 730070)
【目的】研究一氧化氮对宰后牦牛肉品质的影响,为牦牛肉品质改善提供理论依据。【方法】以3—5岁去势甘南牦牛肉为材料,取其背最长肌,剔除筋膜、脂肪等,切成大小均匀的薄片(8 cm×8 cm),用20 G针均匀穿刺,分别采用去离子水(对照组)和1、10、100 mmol·L-1一氧化氮合成酶(NOS)抑制剂(N-硝基-L-精氨酸甲酯盐酸盐)在4℃条件下1﹕1(V/m)浸泡肉样1 d,然后在4℃条件下成熟,测定成熟期间(0、1、3、5和7 d)NOS活性与一氧化氮含量、肌原纤维小片化指数(MFI)、总巯基含量、羰基含量、pH、色度等指标。【结果】NOS抑制剂处理后的牦牛背最长肌NOS活性和一氧化氮含量显著降低,成熟第7天时,处理组的NOS活性分别比对照组低30.9%、43.6%、74.7%,一氧化氮含量分别比对照组低4.7%、12.5%、21.5%。处理后的牦牛肉pH显著降低,第7天时,处理组分别比对照组低0.8%、5.7%、15.2%,其中10和100 mmol·L-1NOS抑制剂处理组显著低于对照组。处理显著降低了牦牛肉羰基含量,成熟第7天时,处理组分别比对照组低4.1%、19.0%、22.2%。此外,处理组MFI显著上升,成熟第7天时,处理组分别比对照组低31.1%、23.3%、9.6%。处理组牦牛肉总巯基含量显著上升,第7天时,对照组比NOS抑制剂处理组分别低3.2%、3.7%、2.7%。成熟过程中,NOS抑制剂处理使肉色*值显著降低,肉色*值显著升高,第7天时,处理组的肉色*值分别比对照组低7.1%、40.2%、30.7%,肉色*值分别比对照组高1.1%、2.0%、1.1%。【结论】一氧化氮促进宰后牦牛肉蛋白质氧化,抑制牦牛肉嫩化,使肉色*值降低,*值升高,对宰后牦牛肉的品质产生负面影响,而NOS抑制剂能降低肌肉中NOS活性。
牦牛肉;宰后成熟;一氧化氮;一氧化氮抑制剂;肉品质
0 引言
【研究意义】牦牛原产亚洲中部山地,主要分布于青海、西藏、四川、甘肃等海拔3 000 m以上的高寒地区[1]。甘肃省有着丰富的草地资源,拥有牦牛100多万头,其中,甘南州约有牦牛80万头,占甘肃省牦牛总数的80%,占世界牦牛总数的5%[2]。甘南牦牛肉具有营养丰富,肉质鲜美、低脂、高蛋白、矿物质含量丰富的特点,是消费者青睐的天然绿色食品,具有良好的加工特性,是一种优质的肉类资源[3],但是其肌纤维较粗,嫩度较低,口感较差[4]。因此,改善肉品质是牦牛产业亟待解决的问题。【前人研究进展】宰后成熟是改善肉品质的重要方法,然而,肉的宰后成熟机理尚未明确,宰后成熟过程中活性氮类物质会大量聚集于肌肉细胞中,包括由一氧化氮合成酶催化精氨酸向瓜氨酸代谢产生的一氧化氮(NO),NO在调节肌肉收缩、能量代谢和蛋白降解中发挥着重要作用[5-6]。目前认为钙蛋白酶系统是宰后成熟过程中蛋白质降解起关键作用的酶系统[7]。由于钙蛋白酶是半胱氨酸酶,其大亚基活性位点易受到NO攻击而失活,从而影响肉品质[8]。细胞内的一氧化氮合成酶(NOS)浓度和活性因肌肉类型[9]和动物种类[10]而异,宰前注射NOS抑制剂能够显著提高羊背最长肌的嫩度,但其滴水损失和肉色不受影响[11]。ZHANG等[12]发现宰后鸡肉NOS抑制剂组比对照组和NO增强剂组显示出更高的*值和更低的*值。李玉品[13]发现NO促进剂可使猪背最长肌的羰基含量上升,游离巯基含量下降,说明NO促进剂加快了蛋白质的氧化。内源性NO参与减少蛋白质的降解和增加蛋白质的合成并诱导骨骼肌纤维肥大,对肉嫩化有抑制作用[14]。COTTRELL等[15]用NOS抑制剂和NO增强剂对宰后牛背最长肌处理,发现NO增强剂组肌原纤维小片化指数(MFI)显著低于对照组和NOS抑制剂组。另外,研究发现向肌细胞培养基中添加L-NAME因子能够增强蛋白水解作用[16]。同时,也有报道表明,NO释放剂可显著提高牛肉的嫩度,NOS抑制剂降低牛肉嫩度[17]。【本研究切入点】目前,已有关于NO对宰后鸡肉、牛羊肉品质影响的报道,但是,研究结论不一致,而且,NO如何影响宰后牦牛肉品质还有待研究。【拟解决的关键问题】试验以甘南牦牛背最长肌为试验材料,NOS抑制剂处理后,测定牦牛肉宰后成熟期间NOS活性与NO含量,并分析MFI、巯基含量、羰基含量以及pH、色度等指标的变化,研究NOS抑制剂对宰后牦牛肉品质的影响,为宰后牦牛肉品质改善提供理论依据。
1 材料与方法
试验于2018年10月至2019年4月在甘肃农业大学食品营养研究实验室进行。
1.1 材料
1.1.1 试验材料 本研究试验材料于2018年10月采自甘肃安多清真绿色食品有限公司,生理成熟度相似的3—5岁去势甘南牦牛,参考国内外对动物福利的相关要求,屠宰方式严格按照GB/T 19477—2018《畜禽屠宰操作规程牛》进行操作,宰前保证牦牛的健康状况良好,宰后热应激波动幅度较小,跟腱吊挂,从胴体上取下整条背最长肌作为试验材料。
1.1.2 试剂与仪器 L-NAME(美国Sigma公司)、盐酸胍(天津市科密欧化学试剂有限公司)、DNPH(天津市光复精细化工研究所)、DTNB(北京拜尔迪生物公司)、NOS检测试剂盒(南京建成生物工程研究所)、NO检测试剂盒(南京建成生物工程研究所)等。
XHF-D高速分散器(宁波新芝生物科技股份有限公司)、TGL-16M高速台式冷冻离心机(长沙湘怡离心机仪器有限公司)、T6新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司)、XMTD-8222电热恒温鼓风干燥箱(上海精宏实验设备有限公司)、PHB-4型便携式酸度计(南京科环分析仪器有限公司)、KQ-500E型超声清洗器(昆山市超声仪器有限公司)、HHS型电热恒温水浴锅(上海博迅实业有限公司医疗设备厂)。
1.2 试验方法
1.2.1 样品处理 甘南牦牛背最长肌,剔去筋膜、脂肪等,切成大小均匀的薄片(8 cm×8 cm),均匀地用20 G针穿刺,分别用去离子水和1、10和100 mmol∙L-1的NOS抑制剂溶液与肉样进行1﹕1(v/m)浸泡,在4℃下浸泡1 d后,用滤纸轻轻按压吸干肉块表面水分后于4℃成熟,在不同成熟时间点(0、1、3、5和7 d)分别取样,现场测定其pH和色度变化,其余样品置于-80℃条件下储存,用于测定NO含量、NOS活性、MFI、巯基含量、羰基含量。
1.2.2 NOS活性及一氧化氮含量测定 按照NOS及NO试剂盒使用说明进行测定。
1.2.3 pH测定 用便携式pH计对对照组和不同浓度NOS抑制剂溶液处理的牦牛肉进行测定。将探头插入到肉样中,使pH计电极与肉样组织充分接触,待pH计读数稳定后记录。每份肉样平行测定3次,取平均值作为该肉样的pH[18]。
1.2.4 色度测定 采用CR-10色差仪进行测定。用蒸馏水冲洗肉样上的血渍并用干净滤纸吸干表面残留水分进行*值、*值、*值测定,每块肉样选取3处测定,取平均值[19]。
1.2.5 肌原纤维小片化指数的测定 取2 g肉样,加入20 mL的MFI缓冲液(100 mmol∙L-1的KCl、20 mmol∙L-1Na3PO4、1 mmol∙L-1EDTA、1 mmol∙L-1MgCl2、1 mmol∙L-1NaN3,pH 7.1),将肉样冰浴匀浆。得到肌原纤维蛋白悬浊液,1 000×离心15 min,弃去上清液,再次加入20 mL缓冲液使沉淀重新处于悬浊态,1 000×离心15 min,弃去上清液。再用10 mL缓冲液使沉淀重新处于悬浊态,将悬浊液通过200目尼龙筛网过滤,取10 mL缓冲液帮助过滤,用双缩脲法测定所得悬浊液中蛋白含量。用缓冲液调节悬浮液中蛋白浓度为0.5 mg∙mL-1,再用分光光度计测定(540 nm处)吸光值,将所得结果(吸光值)乘以200即为MFI[20]。
1.2.6 羰基含量测定 参考李银等[21]和Oliver等[22]的方法,略作修改。
称取1 g肉样,加10倍体积(v/w)标准盐溶液(20 mmol∙L-1磷酸钾缓冲液、0.1 mol∙L-1KCl、2 mmol∙L-1MgCl2、2 mmol∙L-1EGTA,pH 6.8),13 000 r/min匀浆10 s,4℃离心10 min(1 000×),弃上清,沉淀用8倍体积(v/w)标准盐溶液溶解后,4℃离心10 min(1 000×)弃上清,重复两次。沉淀用8倍体积(v/w)含1% Triton X-100的标准盐溶液(20 mmol∙L-1磷酸钾缓冲液、0.1 mol∙L-1KCl、2 mmol∙L-1MgCl2、2 mmol∙L-1EGTA、1% Triton X-100,pH 6.8)溶解,4℃离心10 min(1 000×)弃上清,重复两次。沉淀用8倍体积(v/w)100 mmol∙L-KCl溶液溶解,4℃离心10 min(1 000×)弃上清,重复两次。沉淀中加4 mL 100 mmol∙L-1KCl溶液溶解,用双缩脲法测定蛋白含量,用牛血清白蛋白做标准曲线。
(2)羰基含量测定
①用100 mmol∙L-1KCl溶液将肌原纤维蛋白浓度调整为5 mg∙mL-1,分别取0.5 mL肌原纤维蛋白溶液分装至2个10 mL塑料离心管,其中一份加2 mL 2 mol∙L-1HCl溶液(对照),另一份加2 mL含0.2%DNPH的2 mol∙L-1HCl溶液,室温下避光反应1 h(每10 min旋涡振荡一次)。
②分别添加2 mL 20%三氯乙酸沉淀蛋白,10 000 r/min离心5 min,弃上清液。
③沉淀用2 mL乙酸乙酯﹕乙醇(1﹕1)清洗,重复3次。
④待沉淀中试剂挥发完后,分别加3 mL 6 mol∙L-1盐酸胍(含20 mmol∙L-1磷酸钾,pH 6.5)溶液后置于37℃条件下水浴保温30 min溶解沉淀,再将反应液10 000 r/min离心5 min除去不溶物质,在370 nm处测定上清液吸光度,比色皿厚度1 cm。使用分子吸光系数22 000 M-1·cm-1计算羰基含量。
1.2.7 巯基含量的测定 按照LIU等[23]的方法进行测定。
1.3 数据处理
所有试验均重复3次,所有数据均采用Microsoft Office Excel 2013进行处理,计算平均值和标准误(±SE)并作图,并用SPSS 22.0进行Duncan’s多重差异显著性分析(<0.05)。
2 结果
2.1 宰后牦牛肉NOS及NO含量变化
2.1.1 NOS含量变化 由图1可以看出,宰后牦牛肉成熟过程中,对照组与处理组的NOS活性均逐渐下降,但处理组的NOS活性显著低于对照组,第7天时,各NOS抑制剂处理组分别比对照组低30.9%、43.6%、74.7%(<0.05)。可见,采用NOS抑制剂对宰后牦牛肉进行处理后,降低了NOS活性。
2.1.2 NO含量变化 宰后牦牛肉成熟过程中,对照组和处理组的一氧化氮含量均逐渐下降,且处理组的一氧化氮含量均显著低于对照组。宰后当天,各处理组分别比对照组低19.8%、41.35%、44.2%(<0.05),第7天时,各处理组分别比对照组低4.7%、12.5%、21.5%(<0.05)。可见,NOS抑制剂降低了宰后牦牛肉的NO含量(图2)。
2.2 NOS抑制剂处理对宰后牦牛肉pH的影响
由图3可见,宰后牦牛肉成熟过程中,对照组与处理组的pH基本呈现先下降后上升趋势,且处理组的pH低于对照组。第3天时,各处理组pH分别比对照组低4.2%、9.1%、10.9%(<0.05);第7天时,各处理组分别比对照组低0.8%、5.7%、15.2%,其中,1 mmol∙L-1NOS抑制剂处理组与对照组相比无显著差异,10及100 mmol∙L-1NOS抑制剂处理组与对照组相比差异显著(<0.05)。可见,NOS抑制剂能显著降低宰后牦牛肉的pH。
2.3 NOS抑制剂处理对宰后牦牛肉色度的影响
由表1可知,宰后牦牛肉成熟过程中,NOS抑制剂处理组和对照组牦牛肉的*值均先上升后下降。第1天时,各处理组均显著高于对照组,分别比对照组高3.9%、6.4%、8.3%(<0.05);第7天时,分别比对照组高1.1%、2.0%、1.1%(<0.05)。处理组和对照组牦牛肉的*值均逐渐下降,且各处理组显著低于对照组(<0.05),第7天时,分别比对照组低7.1%、40.2%、30.7%。处理组和对照组牦牛肉的*值呈显著上升趋势(<0.05),第7天时,各处理组与对照组相比差异不显著(>0.05)。总之,采用NOS抑制剂对宰后牦牛肉进行处理后,*值显著升高,*值显著下降,*值无显著性变化。
2.4 NOS抑制剂处理对宰后牦牛肉MFI的影响
宰后牦牛肉成熟过程中对照组与NOS抑制剂处理组MFI均呈现显著上升趋势,且各NOS抑制剂处理组显著高于对照组,第7天时,各处理组分别比对照组高31.1%、23.3%、9.6%(<0.05)(图4)。结果表明,采用NOS抑制剂对宰后牦牛肉进行处理,促进了肌原纤维蛋白的降解。

不同大写字母表示同一处理组在不同成熟时间差异显著(P<0.05),不同小写字母表示在同一时间不同处理组之间差异显著(P<0.05)。下同
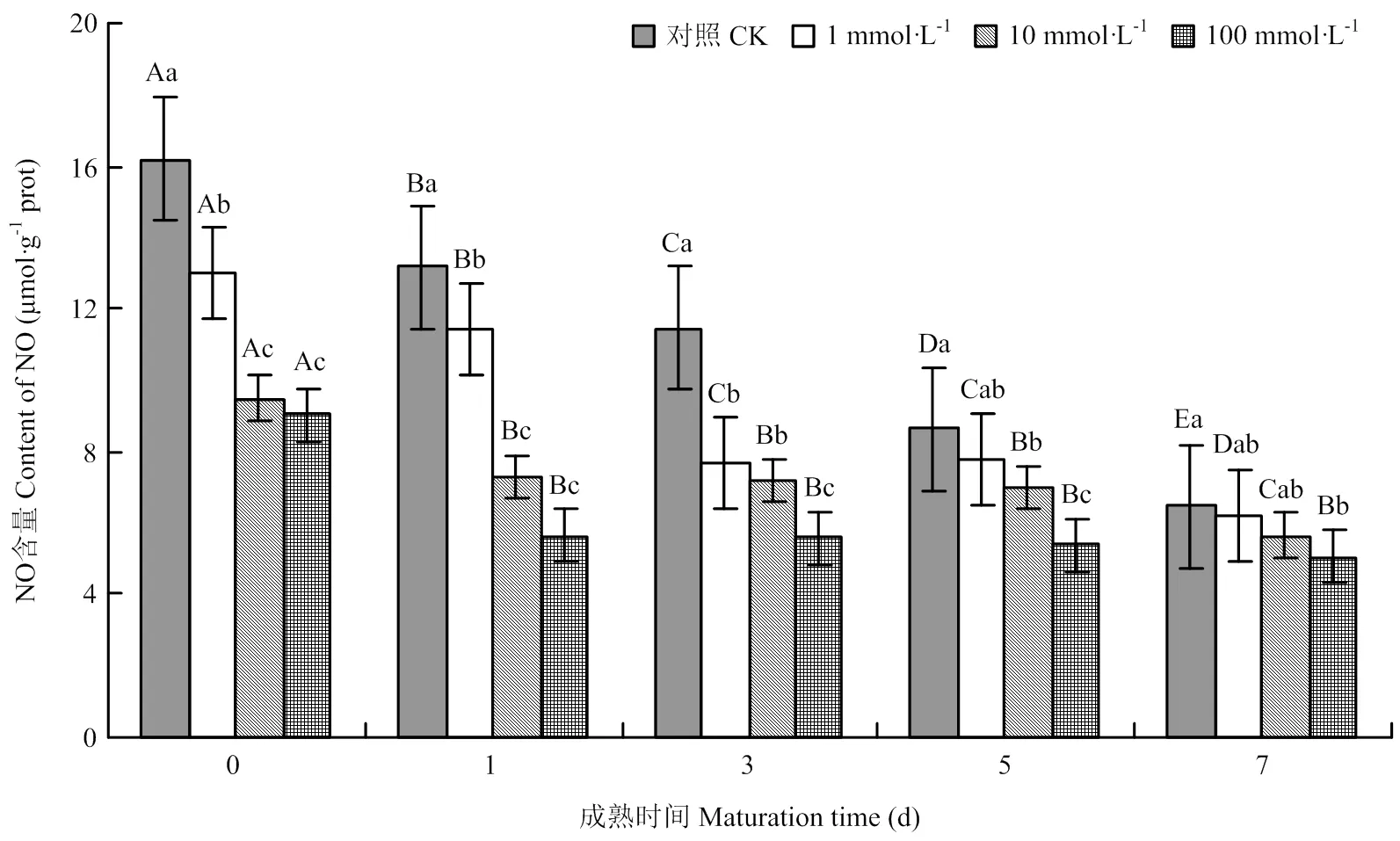
图2 不同浓度NOS抑制剂处理对牦牛肉中NO含量的影响

图3 不同浓度NOS抑制剂处理对牦牛肉pH的影响
2.5 NOS抑制剂处理对宰后牦牛肉羰基含量的影响
由图5可以看出,宰后牦牛肉成熟过程中,NOS抑制剂处理组与对照组羰基含量均呈显著性上升趋势(<0.05),且NOS抑制剂处理组显著低于对照组(0 d时各组均无显著性差异),第7天时,各处理组分别比对照组低4.1%、19.0%、22.2%(<0.05)。结果表明,宰后牦牛肉成熟过程中NOS抑制剂可以抑制蛋白质氧化,导致羰基含量下降。
2.6 NOS抑制剂处理对宰后牦牛肉总巯基含量的影响
由图6可见,宰后牦牛肉成熟过程中,对照组与各NOS抑制剂处理组的总巯基含量呈显著下降趋势(<0.05),且对照组显著低于NOS抑制剂处理组,第7天时,对照组比各NOS抑制剂处理组分别低3.2%、3.7%、2.7%(<0.05)。由此可见NOS抑制剂能抑制NO对细胞内的巯基进行修饰,导致总巯基含量的增加。

表1 不同浓度NOS抑制剂处理对牦牛肉色度的影响
不同大写字母表示同一处理组在不同成熟时间差异显著(<0.05),不同小写字母表示在同一时间不同处理组之间差异显著(<0.05)。下同
Different uppercase letters indicate significant differences at different maturation times of the same treatment group (<0.05), while different lowercase letters indicate significant differences between different treatment groups at the same time (<0.05). The same as below
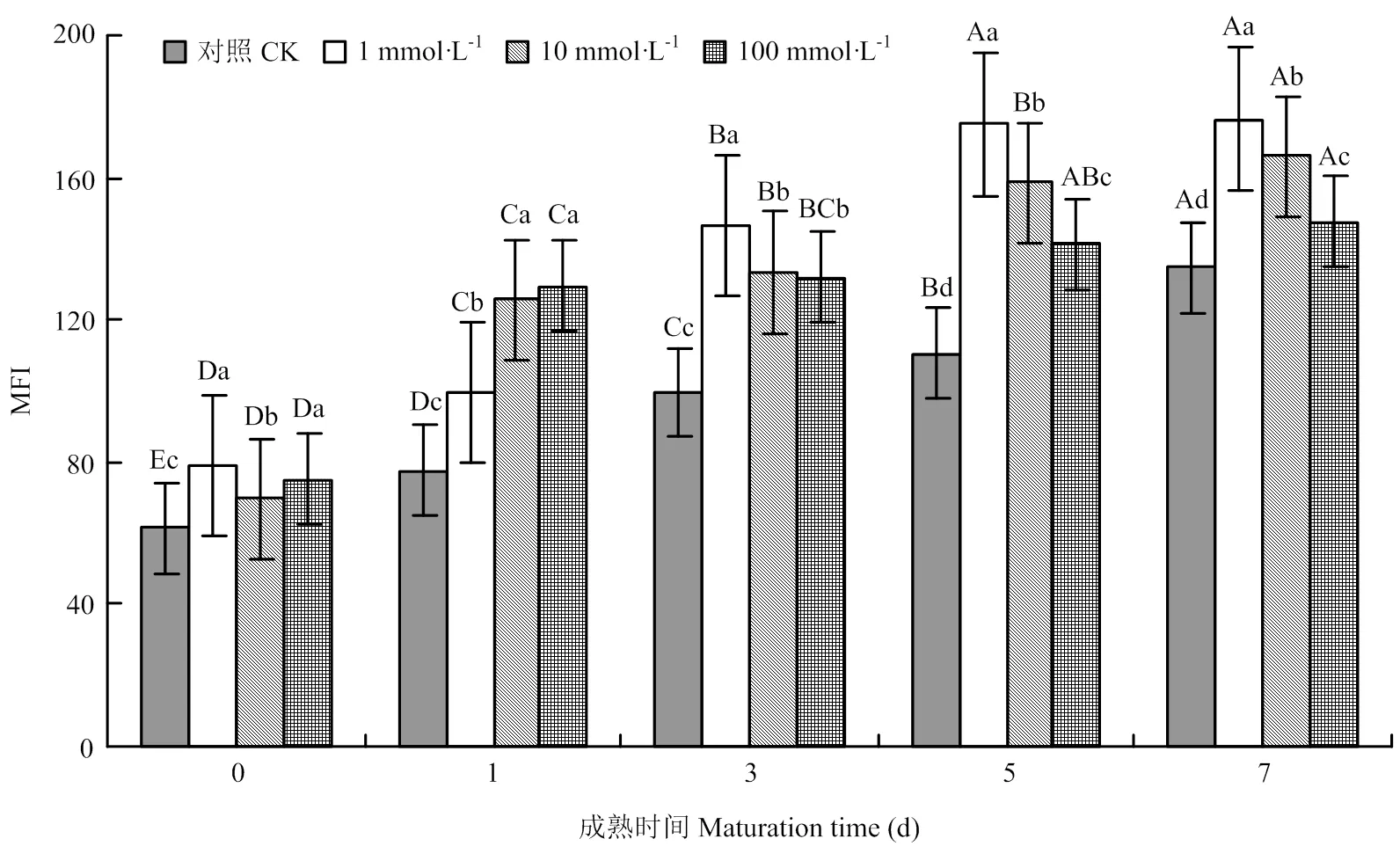
图4 不同浓度NOS抑制剂处理对牦牛肉MFI的影响
3 讨论
肌肉细胞中NOS催化精氨酸向瓜氨酸代谢产生一氧化氮,而动物宰后肌细胞在缺血缺氧环境下会激活NOS产生一氧化氮,这可以保护细胞免受不利环境影响[5-6,24]。本试验采用NOS抑制剂对宰后牦牛肉进行处理,显著降低了宰后牦牛肉NOS活性和NO的表达量。这与Cottrell等[25]研究发现宰前注射NOS抑制剂,宰后羊羔肉成熟过程中的NO表达量减少相一致。

图5 不同浓度NOS抑制剂处理对牦牛肉羰基含量的影响

图6 不同浓度NOS抑制剂处理对牦牛肉总巯基含量的影响
动物宰后肌细胞中形成缺血缺氧环境,肌糖原由原来的有氧分解转化为无氧酵解,产生大量乳酸,并且ATP分解产生磷酸根等离子,导致pH下降[26],而宰后pH的下降速率和极限pH对肉品质如嫩度、保水性和肉色均有重要的影响[27]。本试验发现,采用NOS抑制剂处理后牦牛肉的pH显著降低,这可能是NO在肌肉转化为肉中起作用,影响肌肉蛋白水解和糖酵解,NOS抑制处理后肌肉乳酸合成增加,pH降低[11]。NO可通过抑制鸟苷酸环化酶影响环磷酸鸟苷的形成和cGMP依赖性蛋白激酶活性参与骨骼肌糖原代谢[28-29]。本研究结果与COTTRELL等[11]报道NOS抑制剂显著降低羔羊胸肉及腰大肌的极限pH相似。
肉色影响肉及肉制品的商业价值。主要是由肉中的肌红蛋白和血红蛋白所决定。本试验发现NOS抑制剂处理牦牛肉后,*值增大,*值降低。pH在肉类颜色中起着关键作用[12],低pH的肉颜色较浅,而pH较高使肉色加深[30]。本研究发现NOS抑制剂对肉色变化有重要影响,该结果与MOLLER等[31]研究结果一致,NO与肌红蛋白发生反应,在肉制品中产生粉红色,NOS抑制剂处理组中的*值较低可能与NO含量较少有关。COTTRELL等[11]发现宰前注射NOS抑制剂,肉色不受L-NAME的影响,本试验与上述结果不同,原因可能是物种的差异,肌纤维类型的组成和肌肉NO水平不同造成。
MFI反映了成熟过程中肌原纤维蛋白的降解情况。宰后肌原纤维蛋白降解与肌纤维小片化是成熟嫩化的重要标志[32]。本试验发现,用NOS抑制剂对宰后牦牛肉进行处理,MFI增大,与NO抑制肌原纤维蛋白的降解有关。该结果与KOH等[14]发现内源性NO参与减少蛋白质的降解和增加蛋白质的合成,并诱导骨骼肌纤维肥大,对肉嫩化有抑制作用的结果一致。
氧化被认为是影响肉品质的一个重要因素[33],巯基氧化是蛋白质氧化的最初反应之一[34]。本试验发现,用NOS抑制剂对宰后牦牛肉处理,羰基含量显著降低,总巯基含量显著升高。这可能是因为NO加速肌肉中蛋白质氧化,肌肉中羰基含量上升;游离巯基被氧化为二硫键,游离巯基含量会降低,总巯基含量也降低。这与李玉品[13]发现NO能够促进蛋白质氧化,使羰基含量上升;NOS抑制剂组游离巯基含量高于对照组的结果一致。随着氧化剂浓度的增加,巯基含量降低[35]。肌原纤维蛋白氧化后,降低了其游离巯基含量[36]。此外,高水平的NO和NO衍生物可以降低宰后肌肉的抗氧化能力,从而导致冷藏期间肉中蛋白质的高水平氧化[13,37-38]。
4 结论
采用不同浓度NOS抑制剂溶液处理牦牛背最长肌,抑制了肌肉中NOS活性,减少NO的表达量,导致宰后牦牛肉成熟过程中pH、肉色*值及羰基含量显著降低;肉色*值、MFI和总巯基含量显著上升。NO促进宰后牦牛肉成熟过程中蛋白质氧化,抑制肌原纤维蛋白的降解,降低宰后牦牛肉的嫩度,使肉色L值降低,*值升高,对宰后牦牛肉的品质产生负面影响。
[1] 谢秀梅. 青海牦牛业可持续发展的新思路. 青海畜牧兽医杂志, 2015, 45(6): 43.
XIE X M. New idea of sustainable development of yak industry in Qinghai ., 2015, 45(6): 43. (in Chinese)
[2] 孙志昶, 冯晓琴, 韩玲, 赵会平, 余群力. 牦牛肉宰后成熟嫩化与细胞凋亡酶活力变化研究. 农业机械学报, 2014, 45(1): 191-196, 202.
SONG Z C, FENG X Q, HAN L, ZHAO H P, YU Q L. Tendernes and apoptotic activity of Yak meat during postmortem aging., 2014, 45(1):191-196, 202. (in Chinese)
[3] 李鹏, 余群力. 甘南黑牦牛肉品质分析. 甘肃农业大学学报, 2006, 41(6): 114-117.
LI P, YU Q L. Meat quality of Gannan black yak.,2006, 42(6): 114-117. (in Chinese)
[4] 韩玲. 冷却牦牛分割肉酶嫩化技术研究. 农业工程学报, 2003, 19(2): 171-175.
HAN L. Tenderizing technology for chilled cut yak meat by fermentation., 2003, 19(2): 171-175. (in Chinese)
[5] Liu R, Robyn D W, Zhou G H, Zhang W G.Contribution of nitric oxide and protein S-nitrosylation to variation in fresh meat quality., 2018, 143(5):30-38.
[6] Stamler J S, Lamas S, Fang F C. Nitrosylation: The prototypic redox-based signaling mechanism., 2001, 106(6): 675-683.
[7] ZHANG W G, XIAO S, AHN D U. Protein oxidation: Basic principles and implications for meat quality., 2013, 53(11):1191-1201.
[8] CARLIN K R M, HHFF-LONERGAN E, ROWE L J, LONERGAN S M. Effect of oxidation, pH, and ionic strength on calpastatin inhibition of μ-and m-calpain., 2006, 84(4): 925.
[9] LIU R, LI Y P, ZHANG W G, FU Q Q, LIU N, ZHOU G H. Activity and expression of nitric oxide synthase in pork skeletal muscles., 2015, 99: 25-31.
[10] BRANNAN R G, DECKER E A. Nitric oxide synthase activity in muscle foods., 2002, 62(2): 229-235.
[11] COTTRELL J J, MCDONAGH M B, DUNSHEA F R, WARNER R D. Inhibition of nitric oxide release pre-slaughter increases post-mortem glycolysis and improves tenderness in ovine muscles., 2008, 80(2): 511-521.
[12] ZHANG W, MARWAN A H, SAMARAWEERA H, LEE E J, AHN D U. Breast meat quality of broiler chickens can be affected by managing the level of nitric oxide., 2013, 92(11): 3044-3049.
[13] 李玉品. 蛋白质亚硝基化对宰后猪肉钙蛋白酶系统和蛋白质降解的影响[D]. 南京: 南京农业大学, 2015.
LI Y P. Effects of protein nitrogenation on calpain activation and protein proteolysiis of pork during postmortem aging [D]. Nanjing: Nanjing Agricultural University, 2015. (in Chinese)
[14] KOH T J, TIDBALL J G. Nitric oxide inhibits calpain-mediated proteolysis of talin in skeletal muscle cells., 2000, 279(3): C806-C812.
[15] COTTRELL J J. Nitric oxide influences muscle physiology and meat quality [D]. Australia: James Cook University, 2004.
[16] ZHANG J S, KRAUS W E, TRUSKEY G A. Stretch-induced nitric oxide modulates mechanical properties of skeletal muscle cells., 2004, 287(2): C292-C299.
[17] COOK C J, SCOTT S M, DEVINE C E. Measurement of nitric oxide and the effect of enhancing or inhibiting it on tenderness changes of meat., 1998, 48(1/2): 85-89.
[18] 田甲春, 韩玲, 刘昕, 师希雄, 王文婷, 郭兆斌. 牦牛肉宰后成熟机理与肉用品质研究. 农业机械学报, 2012, 43(12): 146-150.
TIAN J C, HAN L, LIU X, SHI X X, WANG W T, GUO Z B. Ageing mechanism and meat quality during postmortem ageing of yak meat., 2012, 43(12): 146-150. (in Chinese)
[19] 李婕, 罗天林, 师希雄, 韩玲, 余群力, 马君义. 牦牛肉宰后成熟过程中热休克蛋白27表达量与食用品质的相关性分析. 食品科学, 2016, 37(9): 18-22.
LI J, LUO T L, SHI X X, HAN L, YU Q L, MA J Y. Correlation analysis between heat shock protein 27 expression and eating quality during postmortem aging of yak meat., 2016, 37(9): 18-22. (in Chinese)
[20] 黄明, 周光宏, 徐幸莲, 赵莲. 不同注射处理对牛肉剪切力和肌原纤维小片化指数的影响. 食品科学, 2005, 26(2): 49-51.
HUANG M, ZHOU G H, XU X L, ZHAO L. Effects of injection treatments on beef Warner-Bratzler shear force and myofibrillar fragmentation index.2005, 26(2): 49-51. (in Chinese)
[21] 李银. 蛋白氧化对肌肉保水性的影响机制研究[D]. 北京: 中国农业科学院, 2014.
LI Y. Effect-mechanism of protein oxidation on water-holding capacity of muscle [D]. Beijing: Chinese Academy of Agricultural Sciences Dissertation, 2014. (in Chinese)
[22] OLIVER C N, AHN B W, MOERMAN E J, GOLDSTEIN S, STADTMAN E R. Age-related changes in oxidized proteins., 1987, 262(12): 5488-5491.
[23] LIU G, XIONG Y L, BUTTERFIELD D A. Chemical, physical, and gel-forming properties of oxidized myofibrils and whey-and soy-protein isolate., 2000, 65(5): 811-818.
[24] MAN H S J, TSUI A K Y, MARSDEN P A. Chapter Seven-Nitric oxide and hypoxia signaling., 2014, 96(12): 161-192.
[25] COTTRELL J J, PONNAMPAIAM E N, DUNSHEA F R, WARNER R D. Effects of infusing nitric oxide donors and inhibitors on plasma metabolites, muscle lactate production and meat quality in lambs fed a high quality roughage-based diet., 2015, 105: 8-15.
[26] 周光宏. 畜产品加工学. 北京: 中国农业出版社, 2011: 55.
ZHOU G H.. Beijing: China Agricultural Press, 2011: 55. (in Chinese)
[27] 刘瑞, 周光宏, 张万刚. 一氧化氮和蛋白质亚硝基化对鲜肉品质的影响研究进展. 中国畜牧杂志, 2017(4). 1-2.
LIU R, ZHOU G H, ZHANG W G. Research progress on the effect of nitric oxide and protein nitrite on fresh meat quality., 2017(4): 1-2. (in Chinese)
[28] YOUNG M E, RADDA G K, LEIGHTON B. Nitric oxide stimulates glucose transport and metabolism in rat skeletal muscle., 1997, 322(1): 223-228.
[29] MERRY T L, LYNCH G S, MCCONELL G K. Downstream mechanisms of nitric oxide-mediated skeletal muscle glucose uptake during contraction., 2010, 299(6): R1656-R1665.
[30] SWATLAND H J. How pH causes paleness or darkness in chicken breast meat., 2008, 80(2): 396-400.
[31] MOLLER J K S, SKIBSTED L H. Nitric oxide and myoglobins., 2002, 102(4): 1167-1178.
[32] HUFF-LONERGAN E, MITSUHASHI T, BEEKMAN D D, JR P F, OLSON D G, ROBSON R M. Proteolysis of specific muscle structural proteins by mu-calpain at low pH and temperature is similar to degradation in postmortem bovine muscle., 1996, 74(5): 993-1008.
[33] SHACTER E. Quantification and significance of protein oxidation in biological samples., 2000, 32(3/4): 307-326.
[34] FENG X C, CHEN L, LEI N, WANG S X, XU X L, ZHOU G H, LI Z X. Emulsifying properties of oxidatively stressed myofibrillar protein emulsion gels prepared with (-)-epigallocatechin-3-gallate and NaCl., 2017, 65(13): 2816-2826.
[35] 胡忠良, 邹玉峰, 林玉海, 普琦, 徐幸莲. 氧化程度对肌原纤维蛋白热凝胶及理化特性的影响. 食品科学, 2013, 34(17): 19-23.
HU Z L, ZOU Y F, LIN Y H, PU Q, XU X L. Effects of oxidation degree on heat-induced gel and physicochemical properties of myofibrillar protein., 2013, 34(17): 19-23. (in Chinese)
[36] 李玲, 季慧, 康大成, 周怡, 郭燕云. 氧化条件下茶多酚对猪肉肌原纤维蛋白理化和凝胶特性的影响. 食品科学, 2019, 40(2): 20-25.
LI L, JI H, KANG D C, ZHOU Y, GUO Y Y. Effects of tea polyphenols on physicochemical and gel properties of pork myofibrillar protein under oxidation conditions., 2019, 40(2):20-25. (in Chinese)
[37] ASTRUC T, MARINOVA P, LABAS R, GATELLIER P, SANTé-LHOUTELLIER V. Detection and localization of oxidized proteins in muscle cells by fluorescence microscopy., 2007, 55(23): 9554 -9558.
[38] ZHAO K, HUANG Z, LU H L, ZHOU J F, WEI T T. Induction of inducible nitric oxide synthase increases the production of reactive oxygen species in RAW264.7 macrophages., 2010, 30(4): 233-241.
Effect of Nitric Oxide Synthetase Inhibitor on Yak MeatQuality during Post-Mortem Aging
LI XueRu, SHI XiXiong, WANG JianZhong, ZHANG PanGao, TIAN Zhu, HAN Ling
(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070)
【Objective】The effect of nitric oxide on the yak meat quality of post-mortem was studied to provide a theoretical basis for improving the yak meat quality. 【Method】The(LD) muscles of 3-5-year-old castrated Gannan yak were used as the material. After removing the fascia and fat, the LD was cut into uniform-sized slices (8 cm × 8 cm), and uniformly pierced with a 20 G needle. Subsequently, a part of each sample were immersed at deionized water (as the control group), and the remainders of the muscle samples were immersed at 1, 10, and 100 mmol L-1nitric oxide synthase (NOS) inhibitor (N-nitro-L-arginine methyl ester hydrochloride) then aged at 4℃for 0, 1, 3, 5, and 7 d, which served as treatment group. Then, the NOS activity, the content of nitric oxide, sulfhydryl, and carbonyl, the myofibrillarfragmentation index (MFI), pH and color were analyzed. 【Result】The NOS activity and nitric oxide content of the meat sample in NOS inhibitor group were significantly decreased; at 7 d, the NOS activity of each NOS inhibitor treatment group was 30.9%, 43.6% and 74.7% lower than that of the control group, respectively. Nitric oxide levels were 4.7%, 12.5%, and 21.5% lower than the control group, respectively.The pH in the treatment group significantly decreased; at 7d, the treatment groups were 0.8%, 5.7%, and 15.2% lower than the control group, respectively. The 10 and 100 mmol L-1NOS inhibitor treatment groups were significantly different compared with the control group. The treatment significantly reduced the carbonyl content of the yak meat; at 7 d, treatment groups were 4.1%, 19.0%, and 22.2% lower than the control group, respectively. The MFI of the treatment group increased significantly; at 7 d, treatment groups were 31.1%, 23.3%, and 9.6% lower than the control group, respectively. The total sulfhydryl content was significantly increased in the treatment groups; at 7d, the control group was 3.2%, 3.7%, and 2.7% lower than the NOS inhibitor treatment groups. In addition, the treatment significantly reduced the* value and significantly increased the* value of samples; at 7d, the* values of each treatment groups were 7.1%, 40.2%, and 30.7% lower than the control group, respectively. The* value of treatment groups were 1.1%, 2.0%, and 1.1% higher than the control group, respectively. 【Conclusion】Nitric oxide promoted protein oxidation of yak meat post-mortem, inhibited tenderness of yak meat, decreased*value and increased*value, which adversely affected the quality of yak meat during post-mortem aging; NOS inhibitor inhibited NOS activity in muscle.
yak meat; post-mortem aging; nitric oxide; nitric oxide synthase inhibitor ; yak meat quality
2019-07-12;
2019-09-11
国家自然科学基金(地区科学基金项目)31760436、青年研究生指导教师扶持基金项目(GAU-QNDS-201716)
李雪茹,Tel:15870149590;E-mail:1418407813@qq.com。通信作者师希雄,Tel:13893134511;E-mail:sxix77@163.com
(责任编辑 赵伶俐)
