一株好氧反硝化菌的分离鉴定及脱氮特性研究
2020-08-14陈张娜李燕敏
郭 超,尹 辉,,范 奎,陈张娜,李燕敏
(1.武汉科技大学城市建设学院,湖北 武汉430065;2.武汉理工大学土木工程学院,湖北 武汉430070;3.武汉黄陂凯迪水务有限公司,湖北 武汉 432200;4.北京城建亚泰建设集团有限公司,北京100013)
众所周知,水体富营养化是当今水污染防治领域的一个热点问题[1]。水体中氮污染是引起水体的富营养化的一个重要原因,氮含量超标不仅会增加水处理成本,而且会直接影响动物及人体的健康[2]。因此,高效去除水体中氮已经成为废水处理研究中的重要课题之一。常见的治理水体中氮污染的方法或技术包括物理、化学和生物脱氮[3]。其中,生物脱氮技术具有高效、经济的优点,已被广泛应用于治理水体中氮污染[4-5]。传统的生物脱氮过程包括硝化和反硝化两个作用过程,其中硝化作用需要在好氧条件下完成,反硝化作用在厌氧或兼性厌氧条件下发生[6-7],这会导致传统的硝化、反硝化过程不能同步实现,进而影响污水的脱氮效率[8]。近年来,随着人们环保意识的增强,除氮技术得到了快速发展,出现了很多新型的生物脱氮技术,如短程硝化、好氧反硝化、厌氧氨氧化等工艺[9-11]。其中,好氧反硝化工艺突破了人们对传统硝化和反硝化理论的认识,给生物脱氮技术提供了一种崭新的思路。
好氧反硝化作用是指在好氧条件下,好氧反硝化菌在一系列酶的作用下将硝酸盐氮转化为气态氮的过程。20世纪80 年代,人们首次发现了具有好氧反硝化功能的副球菌属(Paracoccus)[12]。该菌属的发现打破了反硝化作用只能在缺氧或厌氧条件下进行的传统观点,为实现同步硝化反硝化工艺奠定了微生物学基础。与传统的生物脱氮技术相比,同步硝化反硝化工艺具有反应速率高、操作简单、污水处理效率高等优点[13]。而实现该工艺的关键问题是富集更多的好氧反硝化菌,为此研究者在自然界中筛选出了越来越多的好氧反硝化菌[14]。据报道,国内外学者筛选出的好氧反硝化菌有异养球硫细菌(Thiosphaerapantotropha)[15]、产碱杆菌(Alcaligenes)[16-17]、副球菌属(Paracoccus)[18-19]、红球菌属(Rhodococcus)[20]、芽胞杆菌属(Bacillus)[21]等。由于各类菌属在不同环境中筛选出来,其脱氮性能也存在一定的差异。
为了进一步丰富已有好氧反硝化菌属的特性,本文以本课题组培养的具有同步脱氮除磷的好氧颗粒污泥为污泥样品,通过富集、分离、纯化初步分离出9株具有好氧反硝化特性的单菌株,并利用静态反硝化试验,筛选出一株具有较强好氧反硝化能力的高效菌株Y8,通过对其进行鉴定,进一步探讨该高效菌株在不同操作和运行条件下的反硝化性能,最终确定该菌株最佳的好氧反硝化条件。
1 材料与方法
1.1 试验材料
1.1.1 污泥样品来源

好氧颗粒污泥外观呈黄褐色或黄色,粒径约为1 mm,污泥浓度在8 000 mg/L左右,系统对COD、氮和磷的去除率在85%左右。
1.1.2 培养基配制
为了筛选和研究好氧反硝化菌,本试验配制了4种培养基,其组成如下。
(1) 富集培养基:柠檬酸钠5.0 g,KNO32.0 g,K2HPO41.0 g,KH2PO41.0 g,MgSO4·7H2O 0.2 g,NaCl 30.0 g,蒸馏水1 L,调节pH值至7.0~7.2。
(2) BTB固体培养基:琼脂20.0 g,柠檬酸钠5.0 g,KNO32.0 g,K2HPO41.0 g,KH2PO41.0 g,MgSO4·7H2O 0.2 g,NaCl 30.0 g,BTB 1 mL,蒸馏水1 L,调节pH值至7.0~7.2。
(3) 普通细菌培养基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 30.0 g,蒸馏水1 L,调节pH值至7.0~7.2。
(4) 反硝化培养基:柠檬酸钠 5.0 g,KNO31.0 g,KH2PO41.0 g,FeCl3·6H2O 0.05 g,CaCl2·2H2O 0.2 g,MgSO4·7H2O 0.1 g,NaCl 30.0 g,蒸馏水1 L,调节pH值至7.0~7.2。
1.2 试验方法
1.2.1 好氧反硝化菌的分离与筛选
(1) 富集:先从SBR反应器中吸取25 mL泥水混合液,并将其搅拌均匀,再加入至250 mL灭菌的富集培养基中,放入30℃气浴摇床以160 r/min转速培养2~3 d;然后取25 mL富集液加入新的富集培养基中,按相同步骤继续培养,共富集3次。
(2) 分离与纯化:先用移液枪吸取0.1 mL富集液,加入含有0.9 mL无菌水的小试管中,摇匀后即得到浓度为10-1的菌液,以此类推将富集液依次稀释到10-3、10-4、10-5、10-6、10-7浓度;然后将以上浓度梯度的菌液分别涂布于BTB培养基上,倒置放入30℃培养箱中培养2 d;最后挑取培养基变蓝的单菌落,在BTB培养基上划线纯化,倒置放入30℃培养箱中培养3~5 d,如此重复4次后得到纯菌落,斜面4℃保存备用。
1.2.2 好氧反硝化菌株反硝化能力的测定
将分离的菌株移植到100 mL细菌培养基中培养24 h,取培养液10 mL离心,弃去上清液并用蒸馏水洗涤固体颗粒,后转接至100 mL反硝化液体培养基中,透气塞封口,30℃、160 r/min气浴摇床连续培养,每隔12 h取样,测定其脱氮效率,从中优选出高效的好氧反硝化菌株。
1.2.3 高效好氧反硝化菌株DNA的提取和PCR扩增与测序
细菌基因组16SrDNA提取:①吸取100 μL无菌水至PCR管中,并用灭菌的接种环挑取单个菌落(2~3环)溶于无菌水;②将PCR管置于PCR仪中,94℃裂解4 min提取DNA;③离心机上以转速3 000 r/min离心10 min;④吸取70~80 μL上清液到新的PCR管中。
PCR扩增[22]:先配制PCR反应体系(50 μL):5 μL 10×Taq Buffer ,5 μL dNTP,1 μL 27F, 1 μL 1492R,1 μL Taq酶,10 μL template(即上清液)(空白加10 μL无菌水)无菌水补足至50 μL;然后在PCR仪上扩增大约2.5 h,之后称取0.14 g琼脂糖于锥形瓶,加入20 mL 1×TAE[23](0.4 mL 50×TAE+20 mL H2O),用微波炉煮沸至琼脂糖溶解后补水至原重;最后配制1×TAE缓冲液(2.5 mL 50×TAE+125 mL H2O)倒入电泳槽,并放入琼脂糖。进样时,第一个孔为1 μL 6×loading buffer+5 μL marker,后面的孔为0.6 μL 6×loading buffer+3 μL PCR产物[23]。
电泳:进行电泳时,其条件为电压80 mV,电流80 mA,时间30 min。
染色与洗涤:先将电泳后的胶放入EB中染色10 min左右;然后用清水洗掉胶上的EB染色剂;最后在紫外成像仪器上观察PCR样品纯度是否良好,符合则送样检测。
将该高效菌株测序得到的16SrDNA序列与基因数据库中已有细菌序列进行同源性比对[24],选择序列相似度高的菌株构建系统发育树。
1.2.4 操作和运行条件对高效好氧反硝化菌株脱氮性能的影响
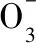
(1) 碳源试验:设置4个试验组,反硝化培养基中碳源分别采用相同碳含量的丁二酸钠、酒石酸钾钠、葡萄糖、柠檬酸钠,其他成分保持不变,培养基的pH值为7.0,温度为30℃。通过本试验确定高效好氧反硝化菌株最适合的碳源。
(2) pH值试验:设置5个试验组,反硝化培养基的组成同第1.1.2节(4)所述,但培养基的pH值分别设定为6.0、6.5、7.0、7.5和8.0,温度为30℃。通过本试验确定高效好氧反硝化菌株最适合的pH值范围。
(3) 温度试验:设置5个试验组,反硝化培养基的组成同第1.1.2节(4)所述,培养基的pH值为7.0,反应温度分别控制为20℃、25℃、30℃、35℃和40 ℃。通过本试验确定高效好氧反硝化菌株最适合的温度范围。
1.2.5 好氧反硝化菌株生长曲线的测定
吸取2 mL种子液接种至盛有200 mL反硝化培养基中维持30℃、160 r/min条件下连续培养,间隔一定时间内取样,测定波长为600 nm处的吸光度,并绘制好氧反硝化菌株的生长曲线。
可以看到,随着SPP阶数的上升,Er随θ变化而变化的周期变小.其它分量对θ的依赖关系随着阶数的上升也有着类似的变化.这是由于场量中都含有因子ei(nθ+βz-ωt),n越大,相同的θ所引入的相位就越大,即场量随θ变化而变化得越快,故场量随θ分布的周期就越小.
1.3 测试方法
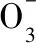
2 结果与讨论
2.1 好氧反硝化菌初筛结果
好氧颗粒污泥样品经富集培养后,不同梯度富集液进一步培养48 h,挑选BTB初筛培养基变蓝的菌落进行研究,观察不同条件下菌落的形态。经观察发现,稀释倍数为10-3和10-4的培养基上菌落较为密集,稀释倍数为10-5的培养基上单菌落数量较多,而稀释倍数在10-6以上的培养基上已无菌落生长,见图1。
从涂布平板上挑取单菌落,采用平板划线法进行分离与纯化,由图1(d)可见共划分了3个区域,每个区域划3条线,从第一区域到第三区域菌落数逐渐减少,在第三区域末端可见若干明显的单菌落,菌落大小约为2 mm,呈规则圆形,表面光滑黏稠,颜色为不透明淡黄色。

图1 不同条件下菌落的形态Fig.1 Colony morphology under different conditions
2.2 初筛菌株反硝化性能的测定
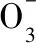
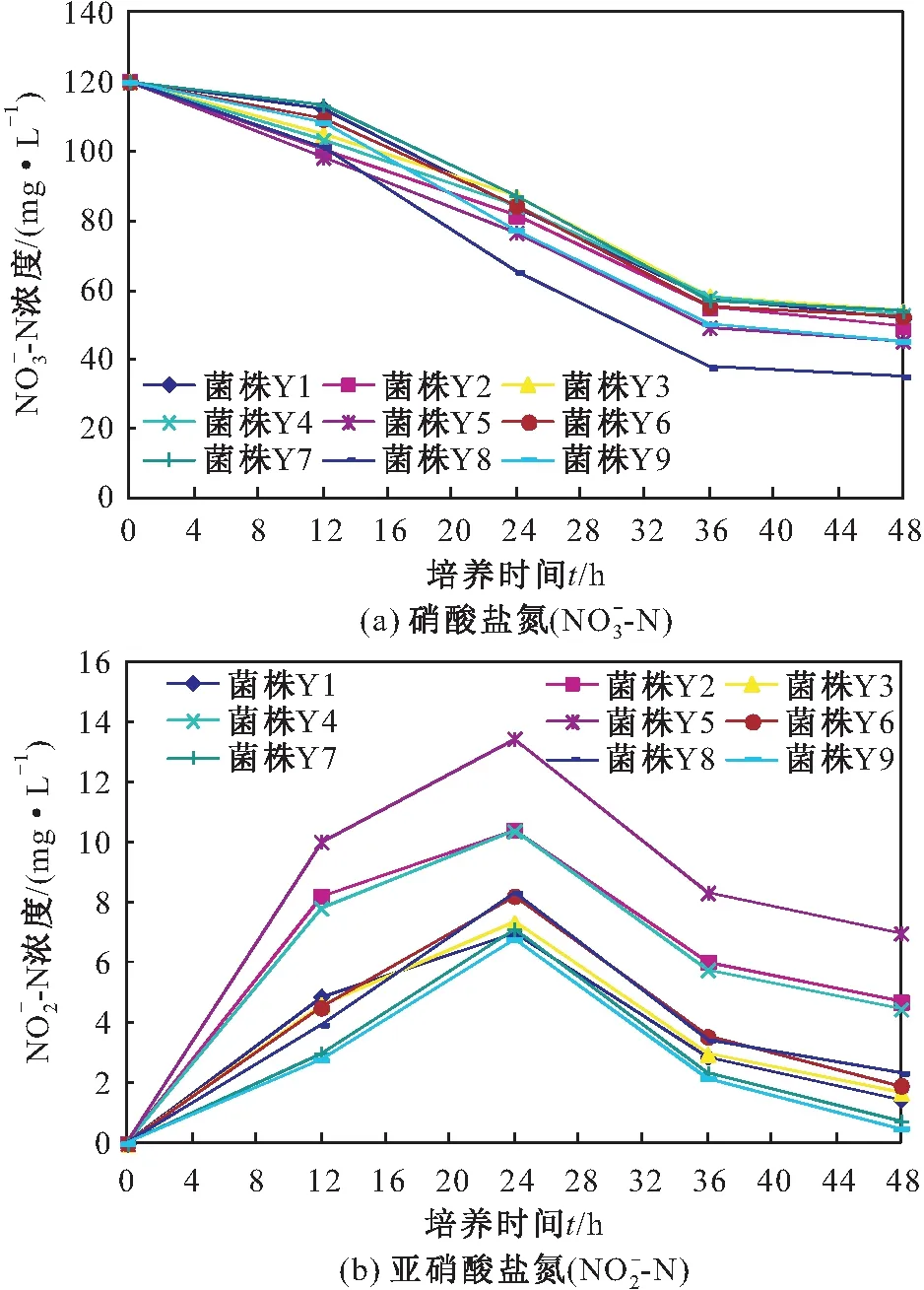
图2 各菌株反硝化过程中N-N和N-N浓度的变化Fig.2 Change of concentration in the denitrification process of each strain
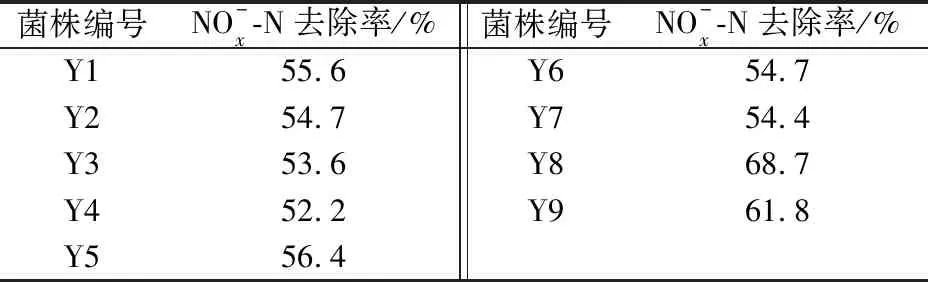
表1 各菌株培养48 h后对氮的总去除率Table 1 Total removal rate of N after 48 h culture for each strain
2.3 菌株Y8的生长曲线
将菌株Y8 接种至反硝化培养基中进行好氧反硝化试验,观察菌株Y8的生长情况,其试验结果见图3。
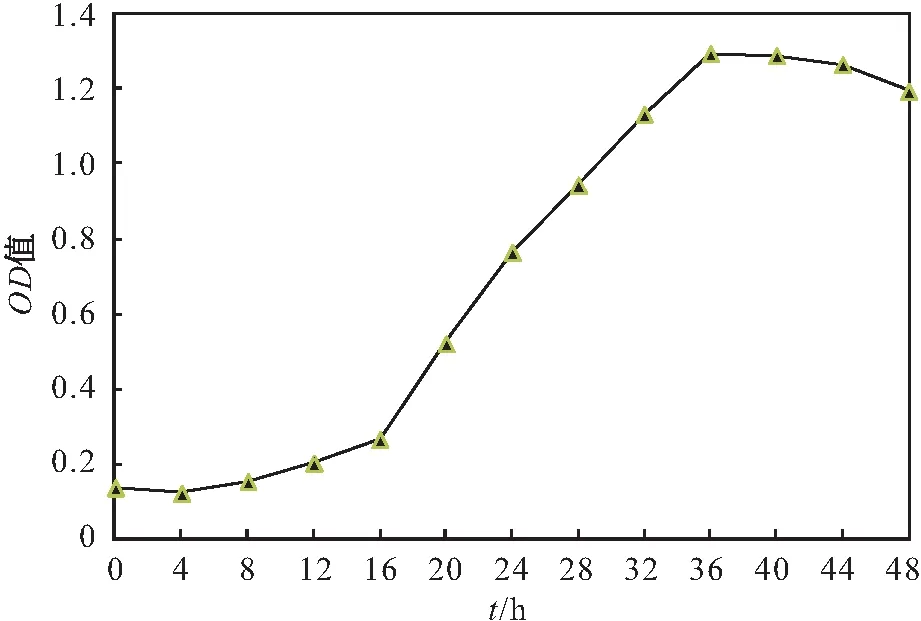
图3 菌株Y8的生长曲线Fig.3 Growth curve of strain Y8
由图3可见,在好氧条件下,菌株Y8 的迟缓期为0~8 h,此时菌株生长较缓慢;在16~24 h内菌体量增长速度最快,到36 h时达到最大生长量,进入稳定期;在44 h左右时菌体进入衰亡期。
2.4 菌株Y8的鉴定
依据第1.2.3的方法,对菌株Y8进行基因组16SrDNA的提取和PCR扩增与测序,将测序得到的基因序列提交至GenBank进行Blast检索,然后用MEGA7.0以领位相接[26](Neighbour-joining)法构建菌株Y8系统发育树,见图4。
由图4可见,菌株Y8与Halomonasvenusta在同一个分支上,同时对该菌株染色得到为革兰氏阴性菌,外观呈杆状,结合其菌落的形态(见图1),初步判定该菌株Y8为盐单胞菌。另外,由上述分析可知,菌株Y8具有显著的好氧反硝化效果,这一点与盐单胞菌属具有硝酸盐和亚硝酸盐还原能力一致[27]。而孙雪梅等[28]在鱼类养殖环境中分离出的盐单胞菌X3以及沈辉等[29]在海洋滩涂沉积物中分离出的盐单胞菌MD5,同属于盐单胞菌,均具有较强的脱氮能力,尤其在高盐环境下其脱氮能力更为显著。
2.5 不同操作和运行条件对菌株Y8脱氮性能的影响
2.5.1 碳源的影响
碳源不仅可以给细菌生命活动提供能量,也给细菌好氧反硝化过程提供电子受体,因此碳源对好氧反硝化菌生长和脱氮性能的影响很大。好氧反硝化菌主要以葡萄糖、乙酸钠、丁二酸钠和柠檬酸钠等为碳源,少数也以某些难降解有机物为碳源[30]。本试验中菌株Y8 分别以酒石酸钾钠、丁二酸钠、柠檬酸钠、葡萄糖作为唯一碳源时,培养48 h后其反硝化脱氮效果见图5。
由图5可见,丁二酸钠作为碳源的氮去除率最高,菌株Y8培养48 h后氮的去除率达到77.86%,其次是柠檬酸钠,氮的去除率高于40%,而以酒石酸钾钠作为碳源时,氮的去除率仅为18.14%。因此,在现有的4种碳源中,丁二酸钠为菌株Y8的最
佳碳源。这是因为丁二酸钠为微生物呼吸作用时三羧酸循环的中间代谢产物,可以被菌株直接利用,同时还能増强硝酸盐还原酶的活性。葡萄糖虽然属于易被微生物利用的物质,但菌株在利用葡萄糖时需要先水解为小分子有机酸,所以对氮的去除效果不如丁二酸钠好[31]。这与Chen等的研究结果一致,与葡萄糖、蔗糖这类大分子碳源相比,丁二酸钠和柠檬酸钠是好氧反硝化作用的优选碳源[30]。
2.5.2 pH值的影响
一般认为,pH值会引起细胞膜电荷的变化,进而影响微生物对营养物质的吸收,且会影响相关酶的活性,改变生长环境中营养物质以及有害物质的性质[31]。因此,pH值对菌株好氧反硝化作用有重要的影响。本试验设定pH值范围为6.0~8.0,研究不同pH值对菌株Y8反硝化脱氮效果的影响,其试验结果见图6。
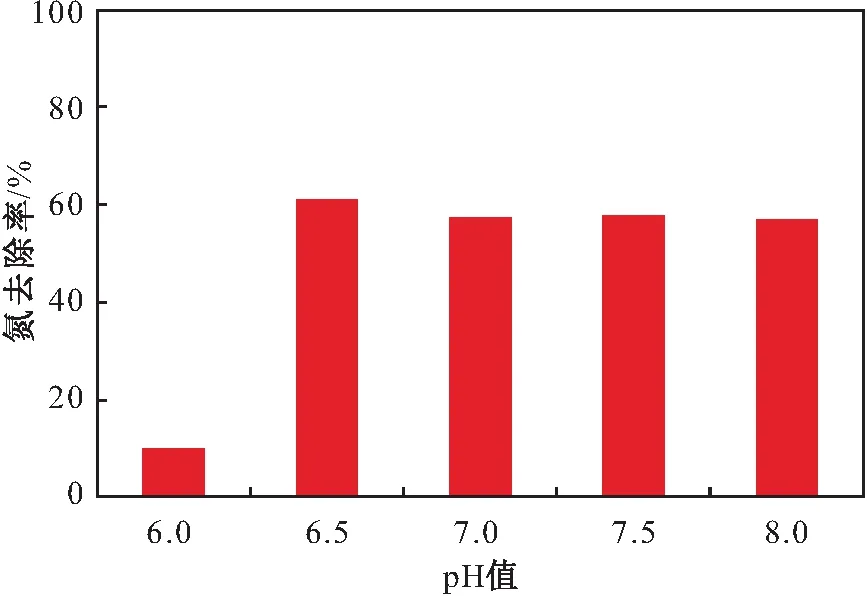
图6 不同pH值对菌株Y8脱氮效果的影响Fig.6 Effect of different pH values on nitrogen removal effect of strain Y8
由图6可见,菌株Y8在pH值为6.0~8.0的范围内均可进行好氧反硝化作用,但当pH值为6.0时菌株Y8的反硝化能力相对较差,氮的去除率仅为10.02%;当pH值为6.5时,氮的去除率最高,脱氮率达到61.02%;当pH值高达8.0时,氮的去除率也维持在较高水平。因此,菌株Y8达到最佳反硝化脱氮效果的pH值为6.5,在pH值为6.5~8.0时其也具有较好的反硝化脱氮效果。
2.5.3 温度的影响
温度作为影响微生物活动的重要因素之一,对微生物的代谢和活性有重要的影响。本试验设定温度范围为20~40℃,研究了不同温度对菌株Y8反硝化脱氮效果的影响,其试验结果见图7。
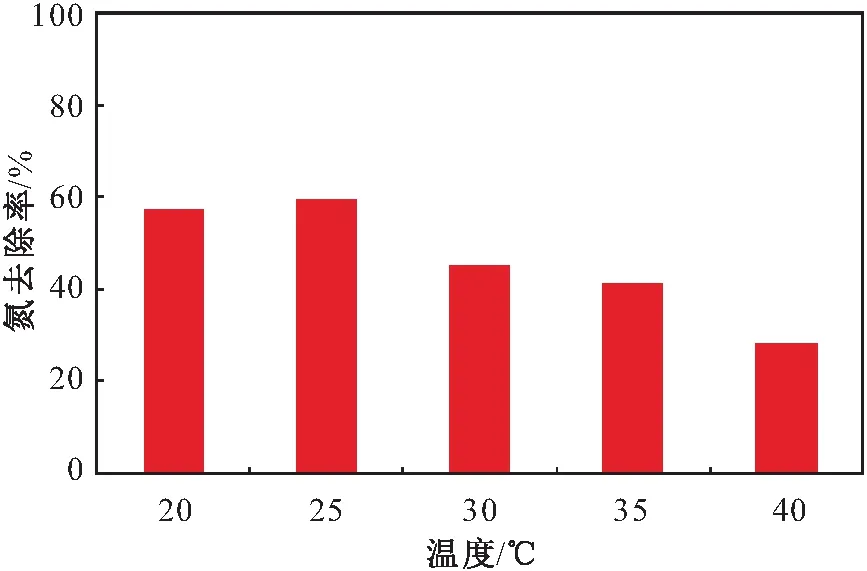
图7 不同温度对菌株Y8脱氮效果的影响Fig.7 Effect of different temperatures on nitrogen removal effect of strain Y8
由图7可见,菌株Y8在20~40℃温度范围内均具有一定的活性,说明菌株Y8有较大的温度适应范围。当菌株Y8培养温度为25℃时,氮的去除率最高,脱氮率高达59.56%;当菌株Y8培养温度为20℃时,氮的去除率为57.23%,且随着温度的升高菌株Y8的脱氮率逐渐下降;当菌株Y8培养温度为30~35℃时,氮的去除率在41%~45%之间;当菌株Y8培养温度升高至40℃时,菌株Y8的脱氮率最低,氮的去除率下降至30%以下。试验结果表明:菌株Y8反硝化脱氮效果最佳的温度为25℃,适应的温度范围为20~35℃。据研究,多数好氧反硝化菌的脱氮性能在过高和过低的温度时都会被抑制,一般适宜的温度范围为25~37℃。Ren等[32]研究发现,在37℃下Acinetobactersp.YB好氧反硝化菌的脱氮效果最好,微生物生长速率也随着温度的升高而升高[32]。本试验结果与该文献报道的结果基本一致。
3 结 论
从同步脱氮除磷好氧颗粒污泥中分离、筛选出一株高效好氧反硝化菌株Y8,经16SrDNA 序列分析,并结合形态和特性分析,确定菌株Y8为盐单胞菌(Halomonassp.)。该菌株的生长曲线测试结果表明:约8 h后菌株生长进入指数期,指数期约持续28 h,稳定期约持续8 h,44 h后进入衰亡期。该菌株的反硝化特性试验结果表明:菌株Y8进行好氧反硝化时,最佳的碳源、pH值和温度分别为丁二酸钠、6.5和25℃,同时在偏碱性条件下,该菌株具有较强的好氧反硝化能力。
