微波消融联合液体注射的温度场
2020-08-14程妍妍乔爱科
田 甄,程妍妍,高 翔,董 彤,南 群,乔爱科
(北京工业大学生命科学与生物工程学院,北京 100124)
肝癌是男性第二大癌症死亡原因. 全世界所有的肝癌患者中,中国占到50%[1]. 原发性肝癌主要包含肝细胞肝癌以及胆管细胞肝癌等[2]不同病理类型,其中肝细胞肝癌(hepatocellular carcinoma, HCC)患者超过90%. 临床上目前治疗肝癌的主要手段包括手术切除、放化疗、靶向药物治疗等,外科手术是公认的最有效的治疗手段[3]. 但是研究表明,肝肿瘤多隐匿发病,大部分患者初诊时便失去了采用手术切除的最佳时机[4]. 因此,微创介入治疗成为非手术治疗的主要手段. 微波消融方法对比射频消融、激光消融等技术具有升温迅速、肿瘤内温度高、受碳化以及血流速度的影响小、消融区域大等优点[5-8],在治疗较大的脏器肿瘤(d≥3 cm)中扮演重要的角色,因此该技术的临床普及率逐年增高[9-11]. 微波消融治疗肝癌的作用机制在于肿瘤细胞对热的敏感性以及微波的加热效应[12]. 临床中应用超声或CT导引,将微波消融针准确插入到肿瘤组织中,天线另一端连接微波发生器. 在微波作用下,肿瘤组织内的极性分子极高速运动,继而在较短时间内生成热量(温度可达60~100 ℃),可以使肿瘤的组织蛋白发生凝固性坏死,从而达到消融肿瘤区域的目的[13]. 目前微波消融治疗部分形状不规则且体积较大(d≥3 cm)肿瘤时,会导致消融效果不佳,有可能引起发热、气胸等并发症,限制了其进一步的推广[14-16]. 因此,扩大有效消融区域是提高微波治疗较大肝肿瘤(d≥3 cm)疗效的关键.
一种扩大有效消融区域的手段是在微波消融期间外加液体. 张亮等[17]将原发性肝肿瘤患者随机分为联合治疗组(注射无水乙醇液体)和对照组(单纯消融组),治疗结果表明微波消融联合无水乙醇注射组的疗效明显优于对照组. 无水乙醇会导致细胞膜快速脱水、蛋白质变性,使得细胞凝固坏死,进而肿瘤细胞死亡. 在微波消融治疗肝癌注射无水乙醇时,可以发现单根微波天线的消融区域显著扩大[2,18]. Goldberg等[19]发现局部注射高渗盐水可增加局部组织的离子浓度、降低阻抗,增加组织的电导率,显著增大单次射频消融的损伤体积. 目前对于在微波消融治疗肝癌的过程中注射液体,只是在活体实验、临床病例上有所研究,缺乏理论上的研究,特别是数据的支持.
在物理模型的构建上可以充分考虑肝脏的多孔特性. 多孔介质是指由固体骨架和空隙中流体(包括含湿气体)被加热或冷却时,在非均匀的温度场中,构成的多相体系[20-21]. 多孔介质中的空隙分为2类:相互连通以及彼此不连通,空隙的尺寸非常微小,一般为小孔、缝隙或不同类型的毛细管等[22]. 多孔介质材料的孔隙率,指的是多孔介质内中孔隙所占总份额[23-24]. 对于生物体而言,选取的孔隙率一般在0.05~0.30. 肝脏的管道系统是与典型的多孔介质材料近似的,因此可以将其作为多孔介质结构进行仿真计算[25-26].
本课题采用有限元仿真软件,建立三维肝脏组织和肿瘤模型,对微波消融过程中注射生理盐水或者无水乙醇进行仿真计算,证明肝脏作为多孔介质的合理性,同时进行相关的离体实验,来验证仿真数据的真实性,并为微波消融联合液体注射能有效地扩大消融区域提供了数据上的支撑.
1 方法
1.1 几何模型
本研究应用有限元软件Comsol Multiphysics构建出天线模型、肝脏组织和肝脏肿瘤模型结构. 天线使用同轴单槽微波天线,结构如图1所示[27],由内导体、外导体、内导管、外导管、扼流圈和空气柱组成. 将微波功率输入口设置在内外导体[28]之间的内导管处. 该天线的基本尺寸和参数如表1、2所示.
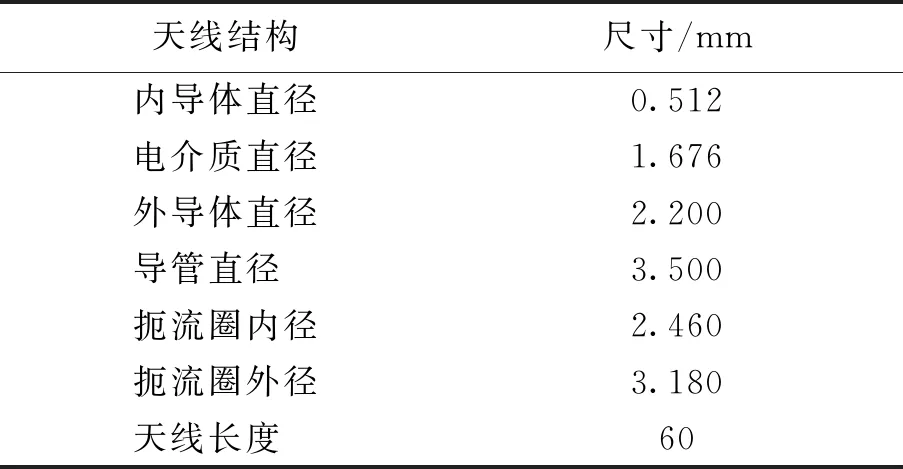
表1 天线尺寸
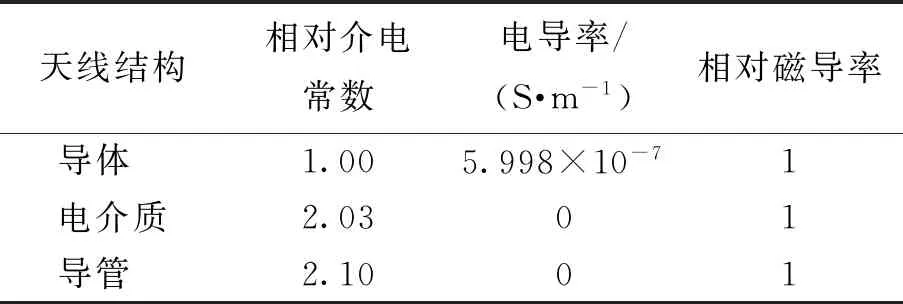
表2 天线参数[29]
由于肝脏组织包括血细胞、血管床和毛细血管等,因此可以将其看作多孔介质结构,而孔隙率是多孔介质的基本特征. 肝脏中的孔隙率φ指的是血液容量(液相)占肝脏总容量的比例,固体骨架部分即组织部分占比为1-φ. 本研究选择的孔隙率为0.10~0.30[30]. 理想的三维对称多孔介质肝组织简化模型如图2所示.
肝脏模型由正常肝脏组织和肝肿瘤组成. 三维肝脏组织模型是半径为3 cm、高度为8 cm的圆柱体. 由于本研究的目的是治疗较大肝癌,因此建立直径为3 cm的球形肿瘤体. 肝脏正常组织、肝肿瘤以及注射的液体(生理盐水或无水乙醇)的热物性参数如表3所示.
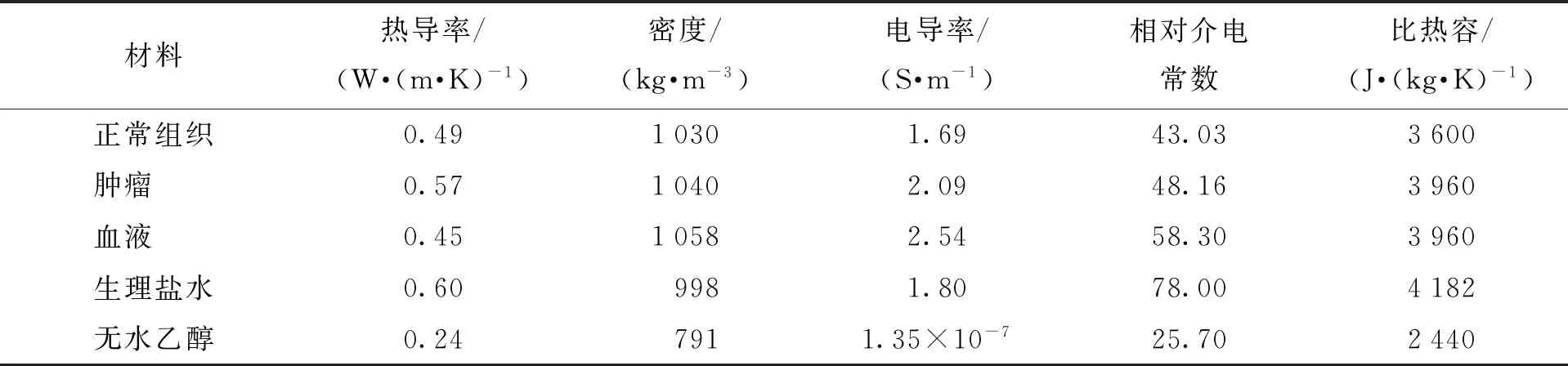
表3 肝脏和注射液体的热物性参数[30-32]
1.2 传热方程
在仿真计算中假设:
1) 肝脏组织是同质且热各向同性.
2) 液体扩散到组织中的速率比液体的正向传播速度快. 也就是说,在液体传播阵面以内的球形组织区域里的液体处于饱和状态.
首次将生物组织的传热与一般的工程材料的传热相区别开来的是由Pennes提出来的生物传热模型[33]. Pennes生物传热方程考虑了血流对组织传热的影响,在固体热传导方程的基础上,引入血液灌注项. 由于注射液体到组织中,液体与组织之间的直接接触会产生热源项[34]. 组织传热方程和液体传热方程为
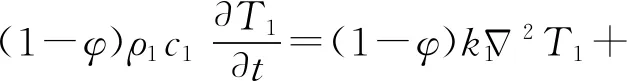
(1)
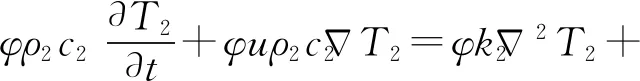
(2)
式中:φ为多孔介质肝脏的孔隙率;ρ1、ρ2分别为组织密度和液体密度,kg/m3;T1、T2分别为组织温度和液体温度,K;Tb为血液温度,K;k1、k2分别为组织和液体导热系数,W/m·K;c1、c2分别为组织和液体比热,J/kg·K;cb为血液比热,J/kg·K;ωb为血液灌注率,kg/m3·s;Qe为外部热源,在仿真中即为微波所产生的能量,W/m3;h为单位体积内组织和液体之间的传热系数,
(3)
(4)
(5)
式中:φ为多孔介质肝脏的孔隙率;Nu为Nusselt数,在本研究中近似取值4[35];A0为组织表面积;d为多孔介质的颗粒直径,在本研究取值为0.5 cm.
1.3 电磁场
本文选取的微波频率为2 450 MHz,此时电磁波的波长远远大于消融区域的长度[32],因此可采用准静态的研究方法近似解决电磁场的问题.
电磁场的计算[36]式为
(6)
(7)
式中:E为电场强度,V/m;ε′r为材料相对介电常数;ε″r为材料相对介电常数的虚部;ω为电磁波的角频率,rad/s;μ′为相对渗透率;c为真空中的光速,m/s;ε0为真空中的相对介电常数;V为空间体积.
将模拟中的电磁场的边界条件设定为散射边界条件;为接近人体实际温度,将温度场的初始温度设定为37 ℃;微波输入功率设定为50、60、70 W.
1.4 离体实验
为验证仿真数据的正确性,进行相关的离体实验. 实验中的离体牛肝组织大小设定为横径、纵径均在6~8 cm,用恒温水浴锅将牛肝组织复温到37 ℃进行实验. 实验采用注射型天线,微波输入频率设定为60 W,消融时间设定为300 s,液体注射量为5 mL.
2 结果和讨论
2.1 孔隙率对消融结果的影响
消融区域的形成取决于组织内的温度分布. 将60 ℃作为有效消融区域的温度场边缘. 消融区域如图3所示. 可以看出,消融区域呈椭球形,因此消融区域尺寸可用消融横径、消融深度和消融体积来描述.
在不注射液体时,消融功率为50 W,消融时间为300 s,肝脏的孔隙率分别为0.10、0.20和0.30的温度场分布如图4所示,消融区域参数如表4所示.

表4 不同孔隙率的消融区域参数(P=50 W,t=300 s)
由图4和表4数据可知,随着肝脏孔隙率的增大,消融区域范围逐渐减小,但减小的趋势不明显;消融区域的横径、纵径和体积均随之减小. 其中横径的减小率依次为1.90%、1.70%;纵径的减小率依次为0.97%、0.65%;体积减小率依次为4.85%、3.90%. 但其减小率不呈等幅度或线性方式减小.
微波输入功率为50 W,消融时间为300 s时,注射生理盐水或者无水乙醇,不同的肝脏孔隙率(0.10、0.15、0.20、0.25、0.30)下的温度场分布如图5所示.
由图5可知,随着孔隙率的增大,消融深度和横径没有明显增大或减小的趋势. 对于注射生理盐水组,随着孔隙率的增大,消融区域的横径减小率依次为0.97%、0.98%、0.97%、0.66%;消融体积的减小率依次为1.65%、1.91%、5.32%、0.75%. 对于注射无水乙醇组,消融区域半径的增大率依次为0.64%、1.60%、1.26%、0.93%;消融区域体积的增大率依次为2.74%、4.10%、4.27%、2.71%. 分析可知其减小率或增大率均不呈等幅度或线性方式减小或增大.
对于生理盐水组,其消融区域的体积随着孔隙率的增加而减小,这与注射乙醇相反. 这是因为无水乙醇具有高渗透性,随着孔隙率的增加,热乙醇可以迅速扩散,从而消融体积增大.
2.2 注射液体对消融结果的影响
由上述研究可知,随着肝脏孔隙率的变化,消融区域的变化不明显,因此该研究下肝脏的孔隙率设定为0.2. 设定微波消融功率为50、60、70 W,消融时间为300 s,液体注射量为5 mL,注射的液体分别为生理盐水和无水乙醇,研究温度场分布情况,如图6和表5、6所示.
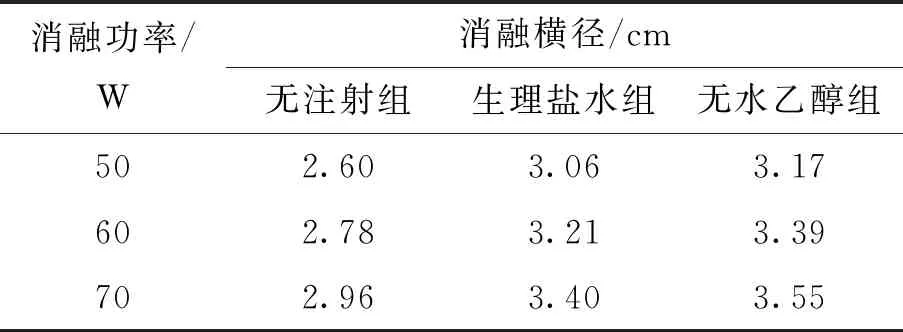
表5 不同组之间横径消融数据结果
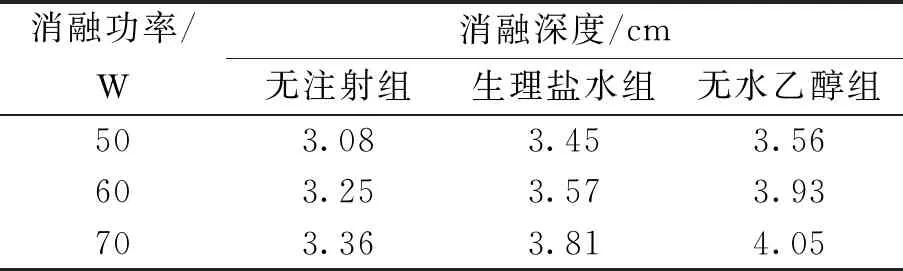
表6 不同组之间深度消融数据结果
可以看出,注射液体之后得到的消融区域都能完全覆盖肿瘤(d=3 cm)部分. 当注射生理盐水时,消融功率逐步增加(50~70 W),消融区域的体积与无注射液体组的体积相比增大率分别为54.99%、48.73%、32.71%,消融区域横径由无注射液体组的2.60 cm增大至3.40 cm. 消融深度由无注射液体组的3.08 cm增大至3.81 cm. 当注射无水乙醇时,当消融功率逐步增加(50~70 W),消融区域的体积相比无注射液体组的增大率分别为71.68%、77.99%、73.39%,消融横径由无注射液体组的2.60 cm增大至3.55 cm,消融深度由3.08 cm增大至4.05 cm.
由于注射生理盐水之后,局部组织中的水分增加,因此减缓了微波天线裂隙附近的碳化过程,使得微波能量更好地扩散到周围区域,消融之后得到的消融区域相对有所增大. 而对于注射无水乙醇,由于无水乙醇具有很强的渗透性,注入之后能够迅速向周围扩散,使微波天线裂隙产生的能量迅速向周围扩散. 因此无论注射哪种液体,都能够有效扩大消融范围,从而提高治疗较大肿瘤的疗效.
通过表5、6数据可知,注射无水乙醇得到的结果要略优于注射生理盐水的结果.
2.3 输入功率对消融结果的影响
肝脏的孔隙率设定为0.2,消融时间300 s,消融功率为50、60、70 W,液体注射量为5 mL,注射的液体分别为生理盐水和无水乙醇,研究消融温度场分布情况,如图7、8所示.
从图7、8所示60 ℃等温线比较中可知,注射液体之后,消融区域能够完全覆盖肿瘤(d=3 cm)部分. 且随着消融功率的逐步增加,消融区域的横径、深度和消融体积均逐步增大.
注入生理盐水后,随着消融功率的增加(50~70 W),消融体积的增大率分别为13.89%和6.19%;注射无水乙醇时,随着消融功率的增加(50~70 W),消融体积的增大率分别为23.06%和15.92%.
从以上分析可知,就体积增大率而言,在低功率(50~60 W)下注射生理盐水或无水乙醇时,体积增大率比高功率(60~70 W)时更高.
2.4 离体实验结果与仿真对比
离体实验数据整理之后如表7所示. 将60 ℃作为消融区域边界.

表7 离体消融实验数据(P=60 W,t=300 s)
由表7数据可知,注射生理盐水或无水乙醇,其消融区域的横径、纵径和体积比无注射组有所增加. 注射生理盐水组比无注射组的横径、纵径和体积增大率分别为9.06%、14.04%、35.72%;注射无水乙醇组比无注射组的横径、纵径和体积增大率分别为18.65%、23.40%、73.82%.
将注射生理盐水或无水乙醇组的仿真数据与离体实验数据进行对比分析并绘制,如图9所示.
可知,注射生理盐水和无水乙醇都能有效地扩大消融区域,仿真组与离体实验组具有相同的扩大趋势. 但通过具体数据对比可知二者还是有一定的差异,主要是由于消融天线结构的不一致性,以及离体实验中反复使用同一根天线造成的.
本研究尚存在局限性. 在仿真研究中应用的几何模型是理想的三维模型,因此对于结果会有一定影响,在今后的工作中会导入真实的几何模型.
3 结论
1) 在微波消融治疗肝肿瘤的模拟计算中,设置微波输入功率为50 W,消融时间为300 s,肝脏孔隙率分别为0.10、0.15、0.20、0.25、0.30. 当注射生理盐水时,消融区域的体积随着孔隙率的增加而减小,注射无水乙醇时,消融区域的体积随着孔隙率增加而增加.
2) 肝脏孔隙率为0.2,输入功率分别为50、60、70 W,注射生理盐水或无水乙醇,液体注射量为5 mL时,计算结果表明,注射液体之后得到的消融区域能够完全覆盖肿瘤(d=3 cm)部分,同时在低功率下(50 W)注射液体获得的消融区域优于高功率下(70 W)无注射液体时获得的消融区域. 在该数值计算中,无水乙醇组的增强效果要略优于生理盐水组的增强效果.
3) 肝脏孔隙率为0.20,输入功率分别为50、60、70 W,注射无水乙醇或生理盐水,液体注射量为5 mL时,计算结果表明,当消融功率增加时,消融区域能有效扩大. 当注射液体时,消融区域相较于无注射液体时明显增大,且随着液体注射量的增加,消融区域逐渐增大. 在低功率(50~60 W)下注射生理盐水或无水乙醇时,体积增大率比高功率(60~70 W)时更高.
