脑泰方对脑出血急性期大鼠神经细胞过氧化损伤的干预作用及机制研究
2020-08-12曾劲松李弘廖君刘林黄娟喻坚柏葛金文
曾劲松 李弘 廖君 刘林 黄娟 喻坚柏 葛金文

〔摘要〕 目的 研究腦泰方对脑出血急性期大鼠神经细胞过氧化损伤的干预作用及其机制。方法 采用自体血注射法构建SD大鼠脑出血模型,随机分为假手术组、模型组、N-乙酰半胱氨酸(NAC)对照组、脑泰方常规剂量(NTFC)组、脑泰方高剂量(NTFH)组,各组于造模并给药7 d后取材;采用HE染色观察脑组织病理形态,采用Zea Longa 5级评分法进行大鼠神经功能缺失评分,采用生物试剂盒检测病灶脑组织脂质活性氧(lipid-ROS)含量,采用免疫组化及Western blot技术检测谷胱甘肽过氧化物酶-4(GPX-4)及铁死亡标志物环氧合酶-2(COX-2)的表达。结果 与假手术组比较,模型组大鼠脑组织病理损伤明显加重,神经功能缺失评分明显升高,病灶脑组织GPX-4表达明显降低,lipid-ROS含量、COX-2表达明显升高,差异均有统计学意义(P<0.01);与模型组比较:NAC组及脑泰方各剂量组病理损伤明显减轻,神经功能缺失评分明显降低,脑组织GPX-4表达明显升高,lipid-ROS含量、COX-2表达明显降低(P<0.05,P<0.01);NTFH组GPX-4表达与NTFC组无显著差异,但NTFH组Lipid-ROS含量及COX-2表达水平均明显低于NTFC组,差异均有统计学意义(P<0.05)。结论 脑泰方可提高脑出血急性期大鼠GPX-4表达,减轻神经细胞的过氧化损伤,其干预机制和效果与铁死亡生化过程及其抑制剂一致,且脑泰方高剂量的干预效果优于常规剂量。
〔关键词〕 脑出血;过氧化损伤;铁死亡;脑泰方;神经保护
〔中图分类号〕R285.6 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.07.008
〔Abstract〕 Objective To study the intervention effect and mechanism of Naotaifang on neuronal peroxidation injury in rats with acute intracerebral hemorrhage. Methods The model of cerebral hemorrhage in SD rats was established by autogenous blood injection, which was divided into a sham operation group, a model group, a N-acetylcysteine (NAC) control group, a Naotaifang conventional dose (NTFC) group and a Naotaifang high dose (NTFH) group. Materials were taken in 7 days after model establishment. HE staining was used to observe the pathological morphology of brain tissue, and Zea longa 5 grade scoring method was used to assess the neurological deficit of rats. Lipid-ROS was detected by biochemical kit. The expression of glutathione peroxidase-4 (GPX-4) and ferroptosis marker cyclooxygenase-2 (COX-2) were detected by immunohistochemistry and Western blot. Results Compared with the sham operation group, the pathological damage of brain tissue in the model group was significantly aggravated, and the neurological deficit score was significantly increased. The expression of GPX-4 was significantly decreased, and the lipid-ROS content and the expression of COX-2 were significantly increased. The difference was statistically significant (P<0.01). Compared with the model group, the pathological damage of NAC group and Naotaifang groups was significantly alleviated, and the neurological deficit score was significantly decreased. The GPX-4 expression in brain tissue was significantly increased, and the lipid-ROS content and COX-2 expression were significantly decreased (P<0.05, P<0.01). There was no significant difference in GPX-4 expression between the NTFC group and the NTFH group, but the lipid-ROS content and COX-2 expression levels were significantly lower than the NTFC group. The difference was statistically significant (P<0.05). Conclusion Naotaifang can improve the expression of GPX-4 in rats with acute ICH, so as to reduce the peroxidation injury of nerve cells. Its intervention mechanism and effect are consistent with the biochemical process of ferroptosis and its inhibitor, and the intervention effect of Naotaifang in high dose is better than that in conventional dose.
〔Keywords〕 intracerebral hemorrhage; peroxidation injury; ferroptosis; Naotaifang; neuroprotection
脑出血(intracerebral hemorrhage, ICH)是一种高致残率和致死率的常见脑血管疾病。大量ICH患者遗留严重的神经功能障碍,给家庭和社会带来沉重的负担。谷胱甘肽过氧化物酶4(glutathione peroxidase-4, GPX-4)是细胞内抗过氧化损伤的关键调控分子。研究表明,GPX-4功能失调将导致细胞内脂质活性氧(lipid-ROS)蓄积,从而导致细胞发生铁死亡[1-2]。铁死亡是一种以细胞内铁超载为主要诱发因素,以细胞抗氧化能力耗竭而致lipid-ROS累积为特征的新型细胞死亡方式[3]。研究证实,ICH后血肿周围存在神经细胞铁死亡病理改变,铁死亡抑制剂可减轻继发性脑损伤[4-5]。因此,探索有效的药物抑制神经细胞铁死亡,成为ICH治疗的新靶向。脑泰方是本研究团队负责人葛金文教授防治中风的专利处方(专利号:ZL201110178359.4)。前期研究表明,脑泰方可提高血红蛋白诱导的大鼠皮质神经元细胞抗氧化损伤能力[6],并可调节脑缺血大鼠神经细胞铁代谢而发挥神经保护作用[7-8];可降低血管内皮细胞脂质过氧化程度而发挥抗动脉粥样硬化作用[9]。此基础上,本研究通过对ICH急性期大鼠脑组织病理形态观察并进行神经功能缺失评分,同步检测抗氧化分子GPX-4和过氧化损伤标志分子lipid-ROS以及铁死亡标志分子环氧合酶-2(COX-2)的变化,并以铁死亡抑制剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)为阳性对照药物,进一步探讨脑泰方对ICH大鼠神经细胞过氧化损伤的干预作用及其机制。
1 材料
1.1 动物
健康清洁级SD大鼠,体质量200~250 g,购于湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2016-0002。大鼠饲养于SPF动物实验中心,温度22~24 ℃,湿度50%~60%,纯净水及高温高压灭菌饲料饮食,各组单笼喂养,12 h昼夜节律交替。本研究经湖南中医药大学第一附属医院实验动物伦理委员会审核通过(批准编号:ZYFY20190522),实验方案考虑安全和公平原则。
1.2 药物
脑泰方由黄芪40 g,川芎10 g,僵蚕15 g,地龙15 g组成,原药材购于湖南中医药大学第一附属医院(湖南春光总汇现代中药有限公司,货号分别为:ZY1359、ZY1448、ZY4834、ZY3917,经湖南中醫药大学第一附属医院中药饮片检验室鉴定验收)。将中药置于煎药器中,加10倍量蒸馏水,室温浸泡30 min后,武火煮沸,文火继续煎煮60 min,煎煮完毕后过滤;滤渣继续加8倍量水,武火煮沸后,文火继续煎煮40 min,过滤;合并两次滤液,转移至旋转蒸发仪中浓缩(80 r/min,70 ℃),浓缩至流浸膏,再转移至真空干燥箱中,制成浸膏粉,每克浸膏粉相当于4 g生药(操作由湖南中医药大学第一附属医院制剂室完成)。临用时用0.9%氯化钠溶液调配成2 g/mL浓度。阳性对照药NAC购于美国Sigma公司,货号:WXBCOO11V。
1.3 主要试剂
lipid-ROS试剂盒(南京建成生物工程研究所,货号:E004-1-1);GPX-4一抗(货号:PAB31461)、COX-2一抗(货号:PAB31107)均购自于武汉贝茵莱生物科技有限公司;poly-HRP anti Rabbit IgG(美国GBI公司,货号:E-IR-R211); Protein G Magnetic Beads(美国Cell Signaling 公司,货号:9006S);蛋白质Marker(美国Thermo公司,货号:26634);十二烷基硫酸钠(货号:151-21-3)、TEMED(货号:110-18-9)、过硫酸铵(货号A6761)均购自于美国Sigma公司;PVDF 转移膜(货号:IPVH00010)、化学发光试剂(货号:WBKLS0010)均购自于美国Millipore公司;Tween-20(美国Amresco公司,货号:P-1379)。
1.4 主要仪器
WP8025型脑立体定位仪(瑞沃德生命科技有限公司,深圳);NIKON Eclipse ci型倒置显微镜(OLYMPUS公司,日本);AUW120D型精密电子天平(Shimadzu公司,日本);DW-HL-3985型美菱超低温冰箱(中科美菱低温科技股份有限公司);Z32HK型台式高速冷冻离心机(英斯特科技有限公司,杭州);KS400型图像分析仪(ZISSE公司,德国);Tanon-5200型全自动化学发光分析仪(上海天能科技有限公司)。
2 方法
2.1 造模、分组和取材
2.1.1 造模 SD大鼠经水合氯醛腹腔注射麻醉,俯卧位固定于脑立体定位仪上(前囟和后囟处于同一水平)。常规备皮、消毒,参照文献方法[10],沿前囟旁开3 mm处作10 mm纵行切口,切开头皮及骨膜后暴露前囟,在前囟后1 mm、旁开3 mm处用微型钻作直径1 mm的小孔。消毒鼠尾,距末端0.5 cm处剪断,取自体血50 ?滋L,经定位仪上的微量注射器沿所钻骨孔进针6 mm,即为右侧尾状核的位置。在10 min内注入自体血50 ?滋L,注射完毕后停针5 min,缓慢退针,缝合切口。假手术组模型:制备步骤同上,不注入自体血,向大鼠尾状核注入生理盐水50 ?滋L。造模后3 h根据Zea Longa 5级评分法[11]进行模型评价并持续观察至造模后24 h,评分1~3分判定为造模成功。出现以下情形予以剔除:取脑组织标本时发现蛛网膜下腔出血者、未到实验取材时间死亡者,因上述原因致实验动物数量不足时,通过随机抽样原则及时补齐。
2.1.2 分组 符合以上ICH模型标准的60只大鼠分为5组,每组12只。分别为:假手术组、模型组、N-乙酰半胱氨酸(NAC)组、脑泰方常规剂量(NTFC)组、脑泰方高剂量(NTFH)组,各组分别于造模并给药干预7 d后取材。
2.1.3 给药 以60 kg成年人每日剂量80 g生药为依据,按体表面积换算,NTFC组给予2倍成人剂量,即20 g生药/kg,NTFH组给与3倍成人剂量,即30 g生药/kg,按所调配的浸膏粉浓度,分别为10、15 mL/kg;NAC组予以等效剂量NAC,5 g NAC用生理盐水稀释成100 mL,按200 mg/kg腹腔注射;脑出血模型组和假手术组均给予等量生理盐水灌胃;各组大鼠于造模后24 h开始给药,每日1次,连续给药7 d。
2.1.4 取材 于各组预定时间点将大鼠作常规灌注固定,断头取材。以注血针道为中心,冠位作厚约5 mm的切片标本,用4%多聚甲醛固定1 h,置于75%的乙醇中于零度以下冰箱中保存备用。
2.2 指标检测
2.2.1 脑组织病理学观察 取大鼠脑组织,常规制片后,行HE常规染色,光镜下观察脑组织病理改变。
2.2.2 神经功能缺失评分 根据Zea Longa 5级评分法评定[11]。0分:无神经损伤症状;1分:不能完全伸展对侧前爪;2分:向对侧转圈;3分:向对侧倾倒;4分:不能自发行走,意识丧失。
2.2.3 lipid-ROS含量 脑组织匀浆液制备:按脑组织重量(g):体积(mL)=1∶9的比例加入9倍体积的生理盐水,冰水浴条件下机械匀浆,2 500 r/min,离心10 min,取上清液按照试剂盒要求加样进行显色反应并测定OD值。Lipid-ROS计算:以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度;再乘以稀释倍数,即为lipid-ROS的实际浓度。
2.2.4 GPX-4、COX-2蛋白表达测定 免疫组化:严格按照试剂盒或说明书操作,制作封片后置于显微镜下观察,使用IPP图像分析仪软件分析观测的图像,随机选取4个高倍视野进行蛋白平均光密度值测定,作为蛋白的表达量。Western blot:采用RIPA快速裂解液处理组织碎片后进行蛋白提取和定量。配取5%浓缩胶12%分离胶并插好梳子,常规配胶与电泳(浓缩胶80 V,40 min,分离膠120 V,50 min)后进行转膜,90 V转膜50 min,常温封闭2 h后按说明书稀释抗体,GPX-4(1∶1 000)、COX-2(1∶1 000)、β-actin(1∶1 000)一抗与膜4 ℃孵育过夜,洗膜后加入HRP标记的二抗(1∶10 000),与膜室温孵育1 h,洗膜后用ECL化学发光试剂盒显影,通过TANON GIS软件读取相关条带灰度值,各蛋白目的条带灰度值与β-actin条带灰度值的比值作为各蛋白质的相对表达水平。
2.3 统计学方法
各组所得计量数据采用“x±s”表示,用SPSS 16.0软件进行统计分析,采用One-Way ANOVA检验比较各组间的显著性差异,其中方差齐者采用LSD检验,方差非齐者采用Dunnetts T3检验,P<0.05表示差异有统计学意义,P<0.01表示差异有显著统计学意义。
3 结果
3.1 各组大鼠脑组织病理形态改变
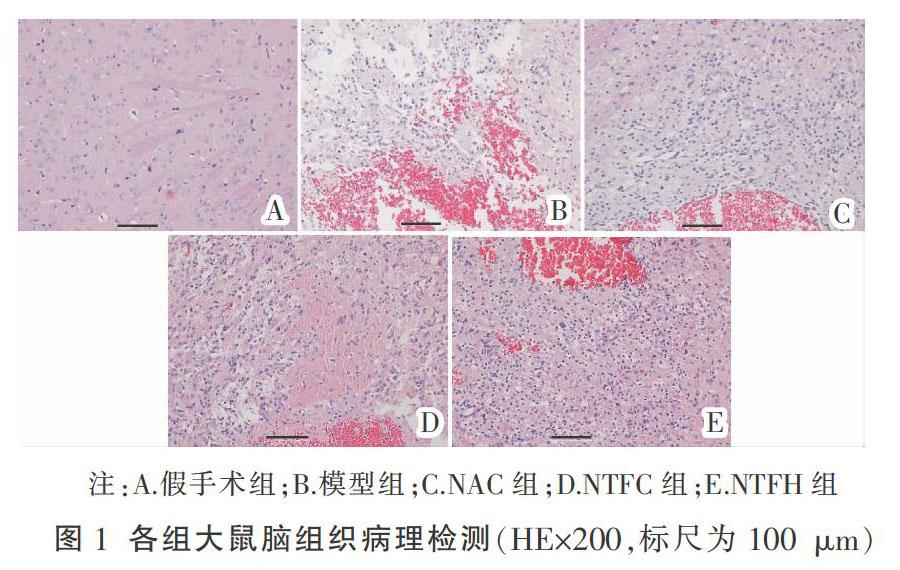
HE染色结果显示:假手术组大鼠术区脑组织未见明显病理损伤,神经细胞排列紧密整齐,细胞体大、胞核淡染、大而圆;模型组大鼠血肿周围脑组织出现明显水肿、坏死,细胞排列不规则、疏松,细胞外间隙增大,呈网状结构,大量炎性细胞浸润;NAC组及脑泰方各剂量组较模型组病理损伤明显减轻。见图1。
3.2 各组大鼠神经功能缺失评分
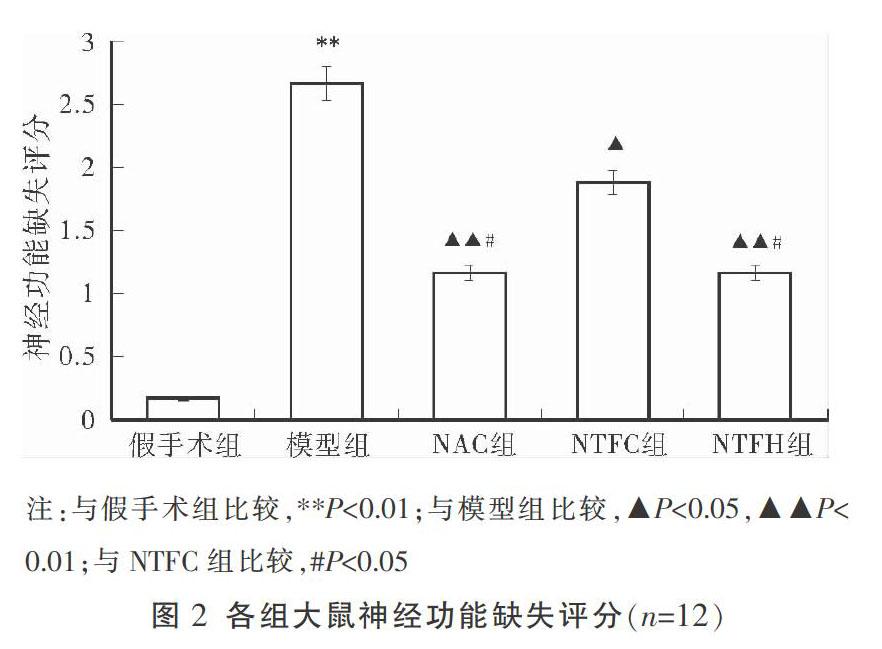
与假手术组比较,模型组大鼠的神经功能缺失评分明显升高,差异有统计学意义(P<0.01);与模型组比较,NAC组及脑泰方各剂量组大鼠的神经功能缺失评分均明显降低(P<0.05,P<0.01);NTFH组与NAC组神经功能缺失评分明显低于NTFC组(P<0.05)。结果见图2。
3.3 各组大鼠脑组织lipid-ROS含量
与假手术组比较,模型组大鼠病灶脑组织lipid-ROS含量明显升高,差异有统计学意义(P<0.01);与模型组比较,NAC组及脑泰方各剂量组lipid-ROS含量明显降低,差异均有统计学意义(P<0.01);NTFH组与NAC组lipid-ROS含量明显低于NTFC量组,差异均有统计学意义(P<0.05,P<0.01)。结果见图3。
3.4 各组大鼠GPX-4、COX-2免疫组化检测
免疫组化观察显示,GPX-4与COX-2主要在细胞质中表达,蛋白平均光密度检测显示:与假手术组比较,模型组大鼠病灶脑组织GPX-4表达明显降低,COX-2表达明显升高,差异均有统计学意义(P<0.01);与模型组比较,NAC组及脑泰方各剂量组GPX-4表达明显升高,COX-2表达明显降低(P<0.05,P<0.01);NAC组GPX-4含量高于NTFC组(P<0.01);NTFH组GPX-4含量与NTFC组差异无统计学意义(P<0.05);NAC组与NTFH组COX-2表达均明显低于NTFC组(P<0.05)。结果见图4-5。
3.5 Western blot检测GPX-4、COX-2蛋白表达
与假手术组比较,模型组大鼠病灶脑组织GPX-4表达明显降低,COX-2表达明显升高,差异均有统计学意义(P<0.01);与模型组比较,NAC组及脑泰方各剂量组GPX-4表达明显升高,COX-2表达明显降低(P<0.05,P<0.01);NTFH组和NAC组GPX-4表达与NTFC组无显著差异(P>0.05),而其COX-2表达明显低于NTFC组(P<0.05)。结果见图6-7。
4 讨论
中医药防治中风历史悠久,疗效肯定[12]。气虚血瘀、痰瘀阻络为ICH的主要病机之一[13]。临床研究表明,益气活血中药复方可促进ICH患者颅内血肿的吸收,减轻脑水肿,改善神经功能缺损,提高临床疗效[14]。脑泰方中黄芪大补脾胃之气,为君药;川芎活血行气,是为臣药;地龙、僵蚕通经活络、化痰熄风,两者均为佐药;全方共奏益气活血、化痰通络之效,对证“虚、痰、瘀”为核心的中医病机。本研究通过观察ICH急性期大鼠脑组织病理学改变,并进行神经功能缺失评分,结果显示:NTFC与高剂量脑泰方均可明显减轻大鼠脑组织脑水肿、坏死程度,减少神经元变性死亡,降低神经功能缺失评分,这与前期脑泰方在缺血性脑损伤中的研究结果一致[7-8]。进一步分析发现,高剂量脑泰方对大鼠脑组织病理损伤和神经功能缺失评分的改善作用优于脑泰方常规剂量,说明高剂量脑泰方的疗效优于其常规剂量脑泰方的疗效。
自2012年命名以来,铁死亡被证实与神经退行性病变、肿瘤、脑卒中等疾病的发生发展密切相关[15]。ICH后血肿的融解导致神经细胞铁超载,细胞内超载的铁离子通过fenton反应产生大量活性氧自由基,使细胞内谷胱甘肽氧化还原体系中GPX-4大量消耗,细胞有氧代谢产生的脂质氧化物不能被GPX-4清除,继而以类似Fenton反应的方式进一步产生大量lipid-ROS而使细胞发生铁死亡。研究证实,在ICH急性期抑制神经细胞铁死亡可发挥持久的脑保护效应[16],GPX-4是ICH后神经细胞铁死亡的关键调控分子,lipid-ROS是铁死亡发生的直接原因,COX-2可作为ICH后神经细胞铁死亡的标志物[5,17]。本研究结果显示,ICH模型组大鼠病灶脑组织GPX-4表达明显降低,lipid-ROS含量明显升高,说明ICH急性期大鼠脑组织GPX-4被大量消耗,lipid-ROS大量累积,导致神经细胞发生过氧化损伤;与此同时,神经细胞铁死亡标志物COX-2表达明显升高,研究结果与前期研究证实的铁死亡生物学过程吻合。因此,探索有效的药物减轻神经细胞过氧化损伤而抑制细胞铁死亡,是ICH潜在的治疗靶向。
研究表明,抗氧化剂NAC可上调胱氨酸/谷氨酸逆向转运体的活性,提高细胞抗氧化能力而抑制铁死亡[18]。本研究以NAC为阳性对照药物,结合脑泰方前期研究基础,进一步探讨脑泰方对ICH大鼠神经细胞过氧化损伤的保护作用及其机制。研究结果显示:脑泰方常规剂量和高剂量均可明显提高GPX-4的表达水平,降低lipid-ROS含量和COX-2表达,其作用与铁死亡抑制剂NAC一致;脑泰方高剂量组GPX-4的表达与NTFC组无显著差异,而其Lipid-ROS含量及COX-2表达水平均明显低于与常规剂量组,说明大剂量的脑泰方还可通过其他途径增强神经细胞的抗氧化损伤能力。
综上所述,脑泰方可通过提高神经细胞抗氧化体系中GPX-4的表达,减少lipid-ROS的累积,从而减轻神经细胞过氧化损伤,其作用机制与铁死亡抑制剂一致,提示脑泰方可抑制神经细胞铁死亡而发挥神经保护作用。高剂量脑泰方的作用优于常规剂量,推测脑泰方对铁死亡其他信号分子亦具有调控作用,如前期研究证实脑泰方可降低腦组织内兴奋性氨基酸毒性而发挥脑保护作用[19],与新近研究证实细胞内过多谷氨酸盐的分解可促进lipid-ROS的产生而诱发铁死亡相吻合[20],其多靶点神经保护机制有待进一步研究。
参考文献
[1] SEIBT T M, Proneth B, Conrad M. Role of GPX4 in ferroptosis and its pharmacological implication[J]. Free Radical Biology & Medicine, 2019, 133: 144-52.
[2] MIESS H, DANKWORTH B, GOUW A M, et al. The glutathione redox system is essential to prevent ferroptosis caused by impaired lipid metabolism in clear cell renal cell carcinoma[J]. Oncogene, 2018, 37(40): 5435-50.
[3] HIRSCHHORN T, STOCKWELLl B R. The development of the concept of ferroptosis[J]. Free Radical Biology & Medicine, 2019, 133: 130-43.
[4] ZIELL M, KARUPPAGOUNDER S S, CHEN Y, et al. Neuronal death after hemorrhagic stroke in vitro and in vivo shares features of ferroptosis and necroptosis[J]. Stroke, 2017, 48(4): 1033-43.
[5] LI Q, HAN X, LAN X, et al. Inhibition of neuronal ferroptosis protects hemorrhagic brain[J]. JCI Insight, 2017, 2(7): e90777.
[6] 曾劲松,喻坚柏,葛金文,等.脑泰方对血红蛋白诱导的大鼠皮质神经元损伤的保护作用及机制[J].北京中医药大学学报,2019,42(10):825-32.
[7] 黄 娟,廖 君,彭熙炜,等.脑泰方对脑缺血/再灌注大鼠海马区Nrf2、HO-1和膜铁转运辅助蛋白表达的影响[J].中国药理学通报,2017,33(10):1467-1472.
[8] LIAO J, XIA X, WANG G Z, et al. Naotaifang extract treatment results in increased ferroportin expression in the hippocampus of rats subjected to cerebral ischemia[J]. Molecular Medicine Reports, 2015, 11(6): 4047-52.
[9] 刘吉勇,朱惠斌,陈 懿,等.脑泰方对动脉粥样硬化兔氧化应激的影响研究[J].湖南中医药大学学报,2015,35(10):22-26.
[10] BARTH A, GUZMAN R, ANDRES R H, et al. Experimental intracerebral hematoma in the rat[J]. Restor Neurol Neurosci, 2007, 25(1): 1-7.
[11] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversiblemiddle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1):84-91.
[12] 宋鵬鹏,崔应麟,董天平.中医药治疗脑出血的研究进展[J].中医临床研究,2018,10(21):13-15.
[13] 于少泓,李万斌,刘昭纯.基于中风“气虚生痰、瘀阻脑络”病机假说的数据挖掘[J].中国中医基础医学杂志,2018,24(11):1514-1516.
[14] 郑翔鸿.益气活血中药复方治疗急性脑出血随机对照试验的系统评价[D].成都:成都中医药大学,2012.
[15] WEILAND A, WANG Y, WU W, et al. Ferroptosis and its role in diverse brain diseases[J]. Molecular Neurobiology, 2019, 56(7): 4880-4893.
[16] CHEN B, CHEN Z, LIU M, et al. Inhibition of neuronal ferroptosis in the acute phase of intracerebral hemorrhage shows long-term cerebroprotective effects[J]. Brain Research Bulletin, 2019, 153:122-32.
[17] ZHANG Z, WU Y, YUAN S, et al. Glutathione peroxidase 4 participates in secondary brain injury through mediating ferroptosis in a rat model of intracerebral hemorrhage[J]. Brain Research, 2018, 1701: 112-25.
[18] KARUPPAGOUNDER S S, ALIN L, CHEN Y, et al. N-acetylcysteine targets 5 lipoxygenase-derived, toxic lipids and can synergize with prostaglandin E2 to inhibit ferroptosis and improve outcomes following hemorrhagic stroke in mice[J]. Annals of Neurology, 2018, 84(6): 854-72.
[19] 贺运河,葛金文,郝晓元,等.脑泰方对缺血再灌注沙鼠脑组织谷氨酸及其转运体功能的影响[J].中国实验方剂学杂志,2002(4):28-30.
[20] GAO M, MONIAN P, QUADRI N, et al. Glutaminolysis and transferrin regulate ferroptosis[J]. Molecular Cell, 2015, 59(2):298-308.
