40例胃神经内分泌肿瘤的临床病理特征及预后分析
2020-08-12王淑娟
王淑娟
(黄梅县人民医院,湖北 黄梅)
0 引言
胃神经内分泌肿瘤(gastric neuroendocrine neoplasms,g NEN)在我国临床上是一种较为常见的消化系统神经内分泌肿瘤 (neuroendocrine neoplasms,NEN),且发病人数在逐年上升[1]。目前,胃镜技术是治疗g NEN最安全有效的一种方法,但由于g NEN的临床症状不典型,这就会增加临床诊断的难度,从而延误患者最佳的治疗时机[2]。为此,该项研究主要针对胃神经内分泌肿瘤的临床病理特征及预后影响因素,随机纳入了我院40例胃神经内分泌肿瘤患者开展了相关研究。
1 资料与方法
1.1 一般资料
选取2016年1月至2018年1月入我院治疗的40例胃神经内分泌肿瘤为研究对象,男26例,女性14例。发病年龄在32~82岁,平均年龄57岁。首发症状:21例为腹痛、腹胀,3例表现为吞咽困难;5例为呕吐;5例为无症状;其余6例为无典型首发症状。通过胃镜检查与病理诊断报告表明:肿瘤位置集中在贲门、胃体、幽门,分别为12例、24例、4例。病理学分级:G1级NET5例;G2级NET6例;G3级29例,神经内分泌癌(neuroendocrine carcinoma,NEC)与混合性神经内分 泌 癌 (mixed adenoendocrine carcinoma,MANEC)分别为12例、11例。肿瘤直径范围与中位直径分别为0.3~11cm, 3.6cm。其中,有19例患者被检查出肿瘤远处转移。
1.2 方法
1.2.1 病理学诊断标准
诊断标准为2010年WHO消化系统神经内分泌肿瘤分类标准,并由2名专业的病理医师对诊断结果进行复核[3]。
1.2.2 治疗方法
此次研究的40例患者均接受手术治疗,其中13例患者选择内镜下粘膜切除术,4例患者行局部切除术,19例患者选择根治性手术。术后共出现5例并发症,2例切口感染、1例吻合口瘘、腹腔积液与肺部感染各1例,手术均十分顺利。术后,患者各项生命指标稳定,并逐步恢复正常。在治疗期间,有4例患者未选择手术治疗,1例肿瘤发生远处转移,3例患者因基础疾病较多,选择保守治疗。患者出院一段时间后,我院对研究患者进行电话随访,获取其生存资料,截止时间为2019年1月。
1.3 统计学分析
采用SPSS 22.0软件对计量资料与技术资料实施统计学分析,分别用t与χ2检验。采用Kaplan-Meier法绘制患者生存曲线,应用log-rank对患者生存情况进行分析。利用Cox回归模型开展多因素分析。检验水准a=0.05。
2 结果
分析随访结果可知,患者的中位生存时间为47月,1、3、5年的生存率呈现出逐年下降的趋势,由最初的88.2%下降至后续3年、5年52.5%、36.3%,详细情况参考图1。应用内镜下粘膜切除术治疗的13例G1,G2期患者,只有1例死亡,无统计学意义(P>0.05),如图2。单因素分析结果表明:影响g NEN预后的主要相关因素为肿瘤分级、肿瘤直径、肿瘤位置、肿瘤类型、肿瘤浸润深度、淋巴结转移、TNM分期及远处转移,P<0.05),见表1。多因素分析结果表明:影响g NEN预后独立因素为肿瘤分级、远处转移以及TNM分期,(P<0.05),见表2。
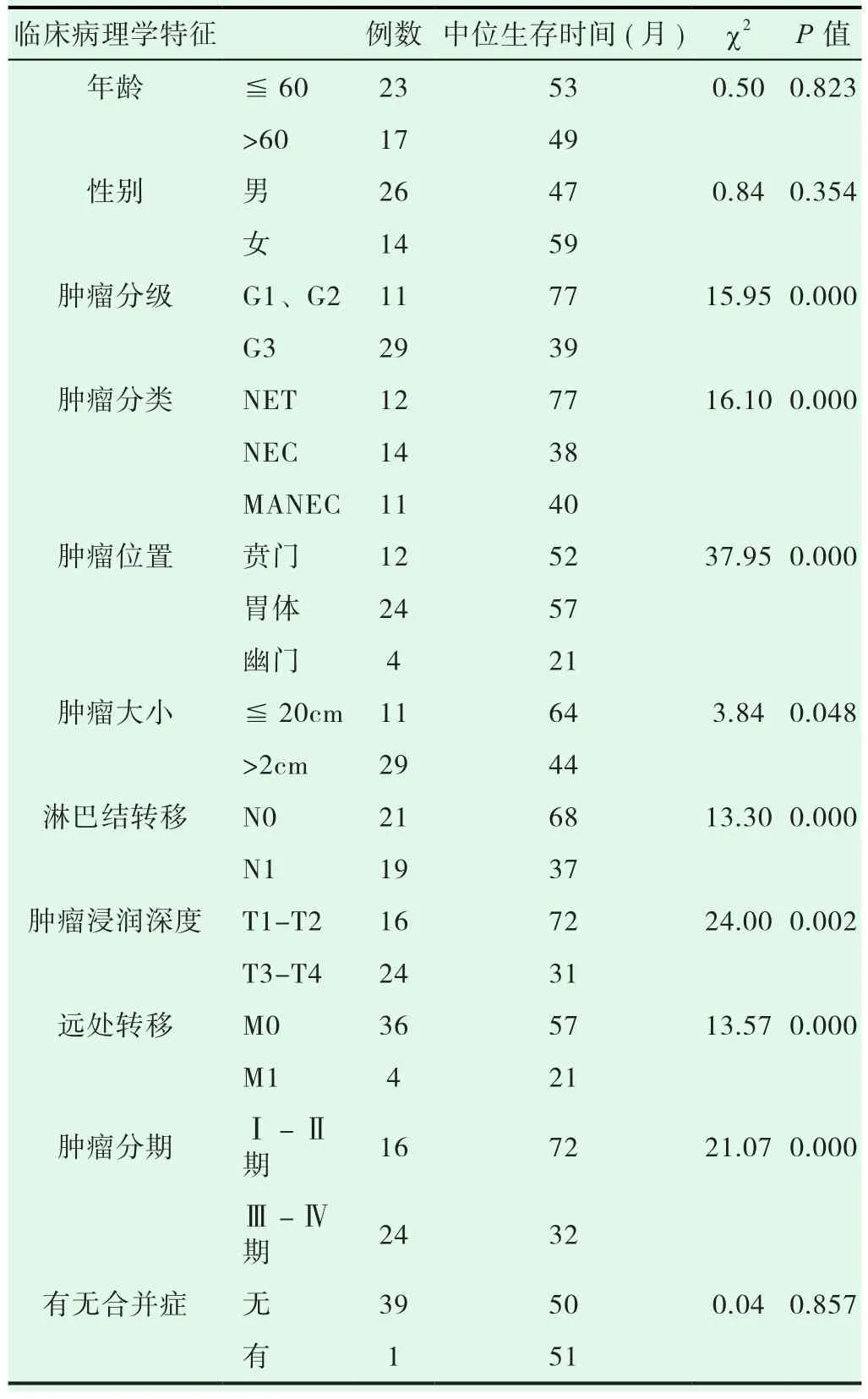
表1 40例手术 g NEN 患者单因素分析结果
3 讨论
据多年的临床数据显示,大部分g NEN患者均无明显的首发症状,这就会在一定程度上增加临床诊断的难度,提高误诊率[4]。在此次研究中,数据统计显示有15.0%的g NEN患者没有明显的首发症状,其诊断结果是临床上采用常规内镜检查而给出的。同时,TNM分期中III-IV期患者的检出数量也相对较多,这进一步表明,g NEN的早期诊断情况并不乐观。另外,由于g NEN肿瘤的起源不同,因此其生物学行为方面也会存在较大的差异。努尔买买提·麦麦提吐尔逊,麦麦提艾力·图尔荪,张文斌在其研究报告中表明[5],男性g NEN的发病率要明显高于女性,且年龄在60岁以上人群为g NEN的高发人群。此次研究中,男性患者的比例要显著高于女性,这与其得出的结论相一致。针对g NEN的好发部位,关新红,马兰英,吴莉等[6]在研究中指出,胃体为g NEN的常见病灶,该结论与本次研究中肿瘤位于胃体占60.0%的结果十分相近。而对于g NEN高发年龄段为50~60岁,中位年龄为58岁,受样本数量的限制,目前还得不到明确的论证。
据相关统计数据资料显示,我国g NEN的发病率在以每年7.3%的速度持续增长,这可能与当前胃镜检查与影像诊断技术快速发展有着较为紧密的联系。目前,我国临床上用于诊断g NEN疾病的主要方法有三种,分别为内镜活检病理学、免疫组化检测以及镜下活检病理学,其中涵盖最大腺瘤活检的是内镜下取活检。在诊断期间,突触素与嗜铬粒素A是测定神经内分泌肿瘤最为关键的指标,而细胞增殖活性是借助显微镜下Ki-67指数与核分裂像数目共同测定的[7]。该项研究中,患者在内镜检查时采取的是常规的取活检,术后标本接受了常规的免疫组化检查,肿瘤增殖活性也是通过Ki-67指数与核分裂像数目来进行确定的,这完全符合病理学诊断标准。另外需要检查人员注意的是,针对直径>1~2cm的NET G级患者,要对其实施超声内检查;同时,由于NET G2级患者的胃泌素瘤会分泌大量的激素,因此极易合并发生高胃泌素血症,因此要选择全身影像学检查,有效提高诊断准确率。

图1 全组患者生存曲线

图2 选择内镜下切除术患者生存曲线
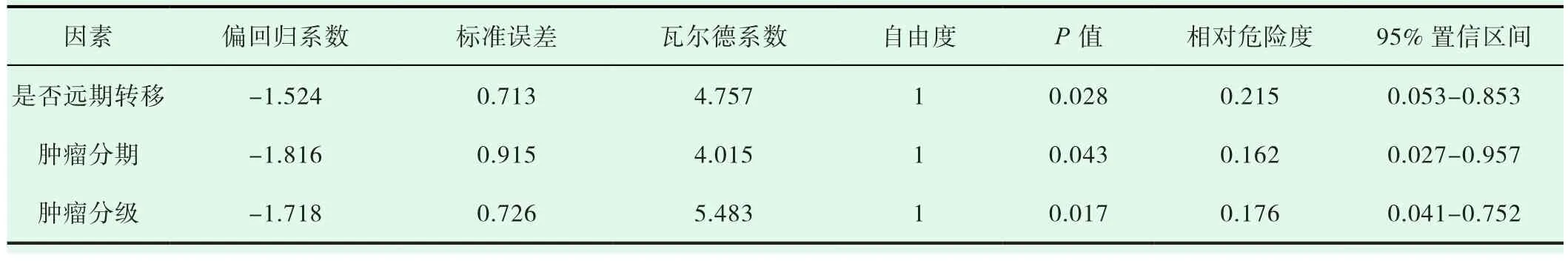
表2 胃神经内分泌瘤患者多因素分析结果
目前,治疗g NEN最有效的方法就是手术,但手术方式的选择要根据患者的具体的肿瘤分级、肿瘤浸润深度等临床病理学特征来进行确定[8]。此次研究数据显示,通过内镜下粘膜切除术治疗,13例G1、G2期患者中仅有1例死亡病例(P>0.05)。由此可知,直径≤ 2cm的T1期神经内分泌瘤G1、G2级的患者选择内镜下粘膜切除术治疗相对安全有效[9]。针对部分已经发生远处转移的g NEN患者,由于其身体耐受性已经相对较差,因此要选择保守治疗,并采用顺铂(DDP)联合依托泊苷(Etoposide)这一化疗方法来尽可能的延长患者短期内的生存时间。除此之外,通过Cox多因素分析结果证明,影响g NEN预后独立因素主要为肿瘤分级、TNM分期与远处转移。皮洪涛,刘毅的研究结果表明[10],I、II期的g NEN患者,其5年生存率高于III、IV期的g NEN患者。
综上所述,由于g NEN在我国临床上的发病数量还相对较少,因此其并无典型的临床症状,这就会大大增加临床诊断的难度。为此,临床医师要精准掌握g NEN的临床病理学特征,以此来大大提升g NEN疾病的早期诊断准确性,科学指导后续治疗工作的有序开展。
