肠道菌群调节睡眠作用机制研究进展
2020-08-12归萌宿文昱裴浩田卢丹
归萌,宿文昱,裴浩田,卢丹
(吉林大学药学院,吉林 长春)
0 引言
睡觉,是人类不可缺少的一种生理现象,睡眠占人的一生中近1/3的时间。睡眠质量好坏与人体健康有密切关系。长期睡眠不足会导致许多疾病,如记忆力下降[1]、糖尿病[2]、肥胖[3],甚至产生癌变[4]。但是超过10小时的睡眠比睡眠不足危害更大,可引发糖尿病、心血管疾病、焦虑和肥胖等问题。因此,保持一个均衡良好的睡眠至关重要。影响睡眠的因素有很多,包括环境因素、生理因素、心理因素、躯体疾病、精神疾病等。近年来,大脑和胃肠道系统之间关系的研究越来越多,很多中枢系统的疾病都发现和消化系统有密切的关系。越来越多的研究表明肠道菌群不仅和消化过程有关,还与睡眠剥夺、糖尿病、高血压以及酒精性肝纤维化等疾病存在直接或间接的联系[5-7]。肠道菌群可以通过脑肠轴(Microbiota gut brain)以多种方式影响睡眠及相关的生理功能,主要有(1)影响体内神经递质的水平;(2)调节体内的激素分泌;(3)释放具有调节睡眠作用的代谢物[8]。一方面,肠道菌群能改变昼夜节律和睡眠-觉醒周期等。同时,睡眠不足也会引起生理应激反应而扰乱肠道微生物菌群的正常功能,进而影响人的代谢和免疫能力[9,10]。
了解肠道菌群与睡眠的相互作用及其机制,有利于重新认识睡眠相关疾病的发生发展,优化治疗方案,提高睡眠障碍患者的生活质量。本文对近年肠道菌群与睡眠相互影响的研究情况进行了分析整理,以期为探索新的治疗方案和新药研发做出贡献。
1 影响体内神经递质水平
肠道中的细菌既能调节神经递质的分泌,也能产生某些神经递质,主要包括5-HT、GABA、Glu、DA或NE[11,12,13],这些神经递质通过作用于迷走神经[14,15]、脑肠轴[16,17],发挥调节睡眠的作用。
现有研究表明,肠道中的许多细菌能产生5-HT、GABA、Glu、DA和NE等神经递质[11,12,13]。5-HT是非常重要的自体活性物质,除了调节脑神经外,还是胃肠道和其他器官系统的重要调节因子。多项研究表明,5-HT的主要作用是促进觉醒,抑制REM(Rapid Eye Movement)睡眠[18,19]。人体超过90%的5-HT合成和分布于肠嗜铬细胞(enterochromaffin cells,ECs),在肠道中,肠道菌群可以通过促进肠嗜铬细胞释放5-HT,进而改善睡眠质量[20]。在一项使用非靶向和靶向液相色谱(LC/MS)代谢组学检测急性睡眠剥夺对血浆代谢物节律影响的实验发现,在睡眠剥夺大鼠的海马体、背侧中缝核和视交叉上核(Suprachiasmatic nucleus,SCN)中的5-HT水平较高[21]。GABA作为抑制性神经递质,具有促进睡眠的作用。有研究证实在原发性失眠患者脑内GABA含量明显低于正常人[22]。Barrett等人[12]发现双歧杆菌、短乳杆菌可以产生GABA。Glu是中枢神经系统中主要的兴奋性神经递质,可以通过兴奋Orexin神经元以及胆碱能神经元来提高大脑皮层的觉醒状态[23]。有研究发现[24]粪便中棒状杆菌科、红椿菌科和伯克氏菌科的相对丰度与Glu水平呈正相关。DA作为脑内重要的神经递质参与了睡眠-觉醒周期的调控,DA分泌过多会促进觉醒,减少睡眠时间。Stanaszek等人[12]证实芽孢杆菌可以产生DA。分别给予大鼠不同剂量 (2.5、5、10、20mg/kg)的 DA 转运体抑制剂GBR12909,发现可剂量依赖性增加小鼠的觉醒水平[25]。NE一直被认为在调节觉醒状态方面发挥着关键作用。Shouse等人[26]发现,NE浓度在清醒时高,在NREM(Non-rapid Eye Movement)睡眠时低。最近利用无菌动物研究发现,无菌小鼠盲肠和组织中NE水平明显降低,并且盲肠NE水平可以通过菌群定植或46种梭状芽孢杆菌的混合来恢复[27]。这一发现有力地表明,微生物群会影响腔内NE的水平。
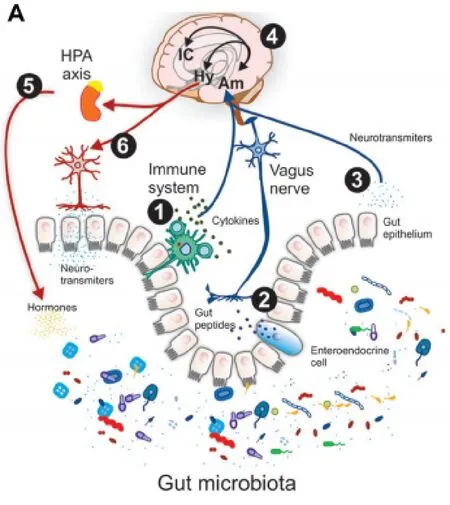
图1 脑肠轴. 肠道菌和中枢神经系统相互作用途径(内分泌、免疫和神经系统)[16]
肠道微生物产生的神经递质既可以从肠道吸收进入门静脉循环,也可以直接与肠神经系统的部分受体相互作用,这些神经递质一旦进入门静脉循环,便可以影响神经系统的组成部分,最终影响大脑[11]。当然,这不只是肠道到脑的单向通信,因为大脑和胃肠道之间可通过涉及神经、内分泌、免疫等多个系统相互作用的脑肠轴(见图1)进行沟通[28]。
2 调节激素分泌
研究表明肠道菌群可以通过调节MT、CRF等相关激素的分泌,改善睡眠质量。褪黑激素是一种广泛存在于脊椎动物体内的激素[29],它在胃肠道粘膜的肠嗜铬细胞中合成[31],主要参与昼夜节律、情绪调节、生殖和免疫等许多生物过程[30]。近年来的研究表明,失眠与MT分泌减少和MT受体表达下调密切相关[32]。经实验证明,MT通过抑制促肾上腺皮质激素释放激素的释放,对脑-肠轴系统中的下丘脑-垂体-肾上腺轴(HPA)轴进行负反馈调节,从而治疗睡眠障碍[33]。WANG等人[31]研究了褪黑素受体表达与肠道菌群的相关性,发现移植了健康人体粪便的无菌小鼠结肠褪黑素受体的表达显著增加,并且粪菌移植小鼠结肠褪黑素受体表达与产短链脂肪酸(short-chain fatty acid,SCFA)细菌如Alistipes、Blautia呈正相关。肠道中的益生菌(如乳杆菌类、双歧杆菌类以及革兰氏阳性球菌)之所以能改善睡眠质量,一方面是因为益生菌能促进MT的分泌[34];另一方面,肠道中的益生菌可以分解食物中的蛋白质产生能形成5-HT的色氨酸,经转化成血清素,最后形成MT[35],MT激活GABA合成酶,促进GABA的释放,使得睡眠时间延长,睡眠潜伏期缩短。此外,CRF也是目前研究较多的调节NREM睡眠时程和慢波活动的激素释放激素之一,给予CRF会减少NREM睡眠。通过一个研究幼年大鼠腹腔注射CRF拮抗剂的实验发现,腹腔注射任意剂量CRF拮抗剂都会使幼年大鼠的REM睡眠显著减少,而NREM睡眠显著增加[36]。Shigeo等人[37]用肠内共生菌(包括大肠杆菌、梭状芽胞杆菌、普通拟杆菌、变种梭杆菌和德布鲁克斯乳杆菌)刺激人树突状细胞产生CRF,发现CRF在mRNA水平和蛋白水平上均显著增强,特别是普通拟杆菌刺激人类树突状细胞后,CRF含量极高。
肠道菌群还可调节肠道内分泌细胞的分泌功能,激活HPA轴,促进MT、CRF等激素的合成和分泌,直接或间接作用于中枢[38,39],完成大脑和胃肠道之间的信息交流,从而改善睡眠。
3 释放代谢物
肠道微生物还可借助丁酸盐以及脂多糖和肽聚糖等肠道菌代谢物与免疫系统的交流,释放出IL-1、IL-6、TNF-α等促炎性细胞因子,对睡眠机制进行调节。有证据[20]表明肠道菌群代谢物丁酸盐与睡眠有关。丁酸盐作为一种短链脂肪酸,是肠道中未消化碳水化合物通过厌氧菌发酵产生,是肠道梭菌群的主要代谢产物[40],与睡眠质量呈正相关。Szentirmai等人[41]以小鼠为模型,研究了经口服给药和门静脉注射丁酸盐对小鼠睡眠质量的影响。结果表明,口服丁酸盐的前药三丁酸三丁酯4小时后小鼠NREMS增加了近50%,门静脉内注射丁酸盐6小时后,NREMS增加了70%。另外,肠道微生物与位于小肠内的免疫系统一直相互影响,这种影响主要通过肠道菌群代谢物、迷走神经和肠道中微生物相关物质的释放实现[42]。已有研究表明,白细胞介素Ⅰ(IL-1)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)等促炎性细胞因子的表达水平可随机体睡眠节律的改变而改变[43]。促炎性细胞因子IL-1可以缩短老年脑的REM睡眠时间[44],老年体内升高的促炎性细胞因子IL-Ⅰ水平升高,其睡眠质量下降,总觉醒时间延长[45]。TNF是由巨噬细胞分泌的一种小分子蛋白,分为TNF-α和TNF-β两种。TNF-α主要由单核-巨噬细胞分泌,主要通过NF-κB激活多种炎症通路,NF-κB是一种可以激活一氧化氮合酶、环氧化酶2和腺苷A1受体的转录因子,而这些受体又与睡眠调节有关,从而可以促进睡眠行为的产生[46,47,48]。脂多糖和肽聚糖[8]是细菌细胞壁的组成部分,细菌崩解或细胞分裂期间会释放脂多糖和肽聚糖片段,刺激产生促炎性细胞因子[49],引起嗜睡反应[8]。这就表明来自肠道细菌衍生的抗炎性信号具有调节睡眠的潜力。
肠道菌群作为人体内的一个“新系统”和“新器官”,参与了机体的各种生理病理过程,通过神经递质、激素以及代谢产物等参与昼夜节律、睡眠-觉醒周期的调节。睡眠不足患者的肠道菌群发生改变,而肠道菌群改变也会影响睡眠质量,它们之间的关系已经成为目前的研究热点。尽管研究已经表明肠道菌群可以通过脑肠轴系统影响睡眠质量,但仍然存在许多需要更加深入了解的地方,其一,神经递质、激素和代谢物对于睡眠的调控是它们共同作用的结果,但具体是如何联合作用的尚不清楚。其二,目前关于肠道菌代谢物只有丁酸盐对于睡眠的影响作用比较清楚,其他代谢物对于睡眠有影响仍需探究。因此,关于肠道菌群与睡眠关系仍有待于深入研究。
