DACH1 在肝癌中的生物学作用及机制
2020-08-12陈晓星戈佳云施智甜郭志唐赵松凌王连敏
陈晓星,翟 广,戈佳云,魏 东,施智甜,郭志唐,王 滔,赵松凌,王连敏,王 琳
(昆明医科大学第二附属医院肝胆外科,云南昆明 650101)
原发性肝癌(Primary carcinoma of the liver),简称肝癌,是原发于肝脏的上皮性恶性肿瘤,其中超过90%的肝癌为肝细胞癌,每年约有70 万新患者被确诊[1-2]。原发性肝癌目前是我国第4 位常见恶性肿瘤,肝细胞癌严重危害我国人民的身体健康,也给社会及人们带来巨大的损失[3-4]。就目前,肝癌的治疗主要包括根治性治疗和姑息治疗。根治性治疗包括肝脏移植、手术切除和局部消融治疗;姑息性治疗如药物治疗、放疗、化疗等。但许多肝癌患者在发现时即为中晚期,能接受的治疗方式十分有限[5-7]。因此,阐明肝癌的发病机制、寻找敏感和特异的肝癌早期分子诊断标志物,将有利于肝癌的早期诊断和及时治疗,对提高患者治愈率和生存率具有重要意义。
人类Dachshund1(DACH1)基因是果蝇Dac基因的同源基因,位于染色体13q22,其编码的蛋白质主要分布于细胞核内。可以通过与c-Jun、Smads、Six 和ER 等转录因子相互作用,在基因转录调控方面发挥重要功能[8-9]。DACH1 作为正常生理过程中血管重塑及上皮细胞迁移等作用的重要调控因子[10],在乳腺癌、子宫内膜癌、卵巢癌,乳腺癌,前列腺癌、等多种肿瘤中作为肿瘤抑制因子,且有许多证据显示其可作为多种肿瘤预后的标志物[11-12]。本研究进一步探讨DACH1 在肝癌中的生物学作用及其作用机制,以期为肝癌的早期诊断、治疗和预后评估提供帮助。
1 材料与方法
1.1 实验材料
正常肝细胞株LO2;以及三株肝癌细胞系(HepG2、Hep3B、Huh7)由中国科学院昆明动物研究所提供。
成年雄性BALB/C-nu/nu 小鼠,体重(18±2)g,由昆明医科大学实验动物学部提供。
1.2 临床样本采集
样本来源于2019 年5 月至2020 年2 月昆明医科大学第二附属医院肝胆外科行根治性肝癌切除术的HCC 患者30 例,纳入标准:临床资料完整;术前均无其他治疗,如TACE、免疫治疗等,患者已签订知情同意书,并且该实验临床样本通过了昆明医科大学第二附属医院伦理学审查。
1.3 药品及试剂
碧云天生物技术有限公司的检测蛋白浓度BCA 试剂盒(上海);索莱宝科技有限公司的HE(苏木素-伊红)试剂染色盒(北京);DACH1 抗体、CyclinD1 抗体、CDK4 抗体、CyclinE1 抗体、CDK2 抗体购自Abcam 公司;SP 免疫组化检测试剂盒(北京中杉金桥科技公司);DMEM 培养基、胎牛血清和Lipofectamine2000TM购自Thermo Fisher Scientific 公司;CCK8 试剂盒购自日本同仁公司,PI 染色试剂盒购自BD 公司,DACH1 慢病毒表达载体购自复能公司。
1.4 免疫组织化学染色
石蜡切片由4 ℃取出复温2 h,再烤片60℃1 h。二甲苯中脱蜡,依次放入100%、95%、85%、75%乙醇和ddH2O 中水化。然后,放入3%的甲醇过氧化氢液中,室温静置20 min。高压修复,冷却至室温。覆盖50 μL 封闭液(1%BSA),37 ℃封闭30 min 后,去除封闭液,覆盖DACH1 一抗(1:200)4℃过夜。第2 天取出后,室温复温15 min,加SP 免疫组化试剂盒中二抗,37℃孵箱孵育30 min,滴加现配的DAB 显色液,苏木素染液复染梯度酒精脱水、二甲苯(15 min),取出切片晾干后,用中性树脂封片,免疫组化每张切片选取中心和4个周边共计5 个高倍视野观察,用Image-pro Plus 6.0 软件计算阳性比率。
1.5 细胞培养
所有的肝癌细胞系和用于包装的293T 细胞都是来自中国科学院昆明动物研究所。所有细胞在DMEM 培养基中补充10%的胎牛血清中,细胞在37℃5% CO2培养箱中培养。细胞转染使用Lipofectamine2000TM。
1.6 慢病毒包装和感染
使用的DACH1 慢病毒表达载体采用复能公司病毒包装系统通过293T 细胞包装DACH1 过表达和对照慢病毒。采用慢病毒液和培养基1:1 比例感染肝癌细胞,在感染72 h 后收集细胞并进行Western blotting 以评估DACH1 蛋白的表达。
1.7 Western blotting 分析
通过Western blotting 检测肝癌细胞系:LO2、HepG2、Hep3B、Huh7。简要地说,使用RIPA 裂解液提取细胞总蛋白,然后,蛋白质用BCA 蛋白测定试剂盒定量。然后,样本通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,然后转移到聚偏二氟乙烯膜。β-肌动蛋白为内参对照,用5%的无脂牛奶封闭,一抗体分别孵育:小鼠抗DACH1 抗体(1:1000),小鼠抗β-Actin 抗体(1:5 000)。然后将膜与二抗一起孵育(山羊抗小鼠IgG)。后进行显影,曝光。蛋白条带使用Image J 软件进行灰度分析并计算相对蛋白表达。
1.8 细胞增殖测定
使用CCK8 估算存活细胞的数量。感染后24 h,HepG2 细胞接种在96 孔板中。含有10%FBS的培养基,密度为2 000 个细胞/孔。为了定量细胞活力,将培养物染色在24、48、72、96 h 后每孔添加10 μL CCK8 溶液在37℃下孵育2 h,之后吸光度是在450 nm 下使用酶标仪检测OD 值。
1.9 细胞周期分析
感染48 h 后,两者胰蛋白酶消化后收集漂浮细胞和贴壁细胞用冰冷的PBS 洗涤;然后在-20℃使用70%的PBS 乙醇将细胞固定过夜。固定细胞然后用20 μg/mL RNaseA 和50 μg/mL 处理碘化丙锭在室温下放置30 min;然后将染色的细胞立即染色使用Accuri C6 流式细胞仪。使用随附的软件分析数据,以及平均值和标准偏差-进行计算。每个样本1 0000个细胞,并将实验重复三遍。
1.10 细胞周期相关蛋白质通过Western blotting分析检测(方法同2.3 部分)
感染48 h 后进行周期相关蛋白检测,一抗体分别孵育:小鼠抗CyclinD1 抗体(1:2 000);小鼠抗CDK4 抗体(1:1 000);小鼠抗CyclinE1 抗体(1:1 000);小鼠抗CDK2 抗体(1:500)。
1.11 裸鼠成瘤实验
BALB/C-nu/nu 小鼠8 只裸鼠随机分为两组:a慢病毒对照HepG2 细胞组;b 表达DACH1 慢病毒HepG2 细胞组。将感染的HepG2 细胞(2×106)重悬100 μL 的无血清DMEM 中,相同体积的基质胶混合后皮下注射接种到BALB/ C 裸鼠一个点。接种第10 天肿瘤形成按照第0 天开始测量肿瘤大小,按照第3、6、9 天测量肿瘤大小,肿瘤的长径(a)和短径(b)进行测量,然后使用公式V=1/2a×b2。第9 天对动物实施安乐死,并取出肿瘤,称重并进行免疫组织化学观察DACH1 表达情况。
1.12 统计学处理
2 结果
2.1 DACH1 在肝癌组织中的表达水平
免疫组化染色后,DACH1 阳性呈棕黄色,且定位于细胞核,HCC 癌组织中DACH1 的表达低于癌旁组织(图1)。Normal 组与术HCC 癌组织相比有统计学差异(61.87 ± 1.771)vs (28.79 ±2.079),P<0.05。
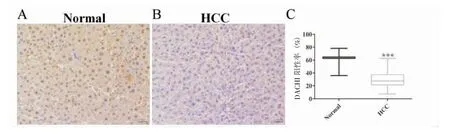
图1 HCC 患者癌组织和正常组织中DACH1 的表达(×200)Fig.1 Expressions of DACH1 in cancer and normal tissues of HCC patients (×200)
2.2 DACH1 在肝癌细胞中的表达水平
研究DACH1 在肝癌细胞中的表达水平,正常肝细胞株LO2;以及三株肝癌细胞系(HepG2、Hep3B、Huh7)分析。结果显示所有细胞系均表达DACH1,正常细胞水平高于肝癌细胞水平。另外,我们的结果表明在HepG2 细胞系中DACH1 的表达明显低于其他细胞系,见图2。
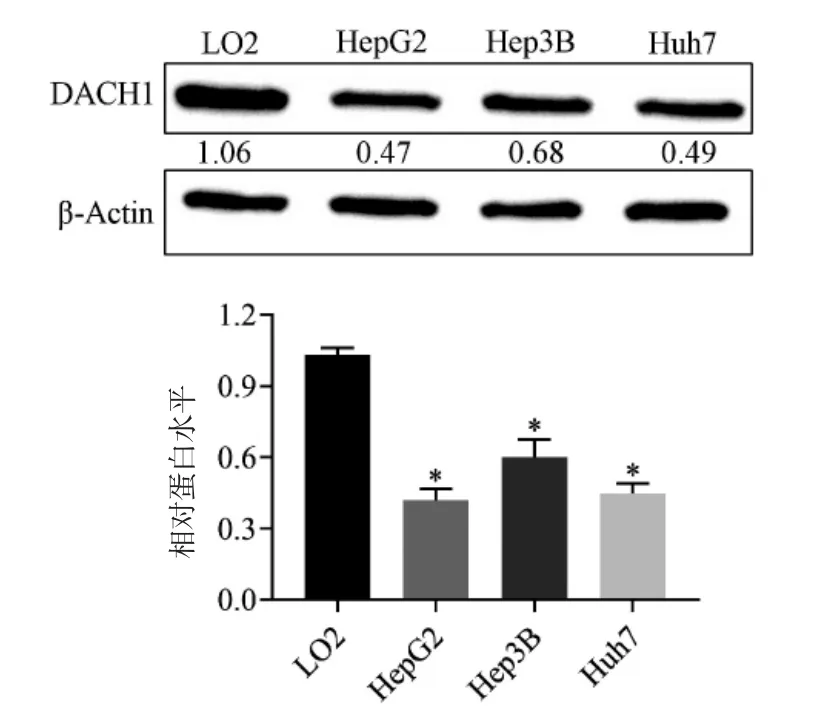
图2 通过蛋白质印迹检测DACH1 蛋白水平Fig.2 DACH1 protein levels detected by Western blotting
2.3 DACH1 蛋白表达抑制HepG2 细胞增殖
蛋白质印迹分析检测表达DACH1 慢病毒感染和对照病毒感染的HepG2 细胞中DACH1 蛋白表达情况,根据结果,DACH1 显着在DACH1 慢病毒感染中过表达(图3A)。
使用CCK8 法测定DACH1 慢病毒感染和对照病毒感染的HepG2 细胞的增殖。分别在24、48、48,96 h 测定OD 值,结果显示DACH1 慢病毒感染细胞增殖明显低于对照病毒感染细胞,表明高表达DACH1 的细胞生长是明显被抑制(图3B)。
2.4 DACH1 上调影响HepG2 细胞周期分布
慢病毒感染后48 h 后通过流式细胞术检测HepG2 细胞周期分布。结果显示被DACH1 上调细胞表现出G0/G1 期细胞较多,而S 期细胞较少与对照感染的细胞相比(52.80±3.18)vs(67.82±2.41),P< 0.01;(32.77±1.94)vs(22.91±1.90),P< 0.01。G2/M 期两者之间没有明显区别(图4)。
2.5 DACH1 上调影响HepG2 细胞周期相关蛋白表达情况
慢病毒感染后48 h 后通过蛋白质印迹分析检测HepG2 细胞周期相关蛋白CyclinD1、CDK4、CyclinE1、CDK2。结果显示被DACH1 上调细胞表现出周期相关蛋白CyclinD1、CDK4、CyclinE1、CDK2 表达都下调,与对照慢病毒感染的细胞比较[(0.78±0.04)vs (0.42±0.06),P< 0.01];[(0.56±0.03)vs (0.36±0.05),P< 0.05];[(0.64 ±0.03)vs(0.27 ±0.02),P< 0.01];[(0.71±0.07)vs(0.47±0.06),P<0.05],见图5。
2.6 DACH1 上调有助于抑制肿瘤生长
检测DACH1 在肿瘤生长作用,用表达DACH1,对照的慢病毒,并接种到BALB/C 裸鼠的皮下。由DACH1 感染的细胞导致的肿瘤重量大约减轻了三倍与对照感染细胞比。通过肿瘤形成后0、3、6、9 d 测量肿瘤体积可见DACH1 感染的细胞肿瘤生长速度明显减慢(图6A)。免疫组化染色后,DACH1 阳性呈棕黄色,且定位于细胞核(图6B),DACH1 感染的细胞接种的肿瘤中DACH1 的表达高于对照感染细胞接种的肿瘤有统计学差异[(5.89±0.23)vs(16.77±0.79),P<0.01]。
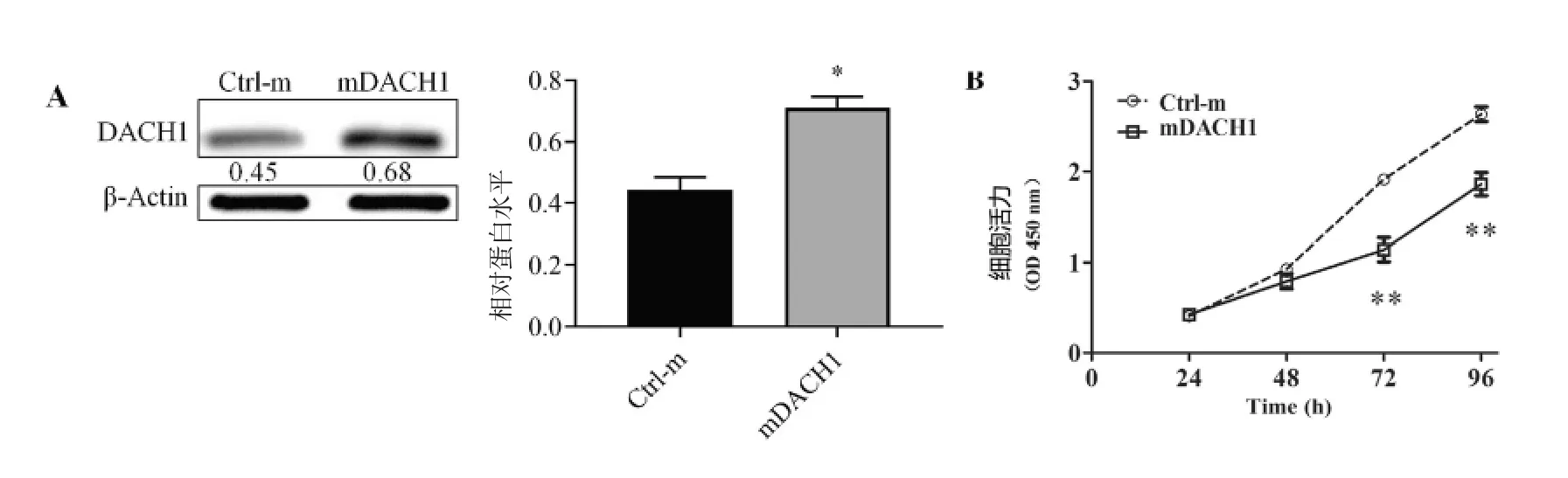
图3 DACH1 过表达时细胞增殖情况Fig.3 Cell proliferation during overexpression of DACH1
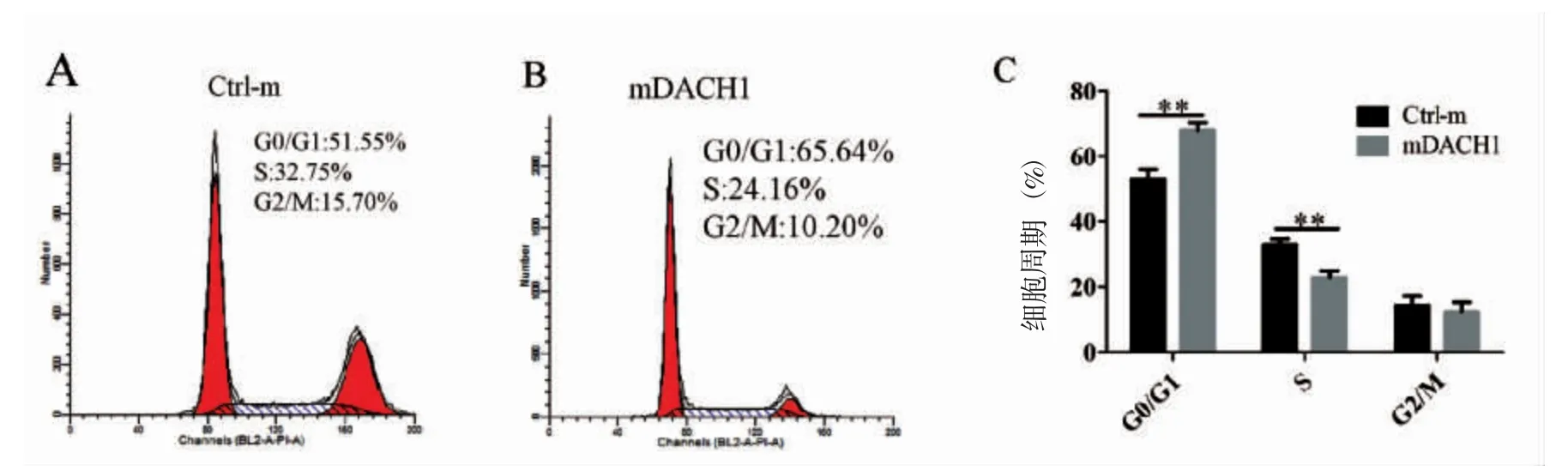
图4 流式细胞术检测HepG2 细胞周期
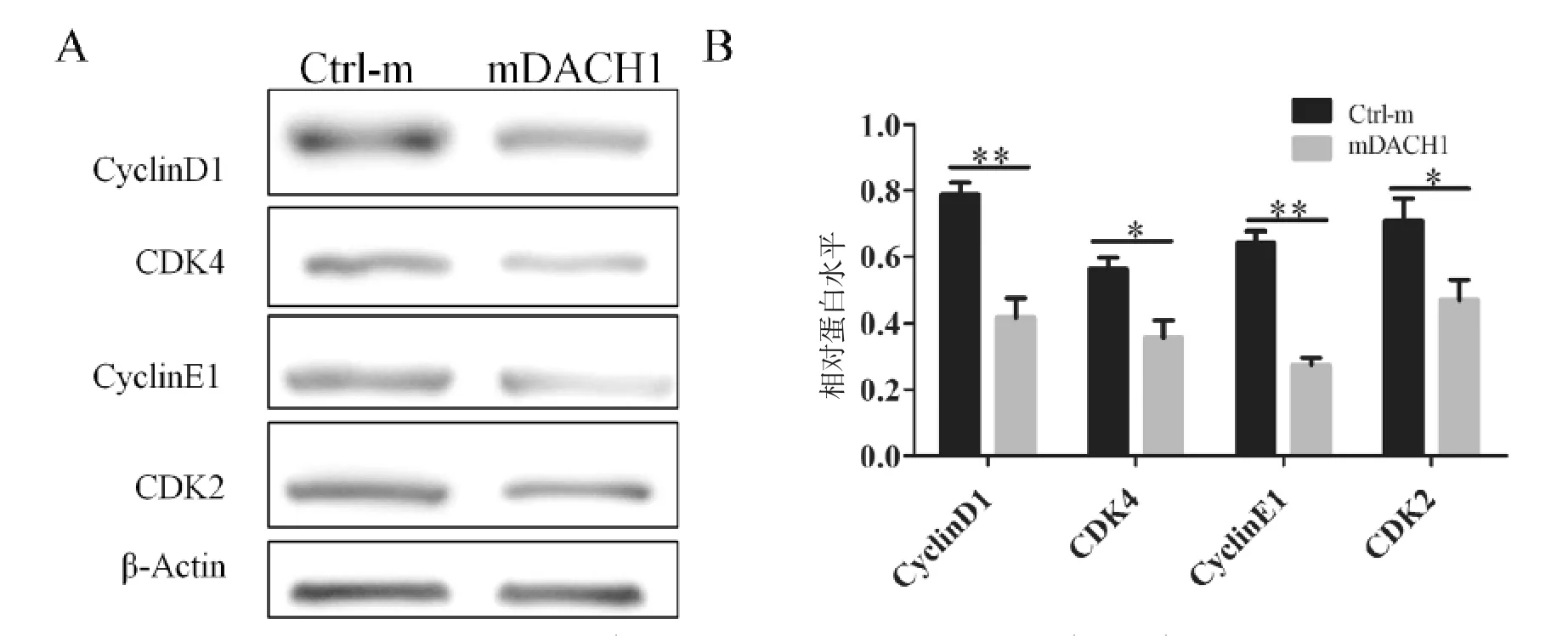
图5 DACH1 过表达时周期相关蛋白的变化情况Fig.5 Changes of periodic related proteins during overexpression of DACH1

图6 DACH1 调节肝癌的发生(×200)Fig.6 DACH1 regulated the tumorigenesis of HCC cancer (×200)
3 讨论
近年来多项研究表明DACH1 基因在多种癌细胞中呈现低表达,在多种肿瘤中发挥了抑癌基因的作用,DACH1 基因抑制细胞增殖和迁移在乳腺癌细胞中得到证实[13-15],在肺腺癌中,DACH1 可以抑制非小细胞肺癌的克隆形成和细胞增殖[16],在前列腺癌中,DACH1 可以抑制前列腺癌细胞的DNA合成、增殖、克隆形成[15]。在肝癌中,本研究进一步证实DACH1 可能具有抑癌作用。笔者对DACH1 在肝癌中的生物学功能进行了研究,笔者发现DACH1 可以抑制肝癌细胞系HepG2 的增殖和裸鼠体内成瘤,表明DACH1 在体外和体内都可以抑制肝癌的生长。为了进一步探索DACH1 抑制肝癌细胞增殖的原因,笔者检测了DACH1 对HepG2细胞周期的影响。结果表明,DACH1 可以使肝癌细胞系HepG2 的G0/G1 期细胞增多、S 期细胞减少。可见,DACH1 抑制肝癌细胞增殖主要是通过调控细胞周期来实现的。
细胞周期是一个非常复杂的过程,涉及到大量调节蛋白,细胞周期依赖性蛋白激酶(CDK2 和CDK4)和细胞周期蛋白(cyclinD1 和cyclinE1)是调控细胞周期的两大家族,CDK4 和cyclin D1 在G0/G1 期表达升高,促进细胞从G0/G1 期向S 期转变[16-19],在这些蛋白的作用下,细胞按顺序经过DNA 合成前期(G1)、DNA 合成期(S)、有丝分裂前期(G2)和有丝分裂期(M)。为了进一步证实DACH1 肝癌细胞增殖主要是通过调控细胞周期来实现,研究中对依赖性蛋白激酶(CDK2 和CDK4)和细胞周期蛋白(CyclinD1 和CyclinE1)的表达水平进行了检测。结果显示,DACH1 可以降低这些依赖性蛋白激酶和细胞周期蛋白的表达水平。从而证实,DACH1 可以诱导肝癌细胞系HepG2 细胞周期G1/S 阻滞。
综合以上研究结果,DACH1 可以抑制肝癌细胞系HepG2 细胞增殖和裸鼠体内成瘤,在肝癌中发挥了抑癌基因的作用。DACH1 主要是通过诱导细胞周期G1/S 阻滞,使G1 期细胞增多、S 期细胞减少,从而抑制肝癌细胞的增殖。
