奶牛脂肪来源间充质干细胞的分离培养及其生物学特性研究
2020-08-11罗惠娜樊全宝江文康赵明明王静静罗冬章王丙云
罗惠娜 樊全宝 江文康 赵明明 王静静 罗冬章 王丙云

摘要:【目的】建立奶牛脂肪間充质干细胞(AD-MSCs)体外分离培养体系,并进行增殖能力检测、分化能力鉴定及生物学特性研究,为推广AD-MSCs在畜牧生产及其疾病治疗等方面的应用提供理论依据。【方法】通过I型胶原酶消化法分离奶牛AD-MSCs并进行代传培养,绘制P3、P6和P9代奶牛AD-MSCs的生长曲线及测定其群体倍增时间,分别采用流式细胞术及RT-PCR检测细胞表面标志物;使用干细胞成骨/成脂诱导分化完全培养基进行奶牛AD-MSCs成骨成脂诱导分化,经茜素红和油红O染色后鉴定其成骨成脂分化能力;并检测冻存奶牛AD-MSCs复苏后的存活率。【结果】分离及传代培养获得的奶牛AD-MSCs在体外培养条件下呈长梭形,折光性强,生长状态良好,其生长曲线呈典型的S形,符合Logistic生长规律。奶牛AD-MSCs高表达MSCs表面标志物CD44、CD73、CD90和CD105,但不表达白细胞表面标志物CD45;分别使用干细胞成骨/成脂诱导分化完全培养基诱导的奶牛AD-MSCs经茜素红和油红O染色后,显微镜下可观察到大量的钙结节和红色脂肪滴。冻存6个月后进行细胞复苏,奶牛AD-MSCs的存活率高达96%;复苏奶牛AD-MSCs培养4 h内贴壁,呈典型的长梭形,生长状态良好,培养72 h细胞融合达80%~90%。【结论】通过I型胶原酶消化法从奶牛腹部脂肪组织分离获得的奶牛AD-MSCs具有良好的体外增殖能力及多向分化潜能,为畜牧生产研究及奶牛疾病治疗提供了一种良好的种子细胞来源。
关键词: 奶牛;脂肪;间充质干细胞(MSCs);生物学特性;体外增殖能力;分化潜能
Abstract:【Objective】This study aimed to establish in vitro culture system for dairy cow adipose-derived mesenchymal stem cells(AD-MSCs) and conduct proliferation ability detection, differentiation ability identification and the biological characteristics of these cells, provide a theoretical basis for promoting the application of AD-MSCs in animal husban-dry production and disease treatment. 【Method】Collagenase type I digestion method was applied to separate dairy cow AD-MSCs and then sub-cultured in vitro,and then plotted the growth curves,determined its population doubling time of P3, P6 and P9 generation of AD-MSCs. Membrane markers of the cells were identified by flow cytometric analysis and RT-PCR. The ability of osteogenic/adipogenic differentiation was detected by alizarin red stainingand oil red O, then livability of AD-MSCs in cryopreserved cow milk after resuscitation. 【Result】The results revealed that the cultured dairy cow AD-MSCs presented typical long spindle shape, strong refractivity and fine growth status. The growth curve showed a typical S shape, which was in line with the law of Logistic growth curve. The MSCs surface markers CD44, CD73, CD90 and CD105 were highly expressed, while white blood cell surface marker CD45 was rarely detected. After being stained with alizarin red and oil red O using stem cell osteogenic/adipogenic differentiation-inducing complete media, a large number of calcium nodules and red fat droplets were observed under the microscope. After 6 months of cryopreservation, the cells were recovered and the cell survival rate was as high as 96%. The recovered AD-MSCs adhered to the wall after 4 h of culture and showed a typical long spindle shape with good growth status. The AD-MSCs were confluent by 80%-90% after 72 h of culture. 【Conclusion】The AD-MSCs of cows isolated from the abdomen adipose tissue of cows by type I collagenase digestion method have good in vitro proliferation ability and multi-directional differentiation potential, which provides a good seed cell source for animal husbandry production research and cow disease treatment.
Key words: dairy cow;adipose;mesenchymal stem cells(MSCs);biological characteristics; in vitro proliferation ability; differentiation potential
0 引言
【研究意义】间充质干细胞(Mesenchymal stem cells,MSCs)是一种理想的组织工程种子细胞,具有自我更新及分化为脂肪細胞、骨细胞、软骨细胞及其他胚层细胞的潜能(Samsonraj et al.,2017;刘超等,2019),在多种组织损伤修复与再生方面发挥着重要作用(Cosenza et al.,2017;Gao et al.,2017;Wang et al.,2017;Zheng et al.,2017;Radwan and Mohamed,2018),是目前应用最广泛的成体干细胞之一。此外,MSCs在体外易于培养,扩增迅速,可分化为多种类型的细胞。因此,加强MSCs生物学特性研究具有重要的临床应用及科学研究意义。【前人研究进展】骨髓和脂肪组织是MSCs的主要来源,其中来源于脂肪组织的MSCs(AD-MSCs)具有来源丰富、易获得、增殖能力强等特点(Wilson et al.,2019)。近年来,MSCs一直是干细胞研究的热点,有关MSCs的体外培养体系、分化潜能、生物学特性及其应用等已得到深入认识。Palumbo等(2018)研究表明,MSCs可通过细胞间直接接触和旁分泌多种细胞因子,促进其他细胞的增殖或迁移,加速伤口愈合及其他组织的修复;罗冬章等(2019)研究发现,与脐带、羊膜、骨髓来源的MSCs相比,AD-MSCs的体外扩增能力更强,群体倍增时间最短,具有更高的临床应用价值。此外,已有大量临床试验证实,MSCs对自身免疫性疾病及运动系统、泌尿系统、消化系统和心血管系统等多种疾病有良好的治疗效果(Buehrer and Cheatham,2013),也可通过MSCs建立大动物模型用于人类和动物的常见疾病研究,同时在提高家畜繁殖力及改造家畜遗传性状等方面均具有重要意义(Hill et al.,2019)。有研究表明,通过回输经药物修饰的MSCs可替换或修复受损的奶牛乳腺组织,并且可增强机体的自身免疫以对抗乳房内感染(Peroni and Borjesson,2011;Gao et al.,2014)。在兽医临床学方面,干细胞治疗大家畜骨关节炎的疗效已得到初步证实,其机理在于MSCs具有强大的免疫调节和抗炎作用,能通过细胞间相互作用及多种因子分泌来调节关节局部内环境和活化内源性祖细胞,从而发挥修复受损软骨的作用(Glenn and Whartenby,2014)。MSCs还可应用于转基因动物生产,培育具有抵抗多种疾病的畜群和研制动物生物反应器,促使转基因动物生产人源α-乳白蛋白等(Donovan et al.,2005;Yang et al.,2011)。【本研究切入点】奶牛作为重要的畜产品来源动物,在畜牧业中扮演着重要角色,而MSCs在奶牛遗传育种、品种改良、抗病研究、奶品质调控、体细胞克隆和转基因技术等领域具有广阔的应用前景(Singh et al.,2010;Capuco et al.,2012;H?eussler et al.,2013),但目前国内有关MSCs的研究主要集中在人类及猪(张庆美等,2015)、犬(Endo et al.,2019)等动物上,针对奶牛MSCs的研究相对较少。【拟解决的关键问题】以奶牛腹部脂肪中的AD-MSCs为研究对象,通过胶原酶消化法分离奶牛AD-MSCs,并进行增殖能力检测、分化能力鉴定及生物学特性研究,以期为推广AD-MSCs在畜牧生产及其疾病治疗等方面的应用提供理论依据。
1 材料与方法
1. 1 试验材料
奶牛脂肪组织由广东省佛山市南海区狮山江仔奶牛场提供,取自30日龄荷斯坦小公牛。DMEM/F12基础培养基、青链霉素双抗和0.25%胰蛋白酶购自美国HyClone公司,胎牛血清(FBS)购自以色列Biologi-cal Industries(BI)公司,0.1% I型胶原酶购自Sigma公司,干细胞成脂诱导分化完全培养基和干细胞成骨诱导分化完全培养基购自Cyagen公司,RNA提取试剂盒和反转录试剂盒购自TaKaRa公司,CD90、CD45、CD105和CD44抗体购自Abcam公司。主要仪器设备有超净工作台(苏州苏净仪器自控设备有限公司)、超速低温离心机(美国Beckman公司)、PCR仪(Thermofisher公司)及流式细胞仪(美国BD公司)。
1. 2 试验方法
1. 2. 1 I型胶原酶消化法分离奶牛AD-MSCs及传代培养 手术采集奶牛腹部脂肪组织,置于装有10%青链霉素双抗的组织保护液中,低温运回实验室,75%酒精喷洒离心管后转入超净台,后续操作均在无菌条件下进行。晃动离心管以清洗脂肪组织表面的血细胞2~3次,以含10%青链霉素双抗的PBS浸泡5 min后转移至100 mm的培养皿中,无菌手术剪将组织剪碎成1 mm3,转移至15 mL离心管中,0.1%(1 mg/mL)I型胶原酶37 ℃下消化2~3 h,直至肉眼无明显可见组织块。组织块与胶原酶体积比1∶3。经100目细胞筛过滤后1000 r/min离心5 min,弃上清液;以完全培养基重悬,调整细胞密度至1×107 Cells/mL,转移至60 mm培养皿,置于CO2培养箱中培养。培养体系含DMEM/F12基础培养基、10% FBS、100 U/mL青霉素、100 U/mL链霉素,置于37 ℃、5% CO2条件下培养48 h后,首次半量更换培养基除去大部分血细胞,以后每3 d更换一次培养液。倒置显微镜下观察细胞形态及生长情况,此时为P0代奶牛AD-MSCs。待细胞达80%~90%融合时,弃培养液,PBS清洗,经胰酶消化后进行传代培养,此时培养的细胞为P1代奶牛AD-MSCs,以此类推,依次进行消化传代培养。
1. 2. 2 细胞生长曲线制作及群体倍增时间测定 分别取处于对数生长期的P2、P5和P8代奶牛AD-MSCs,按5×104 Cells/mL的密度接种于24孔板中,每孔0.5 mL,置于37 ℃、5% CO2的培养箱中进行培养,随后每天随机消化3孔细胞,按细胞—台盼蓝体积分数比1∶1混匀,Counstar细胞计数仪进行计数。持续8 d,取平均值,绘制P3、P6和P9代奶牛AD-MSCs的生长曲线。
根据对数增殖期计算群体倍增时间,Patterson公式为DT=t×[lg2/(lgNt-lgNo)]。式中,t為培养时间,No为首次记录的细胞数,Nt为培养 t 时间后的细胞数。采用SPSS 17.0进行统计分析,组间比较以单因素方差分析(One-way ANOVA)进行检验。
1. 2. 3 表面标志物鉴定 采用流式细胞仪鉴定奶牛AD-MSCs表面标志物CD44、CD45、CD90和CD105的表达情况。消化P3代奶牛AD-MSCs,制成单细胞悬液,调整细胞密度至2×105 Cells/mL,并转移至1.5 mL的EP管中,1000 r/min离心5 min,弃上清液,PBS清洗细胞,重复离心,连续洗涤2次;分别加入CD44-FITC、CD45-FITC、CD90-PE和CD105-FITC一抗稀释液50 μL,常温孵育30 min后以PBS清洗细胞,离心弃上清液,加入50 μL PBS,采用流式细胞术进行测定。
1. 2. 4 总RNA提取、cDNA合成及PCR检测 引物设计如表1,采用常规PCR检测CD90、CD44、CD73、CD105和CD45等表面标志物的相关基因。取P5代奶牛AD-MSCs,以RNA提取试剂盒提取总RNA,分光光度计检测RNA浓度后反转录合成cDNA,-20 ℃保存备用。以cDNA为模板进行PCR扩增,扩增程序:95 ℃预变性5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 10 min,进行30个循环;72 ℃延伸5 min,琼脂糖凝胶电泳检测PCR扩增产物。
1. 2. 5 成骨诱导分化 取生长状态良好的P3代奶牛AD-MSCs,0.25%胰酶消化后,调整细胞密度至1×105 Cells/mL,接种于24孔板中,每孔0.5 mL。试验分为对照组和诱导组,每组3个重复。置于CO2培养箱培养24 h,弃原培养上清液,PBS清洗2遍,试验组加入干细胞成骨诱导分化完全培养基(含FBS、青链霉素双抗、谷氨酰胺、抗坏血酸、β-甘油磷酸钠和地塞米松),对照组加入含10% FBS的DMEM完全培养基。每3 d更换一次培养液,直至诱导组出现钙结节。40 g/L多聚甲醛固定30 min,茜素红染液染色10 min,PBS清洗后显微镜下观察并拍照记录。
1. 2. 6 成脂诱导分化 取生长状态良好的P3代奶牛AD-MSCs,0.25%胰酶消化后,调整细胞密度至1×105 Cells/mL,接种于24孔板中,每孔0.5 mL。试验分为对照组和诱导组,每组3个重复。置于CO2培养箱培养24 h,弃原培养上清液,PBS清洗2遍,试验组加入干细胞成脂诱导分化完全培养基A液(含FBS、青链霉素双抗、谷氨酰胺、胰岛素、IBMX、罗格列酮和地塞米松),对照组加入含10% FBS的DMEM完全培养基。诱导3 d后吸走24孔板中的A液,加入0.5 mL干细胞成脂诱导分化完全培养基B液,24 h后吸走B液,换回A液继续进行诱导。A液和B液交替作用3~5次,继续用B液维持培养4~7 d直至脂滴变大变圆。诱导分化完成后,40 g/L多聚甲醛固定30 min,油红O染色10 min,PBS清洗后显微镜下观察并拍照记录。
1. 2. 7 奶牛AD-MSCs冻存及存活率检测 冻存体系:冻存液为60% FBS+30% DMEM基础培养基+10% DMSO。取经形态学和细胞免疫表型鉴定的P3代奶牛AD-MSCs,常规方法收集对数生长期的贴壁细胞,置于离心管中,1000 r/min离心5 min。弃上清液,收集沉淀,根据细胞数量加入冻存液,调整细胞终浓度为1×106~1×107 Cells/mL,分装至2 mL冻存管中,每管1.0 mL。置于程序降温盒中,-80 ℃保存过夜,第2 d放入-196 ℃液氮保存。细胞复苏:6个月后复苏冻存细胞,37 ℃水浴锅中快速溶解,离心后弃上清液,加入适量完全培养基并转移至5 mL离心管中,取50 μL细胞悬液与0.4%台盼蓝按1∶1混合,细胞计数,死细胞被台盼蓝染成蓝色,活细胞则无色,统计细胞存活率,重复3次。细胞存活率(%)=活细胞/总细胞数×100。
2 结果与分析
2. 1 奶牛AD-MSCs形态学观察结果
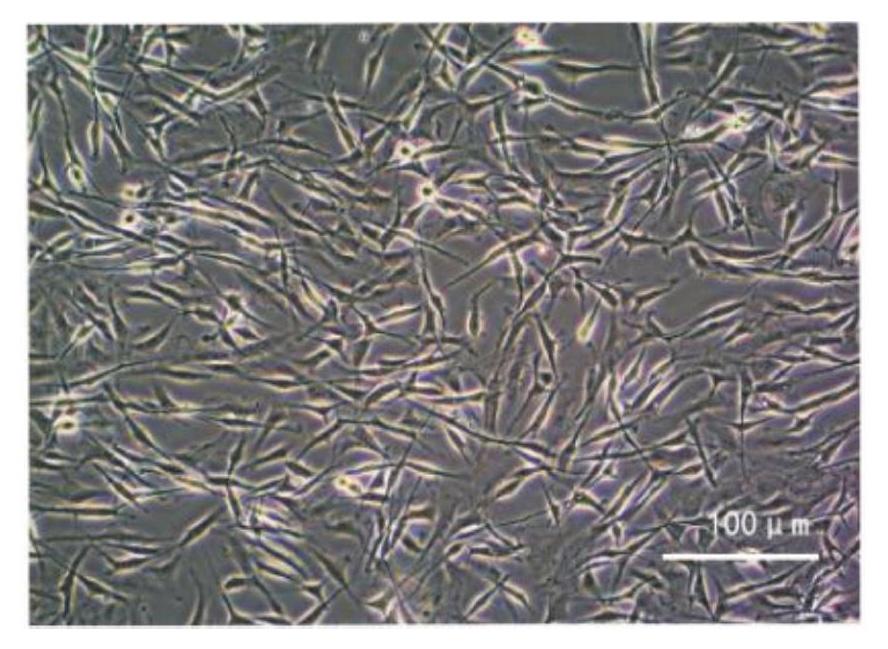
经0.1% I型胶原酶消化得到的原代细胞(P0代奶牛AD-MSCs),培养24 h时其表面覆盖大量悬浮圆形的脂肪细胞和少许红细胞,培养液表面呈油状;培养至48 h时,通过半数更换培养基除去大多数杂质细胞,此时细胞的贴壁状态如图1-A;原代培养至第4 d,细胞大量贴壁,形态呈典型的长梭形,折光性强(图1-B);培养至第8 d,细胞融合达80%~90%(图1-C),即可传代;传代培养至P2代即可得到纯化细胞,传代细胞出现均匀分布的纺锤形,呈典型的漩涡状生长(图1-D和图1-E);传代培养至P8代后,细胞融合的时间较前面代次变长,细胞形态较不规整,折光性开始下降(图1-F),提示细胞开始出现老化。
2. 2 奶牛AD-MSCs的生长曲线及其群体倍增时间
绘制P3、P6和P9代奶牛AD-MSCs的生长曲线,结果发现各生长曲线均呈典型的S形(图2),分别经历潜伏期、对数生长期和平台期。不同代次细胞的增殖趋势差异不明显,均存在2 d的潜伏期,从第3 d开始进入对数生长期,第7 d开始呈缓慢增长,生长曲线逐渐趋于平缓。如图3所示,随着奶牛AD-MSCs代次的增加,细胞群体倍增时间也逐渐增加,P3代奶牛AD-MSCs的群体倍增时间为21.73±0.56 h,P6代奶牛AD-MSCs的群体倍增时间为23.41±0.77 h,P9代奶牛AD-MSCs的群体倍增时间为28.65±1.30 h,其中,P9代奶牛AD-MSCs的群体倍增时间极显著长于P3和P6代奶牛AD-MSCs,说明随着细胞代次的增加,其增殖能力减弱。
2. 3 奶牛AD-MSCs表面标志物鉴定结果
为确认分离获得的细胞即为奶牛AD-MSCs,对其进行表面标志物鉴定。流式细胞仪分析结果如图4所示,其中,红色曲线为未加入一抗的奶牛AD-MSCs细胞对照组,绿色曲线为检测样本。P3代奶牛AD-MSCs高表达MSCs表面标志物CD44、CD90和CD105,但不表达白细胞表面标志物CD45,即分离培养获得的细胞符合AD-MSCs特性及鉴定标准。
2. 4 RT-PCR鉴定结果
根据奶牛CD105、CD90、CD73、CD44及CD45基因序列分别设计5对特异性引物,对P5代奶牛AD-MSCs进行RT-PCR扩增,结果显示分离培养获得的奶牛AD-MSCs表达CD105、CD90、CD73和CD44等MSCs特异性基因,但不表达CD45基因(图5),符合MSCs的特性及鉴定标准。
2. 5 奶牛AD-MSCs的成骨成脂诱导鉴定结果
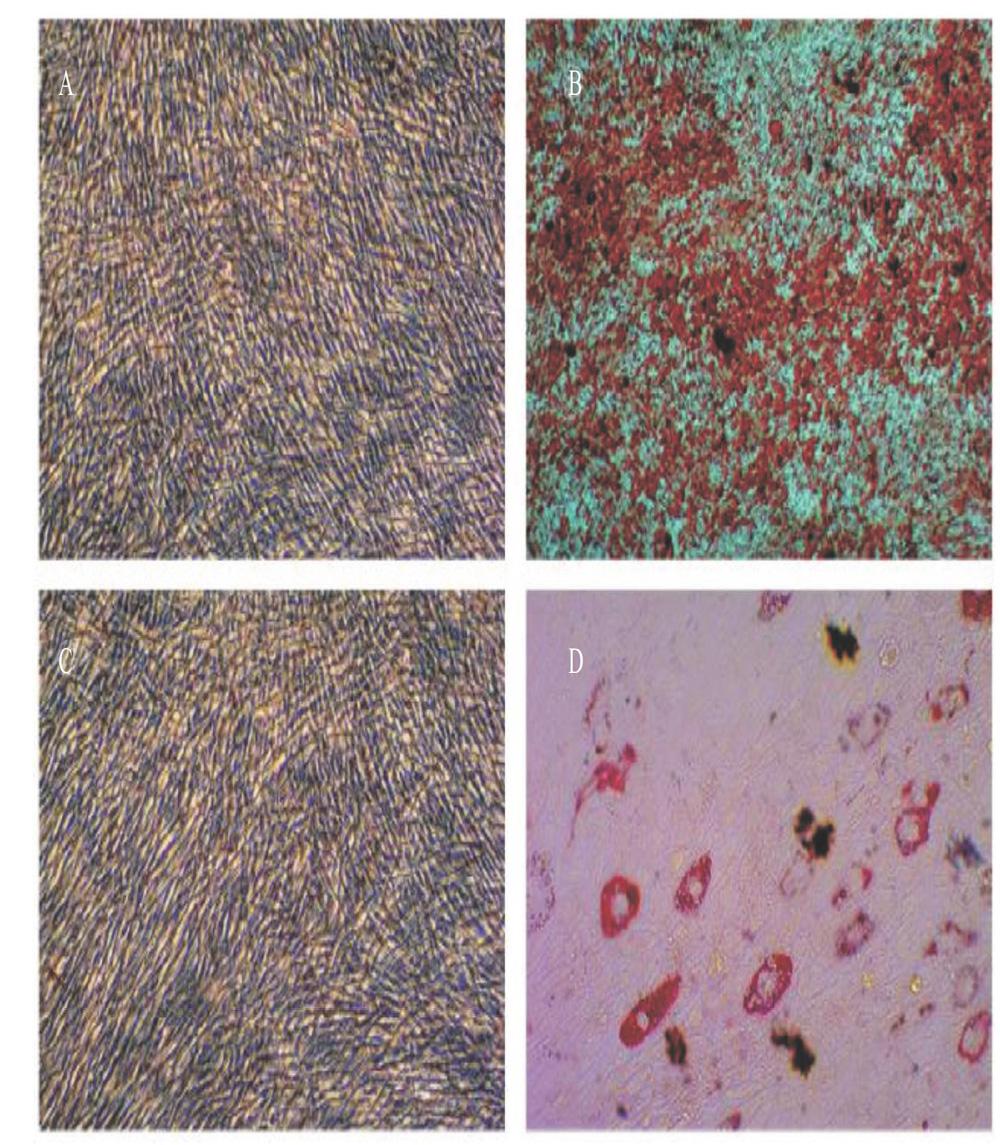
经干细胞成骨诱导分化完全培养基诱导5 d后,奶牛AD-MSCs的细胞形态发生变化,其体积变大,铺满培养皿。至诱导第7 d,细胞堆积连接成片,呈鳞片状(图6-A);诱导第10 d出现钙结节,以茜素红进行矿化结节染色,显微镜观察视野中可见大面积红色致密结节(图6-B)。经干细胞成脂诱导分化完全培养基诱导14 d后,大部分奶牛AD-MSCs的细胞形态呈卵圆形(图6-C),胞质内出现许多大小不一的脂质颗粒,且脂肪滴随诱导时间的延长逐渐变大,脂肪滴可被油紅O染成红色(图6-D)。
2. 6 奶牛AD-MSCs的冻存复苏培养结果
复苏液氮冻存6个月的奶牛AD-MSCs,经台盼蓝染色计数显示细胞存活率可达96%。复苏的奶牛AD-MSCs培养4 h内贴壁,呈典型的长梭形(图7),形态单一,折光性强,生长状态良好;培养72 h细胞融合达80%~90%。冻存前后奶牛AD-MSCs的细胞形态及生长状态无明显差异。
3 讨论
从脂肪组织提取细胞是当前干细胞研究领域的热点,自2001年Zuk等在吸脂术抽取的脂肪中发现脂肪干细胞以来,AD-MSCs的研究逐渐深入。AD-MSCs的分离、培养及冻存等技术也越来越完善,其分离方法包括组织块贴壁法、酶消化法和机械分离法等(Buehrer and Cheatham,2013;罗冬章等,2019)。目前,有关动物AD-MSCs的研究主要集中在鼠、兔和猪等物种上,针对奶牛等大型家畜AD-MSCs的报道较少。王帅帅等(2019)采用胰蛋白酶消化法从3~4月龄初生犊牛肾周脂肪组织中分离获得脂肪干细胞,并证实体外维持数代培养后细胞仍保持良好生长状态。本研究采集奶牛腹部脂肪组织,使用I型胶原酶消化法分离培养获得AD-MSCs。相对于胰蛋白酶,胶原酶较温和,不受培养基中Ca2+、Mg2+及血清的抑制,且易于撑控浓度、温度和时间,消化时不易对细胞造成损伤。本研究分离及传代培养获得的奶牛AD-MSCs呈长梭形,其生长曲线呈典型S形,符合Logistic生长曲线规律。
MSCs是一个异质细胞群,至今尚未发现特异性标志物,其鉴定方法主要是通过结合多方面因素进行综合判定,有关AD-MSCs的表面标志物也尚无明确定论。2013年,国际脂肪应用技术协会(IFATS)宣布经体外培养的AD-MSCs表型为CD31?/CD44+/CD45?/CD73+/CD90+/CD105+(Bourin et al.,2013)。本研究采用流式细胞术检测P4代奶牛AD-MSCs的表面标志物CD44、CD45、CD90和CD105,并通过RT-PCR测定CD44、CD73、CD90和CD105基因的表达情况,结果显示,奶牛AD-MSCs高表达CD44、CD73、CD90和CD105特异性基因,但不表达CD45基因,与IFATS公布的结果一致。同时结合相差显微镜观察发现,奶牛AD-MSCs呈长梭形、漩涡状盘旋排列,类似成纤维类细胞形态特征,因此可判定分离培养获得的细胞即为奶牛AD-MSCs。
已有研究证实,多种动物的MSCs均可在体外诱导分化脂肪细胞、成骨细胞、软骨细胞及神经细胞等(Vidal et al.,2012;罗冬章等,2019;Endo et al.,2019)。张庆美等(2015)使用地塞米松、吲哚美辛、3-异丁基-1-甲基黄嘌呤等试剂成功诱导猪骨髓MSCs向脂肪细胞分化;朱雪敏等(2015)以吲哚美辛为主要的诱导试剂,体外诱导南阳牛骨髓MSCs 3~4 d后即可在显微镜下观察到脂肪细胞小脂滴,同时使用β-巯基乙醇等诱导剂成功诱导其向神经细胞分化。本研究分别使用干细胞成骨/成脂诱导分化完全培养基进行奶牛AD-MSCs成骨成脂诱导分化,经茜素红和油红O染色后,显微镜下分别观察到大量的钙结节和红色脂肪滴,说明奶牛AD-MSCs具有向脂肪细胞和成骨细胞分化的潜能,为今后的相关研究提供了一种前体种子细胞。
MSCs在体外多次传代培养后常出现细胞老化、细胞分化及干性丢失等问题(Redondo et al.,2018)。细胞冻存是干细胞基础研究的重要内容,在体外培养过程中,为避免细胞多次传代,常在低代次将其冻存,使用时再进行复苏。AD-MSCs的冻存及复苏可保证其在生产应用的时效性、安全性及规模性,有效弥补AD-MSCs无法在体外持续扩增传代的劣势。本研究将P3代奶牛AD-MSCs通过程序降温盒进行程序降温,并置于-196 ℃液氮冻存,6个月后进行细胞复苏,经台盼蓝染色计数显示细胞存活率高达96%;复苏奶牛AD-MSCs培养4 h内贴壁,呈典型的长梭形,形态单一,折光性强,生长状态良好;培养72 h细胞融合达80%~90%。说明采用本研究的冻存方法可较长时间保持奶牛AD-MSCs的细胞活性,有利于其后续研究及应用。
4 结论
通过I型胶原酶消化法从奶牛腹部脂肪组织分离获得的奶牛AD-MSCs具有良好的体外增殖能力及多向分化潜能,为畜牧生产研究及奶牛疾病治疗提供了一种良好的种子细胞来源。
参考文献:
刘超,张丽君,陶昊,杜心洁,王芮,李文菁,丁淑梅,王怡,姜磊,黄玉香. 2019. 基于细胞生物学方法比较5种不同组织来源间充质干细胞的特征[J]. 中国组织工程研究,23(33):5334-5340. [Liu C,Zhang L J,Tao H,Du X J,Wang R,Li W J,Ding S M,Wang Y,Jiang L,Huang Y X. 2019. Comparing biological characteristics of five kinds of mesenchymal stem cells[J]. Chinese Journal of Tissue Engineering Research,23(33):5334-5340.]
罗冬章,罗惠娜,詹小舒,李心怡,黄曼晴,林洁微,黄绮亮,洪纯,林好美,陈胜锋,王丙云. 2019. 猫4种不同来源间充质干细胞的生物学特性比较[J]. 生物技术通报,35(7):39-45. [Luo D Z,Luo H N,Zhan X S,Li X Y,Huang M Q,Lin J W,Huang Q L,Hong C,Lin H M,Chen S F,Wang B Y. 2019. Comparison of biological characteristics of feline mesenchymal stem cells derived from four diffe-rent tissues[J]. Biotechnology Bulletin,35(7):39-45.]
王帥帅,张才,孟素丹,黄永志,朱雪敏,王玉琴,杨自军. 2019. 犊牛脂肪干细胞的分离、培养与鉴定[J]. 浙江农业学报,31(2):235-241. [Wang S S,Zhang C,Meng S D,Huang Y Z,Zhu X M,Wang Y Q,Yang Z J. 2019. Isolation,culture and identification of adipose-derived stem cells from calves[J]. Acta Agriculturae Zhejiangensis,31(2):235-241.]
张庆美,李方正,蒋忠玲,孙东兴,李东建,宋学雄. 2015. 猪骨髓间充质干细胞分离培养和诱导分化脂肪细胞[J]. 中国兽医学报,35(1):91-96. [Zhang Q M,Li F Z,Jiang Z L,Sun D X,Li D J,Song X X. 2015. Isolation,culturation and differentiation of porcince bone marrow mesenchymal stem cells into adipocytes[J]. Chinese Journal of Veterinary Science,35(1):91-96.]
朱雪敏,位兰,张自强,邓雯,孙宇,赵前宁,王梦凡. 2015. 南阳牛骨髓间充质干细胞的分离培养及多向分化[J]. 中国畜牧兽医,42(9):2377-2383. [Zhu X M,Wei L,Zhang Z Q,Deng W,Sun Y,Zhao Q N,Wang M F. 2015. Isolation,culture and multiple differentiation induction of Nanyang bovine bone marrow mesenchymal stem cells[J]. China Animal Husbandry & Veterinary Medicine,42(9):2377-2383.]
Bourin P,Bunnell B A,Casteilla L,Dominici M,Katz A J,March K L,Redl H,Rubin J P,Yoshimura K,Gimble J M. 2013. Stromal cells from the adipose tissue-derived stromal vascular fraction and culture expanded adipose tissue-derived stromal/stem cells:A joint statement of the International Federation for Adipose Therapeutics and Science(IFATS) and the International Society for Cellular Therapy (ISCT)[J]. Cytotherapy,15(6):641-648.
Buehrer B M,Cheatham B. 2013. Isolation and characterization of human adipose-derived stem cells for use in tissue engineering[J]. Organ Regeneration,1001:1-11.
Capuco A V,Choudhary R K,Daniels K M,Li R W,Evock-Clover C M. 2012. Bovine mammary stem cells:Cell bio-logy meets production agriculture[J]. Animal,6(3):382-393.
Cosenza S,Ruiz M,Toupet K,Jorgensen C,No?l D. 2017. Mesenchymal stem cells derived exosomes and microparticles protect cartilage and bone from degradation in osteoarthritis[J]. Scientific Reports,7(1):16214. doi:10.1038/ s41598-017-15376-8.
Donovan D M,Kerr D E,Wall R J. 2005. Engineering di-sease resistant cattle[J]. Transgenic Research,14(5):563-567.
Endo K,Fujita N,Nakagawa T,Nishimura R. 2019. Comparison of the effect of growth factors on chondrogenesis of canine mesenchymal stem cells[J]. The Journal of Veterinary Medical Science,81(8):1211-1218.
Gao X R,Xu H J,Wang L F,Liu C B,Yu F. 2017. Mesenchymal stem cell transplantation carried in SVVYGLR modified self-assembling peptide promoted cardiac repair and angiogenesis after myocardial infarction[J]. Biochemical and Biophysical Research Communications,491(1):112-118.
Gao Y H,Zhu Z Q,Zhao Y H,Hua J L,Ma Y H,Guan W J. 2014. Multilineage potential research of bovine amniotic fluid mesenchymal stem cells[J]. International Journal of Molecular Sciences,15(3):3698-3710.
Glenn J D,Whartenby K A. 2014. Mesenchymal stem cells:Emerging mechanisms of immunomodulation and therapy[J]. World Journal of Stem Cells,6(5):526-539.
H?eussler S,Germeroth D,Friedauer K,Akter S H,D?enicke S,Sauerwein H. 2013. Characterization of the dynamics of fat cell turnover in different bovine adipose tissue depots[J]. Research in Veterinary Science,95(3):1142-1150.
Hill A B T,Bressan F F,Murphy B D,Garcia J M. 2019. Applications of mesenchymal stem cell technology in bovine species[J]. Stem Cell Research & Therapy,10(1):44. doi:10.1186/s13287-019-1145-9.
Palumbo P,Lombardi F,Siragusa G,Cifone M G,Cinque B,Giuliani M. 2018. Methods of isolation,characterization and expansion of human adipose-derived stem cells (ASCs):An overview[J]. International Journal of Mole-cular Sciences,19(7):1897. doi:10.3390/ijms19071897.
Peroni J F,Borjesson D L. 2011. Anti-inflammatory and immunomodulatory activities of stem cells[J]. The Veterinary Clinics of North America. Equine Practice,27(2):351-362.
Radwan R R,Mohamed H A. 2018. Nigella sativa oil modulates the therapeutic efficacy of mesenchymal stem cells against liver injury in irradiated rats[J]. Journal of Photochemistry and Photobiology,178:447-456.
Redondo J,Sarkar P,Kemp K,Virgo P F,Pawade J,Norton A,Emery D C,Guttridge M G,Marks D I,Wilkins A,Scolding N J,Rice C M. 2018. Reduced cellularity of bone marrow in multiple sclerosis with decreased MSC expansion potential and premature ageing in vitro[J]. Multiple Sclerosis,24(7):919-931.
Samsonraj R M,Raghunath M,Nurcombe V,Hui J H,van Wijnen A J,Cool S M. 2017. Concise review:Multifaceted characterization of human mesenchymal stem cells for use in regenerative medicine[J]. Stem Cells Translational Medicine,6(12):2173-2185.
Singh K,Erdman R A,Swanson K M,Molenaar A J,Maqbool N J,Wheeler T T,Arias J A,Quinn-Walsh E C,Stelwagen K. 2010. Epigenetic regulation of milk production in dairy cows[J]. Journal of Mammary Gland Biology and Neoplasia,15(1):101-112.
Vidal M A,Walker N J,Napoli E,Borjesson D L. 2012. Eva-luation of senescence in mesenchymal stem cells isolated from equine bone marrow,adipose tissue,and umbilical cord tissue[J]. Stem Cells and Development,21(2):273-283.
Wang W P,Li P,Li W,Jiang J Z,Cui Y Y,Li S R,Wang Z X. 2017. Osteopontin activates mesenchymal stem cells to repair skin wound[J]. PLoS One,12(9):e01853469.
Wilson A,Chee M,Butler P,Boyd A S. 2019. Isolation and characterisation of human adipose-derived stem cells[J]. Methods in Molecular Biology,1899:3-13.
Yang B,Wang J W,Tang B,Liu Y F,Guo C D,Yang P H,Yu T,Li R,Zhao J M,Zhang L,Dai Y P,Li N. 2011. Cha-racterization of bioactive recombinant human lysozyme expressed in milk of cloned transgenic cattle[J]. PLoS One,6(3):e17593.
Zheng M G,Duan J X,He Z D,Wang Z W,Mu S H,Zeng Z W,Qu J L,Wang D,Zhang J. 2017. Transplantation of bone marrow stromal stem cells overexpressing tropomyo-sin receptor kinase A for peripheral nerve repair[J]. Cytotherapy,19(8):916-926.
Zuk P A,Zhu M,Mizuno H,Huang J,Futrell J W,Katz A J,Benhaim P,Lorenz H P,Hedrick M H. 2001. Multilineage cells from human adipose tissue:Implications for cell-based therapies[J]. Tissue Engineering,7(2):211-228.
(責任编辑 兰宗宝)
