落羽杉属种类及其杂交子代‘中山杉’系列品种的SSR指纹图谱构建及遗传关系分析
2020-08-10徐建华王紫阳郭金博於朝广
段 豪, 徐建华, 王紫阳, 郭金博, 於朝广, 杨 颖
〔江苏省中国科学院植物研究所(南京中山植物园) 江苏省落羽杉属树木种质创新与繁育工程研究中心, 江苏 南京 210014〕
落羽杉属(TaxodiumRich.)包含落羽杉〔T.distichum(Linn.) Rich.〕、池杉〔T.distichumvar.imbricatum(Nuttall) Croom〕和墨西哥落羽杉(T.mucronatumTenore)3个类群[1]58-60。江苏省中国科学院植物研究所经过数十年的杂交选育,从落羽杉属种间杂交后代中选育出‘中山杉’(T. ‘Zhongshanshan’)系列优良无性系品种,该品种具有耐水湿、耐盐碱和观赏价值高等优点,是长江中下游地区主要的生态和园林树种之一[2-5]。
由于在育种过程中高频率使用少数骨干亲本,部分‘中山杉’品种的亲缘关系较近,形态特征差异较小,难以鉴别,为此研究者们利用形态和分子特征对‘中山杉’系列品种的亲缘关系进行了研究。杨美凌等[6]利用外部形态性状的差异,通过聚类分析仅能理清落羽杉属部分种类、栽培品种及杂种间的亲缘关系,且表型特征易受环境因子的影响。李涵等[7]利用RAPD分子标记对落羽杉属种类及其杂交后代共13个样本进行亲缘关系鉴定,但RAPD分子标记提供的是显性标记,无法区分纯合型和杂合型,获得的遗传信息不全面。随着‘中山杉’新优品种的推广,在生产过程中难以避免出现品种混杂的现象,亟需应用鉴别率更高的技术进行种质鉴定。
与其他分子标记相比,SSR分子标记具有多态性高、共显性、种属间通用性良好等优点,且实验过程中所需样本量少、操作简便、分辨率高、可重复性强、结果稳定, SSR分子标记已广泛用于遗传图谱构建、基因定位、指纹图谱分析以及多样性评价等领域[8]。而基于SSR分子标记的指纹图谱也被应用于茶树〔Camelliasinensis(Linn.) Kuntze〕[9]和马尾松(PinusmassonianaLambert)[10]等林木种质资源和品种的鉴定。王紫阳等[3]利用聚丙烯酰胺凝胶电泳技术,通过81对SSR引物和6对SRAP引物组合对23个‘中山杉’品种及其亲本的基因型进行分析,构建了落羽杉属种质的指纹图谱,并从中筛选出7对SSR多态性引物,对供试样本的鉴别率达84.6%。相比于常规的聚丙烯酰胺凝胶电泳技术,荧光标记毛细管电泳技术是一项高通量、自动化的电泳技术,其分辨率约1 bp[11],检测结果更为精确、灵敏、高效,适用于大批量样本的检测分析。
为探索荧光标记毛细管电泳技术在落羽杉属种质鉴定中的应用,作者基于前期筛选的SSR分子标记,采用荧光标记毛细管电泳技术对96个样本(40个‘中山杉’系列品种以及15个池杉、23个墨西哥落羽杉和18个落羽杉的单株)进行检测,并比较了引物的多态性以及供试样本间的遗传参数。考虑实际应用时的简便性和鉴别率,尽可能选择数量少的引物构建指纹图谱;并根据供试样本的遗传距离进行聚类分析,探讨供试样本间的亲缘关系。以期为‘中山杉’品种创新和推广以及落羽杉属种质资源的引种和鉴定奠定基础,并为‘中山杉’新品种的知识产权保护、优良亲本的选育和育种策略的制定提供基础数据。
1 材料和方法
1.1 材料
供试96个样本具有不同的基因型,均来源于江苏省中国科学院植物研究所落羽杉属林木种质资源库,具体包括40个‘中山杉’系列品种(无性系,下同)以及15个池杉、23个墨西哥落羽杉和18个落羽杉的单株。
40个‘中山杉’系列品种包括:‘中山杉401’(‘Zhongshanshan 401’)由池杉与墨西哥落羽杉(前为父本、后为母本,下同)杂交获得;‘中山杉1’(‘Zhongshanshan 1’)、‘中山杉27’(‘Zhongshanshan 27’)、‘中山杉86’(‘Zhongshanshan 86’)、‘中山杉91’(‘Zhongshanshan 91’)、‘中山杉102’(‘Zhongshanshan 102’)、‘中山杉118’(‘Zhongshanshan 118’)、‘中山杉123’(‘Zhongshanshan 123’)、‘中山杉140’(‘Zhongshanshan 140’)、‘中山杉146’(‘Zhongshanshan 146’)和‘中山杉149’(‘Zhongshanshan 149’)由‘中山杉302’ (‘Zhongshanshan 302’)与墨西哥落羽杉杂交获得;‘中山杉111’(‘Zhongshanshan 111’)、‘中山杉112’(‘Zhongshanshan 112’)、‘中山杉113’(‘Zhongshanshan 113’)、‘中山杉120’(‘Zhongshanshan 120’)、‘中山杉125’(‘Zhongshanshan 125’)和‘中山杉127’(‘Zhongshanshan 127’)由墨西哥落羽杉与池杉杂交获得;‘中山杉301’(‘Zhongshanshan 301’)、‘中山杉302’、‘中山杉1002’(‘Zhongshanshan 1002’)、‘中山杉1013’(‘Zhongshanshan 1013’)、‘中山杉1073’(‘Zhongshanshan 1073’)、‘中山杉1074’(‘Zhongshanshan 1074’)、‘中山杉1075’(‘Zhongshanshan 1075’)、‘中山杉1076’(‘Zhongshanshan 1076’)、‘中山杉1201’(‘Zhongshanshan 1201’)和‘中山杉1213’(‘Zhongshanshan 1213’)由落羽杉与墨西哥落羽杉杂交获得;‘中山杉405’(‘Zhongshanshan 405’)、‘中山杉406’(‘Zhongshanshan 406’)、‘中山杉407’(‘Zhongshanshan 407’)、‘中山杉502’(‘Zhongshanshan 502’)、‘中山杉503’(‘Zhongshanshan 503’)、‘中山杉601’(‘Zhongshanshan 601’)和‘中山杉703’(‘Zhongshanshan 703’)由墨西哥落羽杉与落羽杉杂交获得;‘中山杉1301’(‘Zhongshanshan 1301’)、‘中山杉1302’(‘Zhongshanshan 1302’)和‘中山杉1303’(‘Zhongshanshan 1303’)由‘中山杉102’与墨西哥落羽杉杂交获得;‘中山杉1304’(‘Zhongshanshan 1304’)由‘中山杉302’与落羽杉杂交获得;‘中山杉1305’(‘Zhongshanshan 1305’)和‘中山杉1306’(‘Zhongshanshan 1306’)由‘中山杉102’与落羽杉杂交获得。
15个池杉单株中,C1、C2、C3、C4、C5、C6、C7、C8、C9和CT引自南京中山植物园盲人植物园,ZM6、ZM8、ZM10和ZM12引自南京中山植物园树木园,CC引自美国。23个墨西哥落羽杉单株中,YJM引自南京挹江门,DD引自南京东南大学校园,A1、A2、A3、A4、A5、XM1、XM2、XM3、XM4、XM5、XM6、XM7、XM8、JM1、JM2、JM3、JM4和JM5引自美国,B4、B6和B7引自墨西哥。18个落羽杉单株中,L1、L2、L4和L5引自河南,L7、L8、L9、LP1和LP2引自南京中山植物园,L11、L13、L14、L15、L16、L17、CL、LH1和LH2引自美国。
于2019年4月,分别在各单株的东、南、西、北4个方向采集侧枝嫩芽10~15枚,放入自封袋中,用冰盒带回实验室,于-80 ℃冰箱中保存、备用。
1.2 方法
1.2.1 DNA提取 取200 mg嫩芽,用新型快速植物基因组DNA提取试剂盒(北京百泰克生物技术有限公司)提取DNA,用Berthold Colibri超微量分光光度计(德国Berthold Technology公司)检测DNA的浓度和纯度,用双蒸水将DNA质量浓度稀释至5~10 ng·μL-1,置于-20 ℃冰箱中保存、备用。
1.2.2 PCR扩增 参照文献[3]合成6对SSR引物TA0158、TA0231、TA0236、TA0438、TA0440和TA0443,在每对引物的正向引物5′端加FAM荧光标记,由上海捷瑞生物工程有限公司合成荧光引物。
用EDC-810 PCR仪(北京东胜创新生物科技有限公司)进行PCR扩增反应。扩增体系包括10×buffer 1.50 μL、2.5 mmol·L-1dNTPs 0.30 μL、25 mmol·L-1MgCl21.50 μL、5 ng·L-1DNA样品1.00 μL、TaqDNA聚合酶0.30 μL以及10 μmol·L-1正向和反向引物各0.15 μL,用双蒸水补足至15.00 μL。扩增程序为:94 ℃预变性 3 min;94 ℃变性15 s、55 ℃退火15 s、72 ℃延伸30 s,共35个循环;72 ℃延伸3 min。扩增产物置于4 ℃保存。
1.2.3 毛细管电泳检测 扩增产物先经质量体积分数1.0%琼脂糖凝胶电泳检测,然后将扩增产物稀释10倍,并与ROX 500内标(上海捷瑞生物工程有限公司)混匀;混合物经95 ℃变性5 min后迅速冰浴3 min,用3730XL基因测序仪(美国ABI公司)进行毛细管电泳检测[12]。
1.3 数据处理和分析
对SSR荧光标记条带进行分析,统计每对引物的所有多态性位点;某一位点上有条带记为“1”,无条带记为“0”,形成6对引物的“0”、“1”矩阵,据此构建供试96个样本的SSR分子标记指纹图谱。
采用PIC-CALC 2.0软件计算各引物的多态性信息含量指数(PIC);基于各引物扩增的多态性条带,采用PopGene32软件计算供试96个样本的Nei’s基因多样性指数(H)、Shannon’s多态性信息指数(I)、观测杂合度(Ho)和期望杂合度(He)。
参照文献[13]计算供试的‘中山杉’系列品种间以及池杉、墨西哥落羽杉和落羽杉单株间的Nei’s遗传一致度和Nei’s遗传距离;并将供试96个样本的Nei’s遗传距离矩阵导入MEGA 5.0软件,构建NJ聚类图。
2 结果和分析
2.1 SSR分子标记的多态性分析和指纹图谱构建
2.1.1 多态性分析 基于6对SSR引物的多态性条带数量计算供试样本间的遗传多样性参数,结果见表1。由表1可见:6对SSR引物共检测到48个等位基因,平均每对引物扩增出8个等位基因;共检测到条带91条,每对引物的扩增条带数为9~31,平均值为15.2,其中,引物TA0158扩增的条带数最多(31),引物TA0231和TA0438扩增的条带数较少(9)。6对引物的多态性条带数为6~27,多态性条带数总数为68;每对引物扩增的多态性条带数平均值为11.3;多态性条带百分率平均值为70.9%。各引物的多态性信息含量指数为0.476~0.793,平均值为0.658。
由表1还可见:供试96个样本的Nei’s基因多样性指数为0.690~0.843,平均值为0.755;Shannon’s多态性信息指数为1.391~2.088,平均值为1.599;观测杂合度为0.071~0.714,平均值为0.381;期望杂合度为0.157~0.310,平均值为0.245。

表1 6对SSR引物扩增条带的多态性及供试落羽杉属样本间的遗传多样性参数Table 1 Polymorphism of amplified bands of 6 pairs of SSR primers and genetic diversity parameter among test samples of Taxodium Rich.
2.1.2 指纹图谱 依据SSR分子标记分析结果, 40个‘中山杉’系列品种的SSR指纹图谱见表2; 15个池杉、23个墨西哥落羽杉和18个落羽杉单株的SSR指纹图谱见表3。

表2 基于SSR引物TA0158、TA0236、TA0440和TA0443扩增条带构建的‘中山杉’系列品种的指纹图谱Table 2 Fingerprints of Taxodium ‘Zhongshanshan’ series cultivars constructed based on amplified bands of SSR primer TA0158, TA0236,TA0440 and TA0443

表3 基于SSR引物TA0158、TA0231、TA0236、TA0438、TA0440和TA0443扩增条带构建的池杉、墨西哥落羽杉和落羽杉单株的指纹图谱Table 3 Fingerprints of individuals of Taxodium distichum var. imbricatum (Nuttall) Croom, T. mucronatum Tenore and T. distichum (Linn.) Rich. constructed based on amplified bands of SSR primer TA0158, TA0231, TA0236,TA0438,TA0440 and TA0443
由表2可见:运用4对SSR引物TA0158、TA0236、TA0440和TA0443的扩增条带就可以构建40个‘中山杉’系列品种的指纹图谱,指纹编码数量为33,鉴别率达85.0%,这4对SSR引物可作为鉴定‘中山杉’系列品种的核心引物。除‘中山杉111’与‘中山杉123’、‘中山杉407’与‘中山杉503’、‘中山杉1074’与‘中山杉1021’的指纹图谱分别相同外,通过该SSR指纹图谱可鉴别其他34个‘中山杉’系列品种。
由表3可见:运用6对SSR引物TA0158、TA0231、TA0236、TA0438、TA0440和TA0443的扩增条带可以构建15个池杉、23个墨西哥落羽杉和18个落羽杉共56个单株的指纹图谱,指纹编码数量为49,鉴别率达91.1%。除墨西哥落羽杉单株A2、A4与B4以及墨西哥落羽杉单株JM2与JM3的指纹图谱分别相同外,通过该SSR指纹图谱可鉴别其他51个单株。
2.2 遗传关系和聚类分析
2.2.1 遗传关系分析 对供试的‘中山杉’系列品种以及池杉、墨西哥落羽杉和落羽杉单株的Nei’s遗传一致度和Nei’s遗传距离进行计算,结果显示:‘中山杉’系列品种与池杉、墨西哥落羽杉和落羽杉的Nei’s遗传一致度分别为0.699、0.893和0.871,Nei’s遗传距离分别为0.358、0.114和0.137,表明‘中山杉’系列品种与墨西哥落羽杉和落羽杉的遗传关系较近,而与池杉的遗传关系较远。在池杉、墨西哥落羽杉和落羽杉间,池杉与墨西哥落羽杉和落羽杉的Nei’s遗传一致度分别为0.657和0.845,Nei’s遗传距离分别为0.420和0.169;落羽杉与墨西哥落羽杉的Nei’s遗传一致度为0.857,Nei’s遗传距离为0.154,表明池杉与落羽杉的遗传关系较近,而与墨西哥落羽杉的遗传关系较远。
2.2.2 聚类分析 根据Nei’s遗传距离对供试的96个样本进行聚类分析,结果见图1。结果显示:在Nei’s遗传距离0.405处,96个样本首先被分为2大类,其中,除C6、C7和ZM6外的其他12个池杉单株聚为Ⅰ大类,其余84个样本聚为Ⅱ大类。在Nei’s遗传距离0.310处,Ⅱ大类可进一步分为5组,其中,‘中山杉1302’、落羽杉单株L15和‘中山杉1305’分别单独成组,即Ⅱ1、Ⅱ2和Ⅱ3组;‘中山杉1304’、‘中山杉112’、‘中山杉149’、9个落羽杉单株和1个池杉单株聚为Ⅱ4组;其余68个样本聚为Ⅱ5组,其中供试的23个墨西哥落羽杉单株均被聚在此组中。
大多数池杉单株聚为一大类,而落羽杉和墨西哥落羽杉的所有单株与‘中山杉’系列品种聚为另一大类,说明池杉与供试‘中山杉’系列品种的遗传关系较远,而落羽杉和墨西哥落羽杉则与供试‘中山杉’系列品种的遗传关系较近,特别是墨西哥落羽杉,与大多数‘中山杉’系列品种的遗传关系更近。
3 讨论和结论
基于聚丙烯酰胺凝胶电泳(PAGE)技术,王紫阳等[3]利用7对SSR引物构建26个落羽杉属样本的指纹图谱,鉴别率为84.6%。本研究采用荧光标记毛细管电泳技术,利用其中4对SSR引物建立的40个‘中山杉’系列品种的指纹图谱,鉴别率达85.0%;而利用6对SSR引物建立的池杉、墨西哥落羽杉和落羽杉的56个单株的指纹图谱,鉴别率可达91.1%,说明相较于PAGE技术,荧光标记毛细管电泳技术具有较高的分辨率。
王紫阳等[3]的研究结果显示:6对SSR引物TA0158、TA0231、TA0236、TA0438、TA0440和TA0443扩增条带的多态性信息含量指数(PIC)分别为0.514、0.362、0.677、0.488、0.393和0.420,平均值为0.476。而本研究中,同样6对SSR引物的PIC值分别为0.793、0.666、0.626、0.476、0.764和0.625,平均值为0.658,各引物的PIC值明显提高。PIC值越高,表明SSR分子标记的多态性越丰富[14]。若PIC<0.25,表示引物具有低度多态性;若0.25
SSR分子标记通常是共显性标记,呈共显性的引物有3种带型,即只有父本带、只有母本带和亲本杂合带[16-17]。本研究中,针对‘中山杉’系列品种进行SSR分子标记扩增,在排除信息错误后,其中有些品种的扩增条带出现了亲本中没有的新条带,例如:经四碱基(CCTT)5重复SSR引物TA0443扩增后,‘中山杉1002’出现2条长度分别为182和190 bp的条带,而其父本落羽杉单株L4仅有1条长度为182 bp的条带,母本墨西哥落羽杉单株DD出现2条长度分别为182和186 bp的条带,从中可以看出‘中山杉1002’出现的长度为190 bp的条带是其双亲本均没有的新条带。在鸭茅(DactylisglomerataLinn.)[18]和茄(SolanummelongenaLinn.)[19]的SSR分子标记扩增条带中也存在这一现象,这种情况可能是由于在配子体形成过程中,染色体减数分裂时同源染色体发生配对与交换,染色体复制过程中存在碱基突变等现象,从而表现出DNA条带的消失或新条带的出现[18-19]。
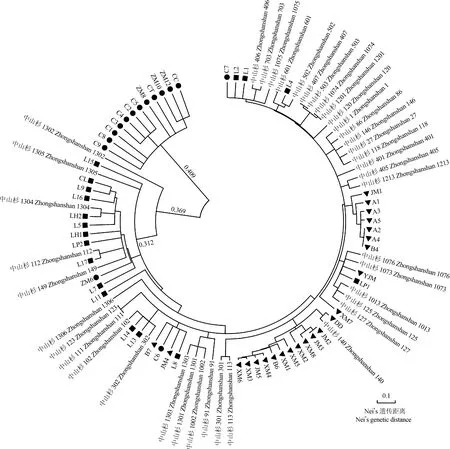
: 池杉单株 Individuals of Taxodium distichum var. imbricatum(Nuttall) Croom; : 墨西哥落羽杉单株Individuals of T. mucronatum Tenore; : 落羽杉单株Individuals of T. distichum (Linn.) Rich.图1 40个‘中山杉’系列品种以及56个池杉、墨西哥落羽杉和落羽杉单株的NJ聚类图Fig. 1 NJ dentrogram of 40 cultivars of Taxodium ‘Zhongshanshan’ series and 56 individuals of T. distichum var. imbricatum (Nuttall) Croom, T. mucronatum Tenore and T. distichum (Linn.) Rich.
在供试的40个‘中山杉’系列品种中,仅少数品种以池杉为亲本杂交获得,所有品种均是以墨西哥落羽杉或墨西哥落羽杉的杂交后代为亲本杂交或回交后获得的品种,因而在NJ聚类图上,大多数池杉单株聚为一大类,所有墨西哥落羽杉单株与所有‘中山杉’系列品种被聚在另一大类中,说明墨西哥落羽杉单株与 ‘中山杉’系列品种有较近的遗传关系。由此可见,SSR分子标记可在一定程度上追溯‘中山杉’系列品种与其亲本间的亲缘关系。
从19世纪至今,对落羽杉属下类群的分类处理一直存在争议[20]。本研究中,从供试的池杉、墨西哥落羽杉和落羽杉单株的Nei’s遗传距离看,池杉与落羽杉的遗传关系更近,与Lickey等[21]基于形态学证据对这2个类群遗传关系的研究结果一致,印证了将池杉作为落羽杉变种[1]59的分类处理。从上述的聚类图可见:部分‘中山杉’系列品种与其父本关系更近(如‘中山杉302’与其父本落羽杉),部分‘中山杉’系列品种与其母本关系更近(如‘中山杉401’与其母本墨西哥落羽杉),还有部分‘中山杉’系列品种难以判断与亲本的关系(如‘中山杉1002’);虽然大多数池杉单株聚为一类,落羽杉和墨西哥落羽杉单株以及全部的‘中山杉’系列品种聚为另一大类,但还有少数池杉单株与落羽杉和墨西哥落羽杉单株有较近的Nei’s遗传距离,导致这一现象的原因可能是这3个类群的原分布区域互相重叠,可产生自然杂交的后代。
植物不同种间杂交或基因渗透在自然界非常普遍,如松属(PinusLinn.)种类间存在的基因渗透现象[22]。落羽杉属的种类可能也存在类似现象,如:McMillan[23]在美国德克萨斯州墨西哥落羽杉与落羽杉的重叠分布区域,观察到大量的具有二者中间特征和结实种子的后代;Lickey等[24]在研究中也发现了大量池杉和落羽杉的中间类型个体。落羽杉属种类通过这种自然杂交过程产生的基因交换,使各种类的遗传多样性水平提高,且‘中山杉’系列品种在育种过程中反复杂交和回交也使不同品种的遗传多样性水平存在较大差异,如供试96个样本的Nei’s基因多样性指数和Shannon’s多态性信息指数分别为0.690~0.843和1.391~2.088,平均值分别达到0.755和1.599,为‘中山杉’系列品种的改良奠定了丰富的遗传基础。
综合分析结果表明:供试96个样本的遗传多样性较高,依据SSR分子标记构建的40个‘中山杉’系列品种以及落羽杉属3个类群56个单株的指纹图谱,对供试样本的鉴别率分别达到85.0%和91.1%,因而,可以采用毛细管电泳技术并运用SSR分子标记构建落羽杉种质资源的指纹图谱。此外,通过聚类分析,发现供试的部分‘中山杉’系列品种及其亲本间的遗传关系较为混乱,因而,在后续的还应进一步借助多学科手段对落羽杉属的种质资源进行鉴定。
