黄毛草莓编码NB-ARC结构域的FnCN基因和启动子克隆及FnCN基因表达分析
2020-08-10胡玉慈姚立萍何淑敏唐鑫彪陈清西文志丰
胡玉慈, 姚立萍, 张 童, 何淑敏, 唐鑫彪, 陈清西,①, 文志丰,①
(1. 福建农林大学园艺学院, 福建 福州 350002; 2. 福州市农业科学研究所, 福建 福州 350018;>3. 中国农业科学院蔬菜花卉研究所, 北京 100081)
植物抗性(resistance,R)基因可介导植物对各种病原体的防御反应,如细菌、真菌和病毒,甚至是一些昆虫和线虫等[1],大多数R基因可编码NB-ARC类抗病蛋白[2],该类抗病蛋白根据N端结构域的不同进一步分为含有TIR(toll/interleukin-1 receptor)的TNL(TIR-NB-ARC-LRR)蛋白、含有CC(coiled-coil)的CNL(CC-NB-ARC-LRR)蛋白以及含有RPW8(resistance to powdery mildew 8)的RNL(RPW8-NB-ARC-LRR)蛋白[3-4]。植物基因组内编码NB-ARC结构域的抗病基因在其抵御病原菌侵染时起重要作用[1-2]。Jia等[5]研究发现,在植物基因组中,约有0.2%~1.6%基因被预测为NB-ARC编码基因。迄今为止,已从苹果(MaluspumilaMill.)[6]、山葡萄(VitisamurensisRupr.)[7]、陆地棉(GossypiumhirsutumLinn.)[8]、草莓(Fragaria×ananassaDuch.)[9]、番茄(LycopersiconesculentumMill.)[10]和花生(ArachishypogaeaLinn.)[11]等植物中克隆到NB-ARC类抗病基因,大多数NB-ARC类抗病基因能响应病原菌的侵染,并通过水杨酸(salicylic acid,SA)、茉莉酸(jasmonie acid,JA)和脱落酸(abscisic acid,ABA)等信号途径来调控植物对病原菌的防御反应。此外,有研究发现草莓FaNBS编码基因可进一步融合WRKY、Pkinase、MBY和RPW8等结构域发挥其抗病作用[12]。
草莓隶属于蔷薇科(Rosaceae)草莓属(FragariaLinn.),为多年生草本植物,其栽培面积和产量居世界小浆果生产的首位[13]。由炭疽菌(Colletotrichumspp.)引发的草莓炭疽病是对草莓破坏性极大的病害之一,可造成80%以上的草莓幼苗死亡,损失50%以上的产量[14]。目前,对草莓炭疽病的防治仍然采用喷施农药的化学防治,而化学防治易造成果实残毒和环境污染,降低了草莓鲜食及加工产品的品质,因此,培育草莓抗病品种是最经济且有效控制病害的方法[15-16]。黄毛草莓(FragarianilgerrensisSchlecht. ex Gay)对叶斑病、炭疽病和蚜虫等病虫害具有较强的抗性,有重要的育种价值[17]。黄毛草莓主要分布在亚洲东南部,在中国分布于湖南、湖北、云南、贵州、四川、陕西和台湾等地[18]。马鸿翔等[19]研究发现,黄毛草莓叶斑病和炭疽病的田间自然发病率较低,且与部分栽培种杂交后其抗病性能遗传。黄金凤[20]通过田间自然发病和接种评价方法,发现黄毛草莓对炭疽病有较强抗性。从黄毛草莓中克隆相关抗病基因并明确其抗病机制,对深入了解黄毛草莓抗病机制及培育抗炭疽病草莓品种具有重要意义。
黄毛草莓对外界不良环境抗性强、适应性好,对草莓品种改良具有重大意义。预实验结果显示:黄毛草莓离体叶片接种胶孢炭疽菌〔Colletotrichumgloeosporioides(Penz.) Sacc.〕后,发病率仅27.78%,病情指数为16.92,说明黄毛草莓对草莓炭疽病具有较强抗性,但目前国内外对黄毛草莓抗炭疽病方面的研究较少。作者所在课题组前期对黄毛草莓接种胶孢炭疽菌,利用转录组测序技术从黄毛草莓中筛选到1个受胶孢炭疽菌诱导表达的序列。本研究利用同源克隆技术从黄毛草莓中获得CN基因及其启动子序列,对该基因编码的氨基酸序列进行生物信息学分析,同时构建了该基因的植物过表达载体和病毒诱导基因沉默(virus induced gene silencing,VIGS)载体,并利用实时荧光定量PCR技术对接种胶孢炭疽菌后的黄毛草莓叶片中CN基因的转录水平进行了检测,以期为明确黄毛草莓CN基因的抗病功能提供初步依据。
1 材料和方法
1.1 材料
供试黄毛草莓由北京市农林科学院张运涛课题组提供,栽培于福建农林大学园艺学院果树抗病与遗传育种实验室,胶孢炭疽菌菌株Lch-1911由湖北省农业科学院韩永超副研究员馈赠。
大肠杆菌(Escherichiacoli)DH5α感受态细胞、植物过表达载体pCAMBIA1301-HA和烟草脆裂病毒载体pTRV2由福建农林大学园艺学院果树抗病与遗传育种实验室保存。氨苄青霉素(ampicillin,Amp)和卡那霉素(kanamycin,Kana)购自生工生物工程(上海)股份有限公司;PCR Master Mix、RNAprep Pure多糖多酚植物总RNA提取试剂盒、DNA Secure Plant Kit植物基因组DNA提取试剂盒、Universal DNA Purification Kit DNA纯化回收试剂盒和TIANprep Mini Plasmid Kit质粒小提试剂盒购自天根生化科技(北京)有限公司;BamHⅠ、KpnⅠ和XbaⅠ限制性内切酶,DNA Marker,pMD20-T载体,Solution Ⅰ,PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit反转录试剂盒,PrimeScript©RT reagent Kit反转录试剂盒以及RR820A SYBR Premix ExTaqⅡ荧光定量试剂盒购自日本Takara公司。
1.2 方法
1.2.1 处理方法 参照韩永超等[21]的方法制备胶孢炭疽菌分生孢子悬浮液,将胶孢炭疽菌接种至新鲜PDA培养基上,于温度28 ℃、避光条件下活化3~5 d,再从活化后的菌落边缘取菌丝块转接到含体积分数0.05%酵母提取液的PDA培养基上,于温度28 ℃、避光条件下培养至平板上长出橘红色分生孢子,用灭菌枪头或牙签将菌丝轻轻刮下,无菌水冲洗、重悬,通过4层纱布滤去菌丝和培养基杂质,使用血球计数板和DMi8倒置荧光显微镜(德国Leica公司),用无菌水稀释为孢子浓度1×106mL-1的孢子悬浮液,置于4 ℃条件下备用。
参照Zhang等[22]的方法,处理组将胶孢炭疽菌分生孢子悬浮液接种到活体黄毛草莓叶片上,对照组接种无菌水,每组分别从15株生长健康的黄毛草莓植株上取由上至下第3至第6位叶片,共接种50枚叶片,然后放置在人工气候室培养,培养条件为温度25 ℃、空气相对湿度70%、光照时间12 h·d-1及光照强度125 μmol·m-2·s-1。接种后0、3、6、12、24、48和72 h每组在同一时间随机采集2~3枚叶片置于液氮中速冻,然后置于-80 ℃冰箱中保存、备用,每组3次重复。
1.2.2 黄毛草莓CN基因和启动子克隆 用无菌剪刀剪取无病虫害、生长势良好的5枚新叶,装入无菌自封袋后迅速放入冰盒中,备用。将叶片置于液氮中研磨成粉末状,以RNAprep Pure多糖多酚植物总RNA提取试剂盒提取的RNA为模板反转录合成cDNA第1链,再利用DNA Secure Plant Kit植物基因组DNA提取试剂盒提取DNA。采用Primer 5.0软件设计扩增黄毛草莓CN基因完整开放阅读框(ORF)的正向和反向引物,FnCN-F序列为5′-ATGGAGTTTGCCGCCATCATTGCT-3′,FnCN-R序列为5′-AAGTCTGTTATGTGTGGGATAA-3′。设计黄毛草莓CN基因起始密码子上游启动子序列的正向和反向引物,P-FnCN-F序列为5′-ATCCTCCCTGCCAATGAAAAGACG-3′,P-FnCN-R序列为5′-GAAGAGAGAAAGAGAGGTTTTATG-3′。分别以cDNA第1链和叶片DNA为模板进行PCR扩增,扩增体系总体积为25.0L,包括2×TaqPCR Master Mix 12.5L、正向和反向引物各1.0L、模板1.0L和无菌水9.5L。扩增程序为:94 ℃预变性90 s;94 ℃变性30 s、57 ℃退火30 s、72 ℃延伸90 s,38个循环;72 ℃延伸5 min。PCR反应产物经质量体积分数1%琼脂糖凝胶电泳检测后用Universal DNA Purification Kit DNA纯化回收试剂盒回收目的片段,将回收产物连接到pMD20-T载体上,然后转化到大肠杆菌DH5α感受态细胞中,菌液涂布于含100 mg·L-1Amp的LB平板上进行筛选,挑取阳性单菌落进行PCR检测,将条带正确的5个阳性克隆菌株送至铂尚生物技术(福州)有限公司测序。
1.2.3 生物信息学分析 利用ORF Finder(http:∥www.bioinformatics.org/sms2/orf_find.html)预测黄毛草莓CN基因编码的氨基酸序列;利用NCBI网站中BLAST程序(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)预测其保守结构域和寻找同源性较高的氨基酸序列;使用DNAMAN 7.0软件进行不同种类间同源基因编码氨基酸序列的相似性比较;使用MEGA 6.0软件中的邻接(NJ)法构建系统进化树;利用Expasy-ProParam (https:∥web.expasy.org/protparam/)预测黄毛草莓CN基因编码氨基酸序列的理化性质;通过在线网站SignalP 4.1(http:∥www.cbs.dtu.dk/services/SignalP-4.1/?tdsourcetag=s_pctim_aiomsg)进行信号肽预测;使用TMHMM软件(http:∥www.cbs.dtu.dk/services/TMHMM/)进行跨膜预测;利用在线工具PSORT Prediction(http:∥psort.hgc.jp/form2.html)进行亚细胞定位预测;利用SOPMA(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测黄毛草莓CN蛋白的二级结构;利用PlantCARE数据库(http:∥bioinformatics.psb.ugent.be/webtools/plantcare/html/)对启动子序列进行顺式作用元件预测。
1.2.4 植物过表达载体和病毒诱导基因沉默载体构建 根据上述测序结果设计带有BamHⅠ和KpnⅠ酶切位点的植物过表达载体引物,FnCN-over-F序列为5′-CGGGATCCCGATGGAGTTTGCCGCCATCATTGCT-3′,FnCN-over-R序列为5′-GGGGTACCCCTTCTCCCACACATAACAGACTTTT-3′,进行PCR扩增,扩增体系和程序同1.2.2。用BamHⅠ和KpnⅠ对FnCN-over质粒和植物过表达载体pCAMBIA1301-HA质粒进行双酶切,回收目的基因小片段和植物过表达载体大片段。根据黄毛草莓CN基因的沉默区间设计带BamHⅠ和XbaⅠ酶切位点的病毒诱导基因沉默载体引物,TRV2-FnCN-F序列为5′-GCTCTAGAGCCCAACAACCATGGGCGTGTCAAAG-3′,TRV2-FnCN-R序列为5′-CGGGATCCCGGTTTTCTGAGACACATACCCACAT-3′,进行PCR扩增,扩增体系和程序同1.2.2。用BamHⅠ和XbaⅠ对TRV2-FnCN质粒和病毒载体pTRV2进行双酶切,获得目的基因小片段和病毒载体大片段。用Solution Ⅰ连接双酶切基因小片段和载体大片段,转化到大肠杆菌DH5α感受态细胞,用含100 mg·L-1Kana的LB培养基进行筛选,挑取单菌落进行PCR检测,培养阳性菌株提取质粒进行酶切验证,选取5个条带正确的阳性菌株送至铂尚生物技术(福州)有限公司测序。
1.2.5 黄毛草莓CN基因实时荧光定量PCR(RT-qPCR)分析 采用RT-qPCR检测黄毛草莓叶片在接种胶孢炭疽菌后0、3、6、12、24、48和72 h黄毛草莓CN基因的相对表达量,以草莓Actin基因(GenBank登录号AB116565)为内参基因。使用PrimeScript©RT reagent Kit反转录试剂盒反转录合成cDNA用于RT-qPCR定量分析,RT-qPCR扩增引物Real-FnCN-F序列为5′-CGCCATCATTGCTGAGAACA-3′,Real-FnCN-R序列为5′-GCGTACCTGTCCTTTGACAC-3′。内参基因扩增引物Real-FnActin-F序列为5′-GCCAGAAAGATGCTTATGTCGGTG-3′,Real-FnActin-R序列为5′-TGGGGCAACACGAAGCTCAT-3′。扩增体系总体积为12.50L,包括SYBR Premix ExTaqTM6.25L、正向和反向引物各0.50L、cDNA模板1.00L和无菌水4.25L。扩增程序为:95 ℃预变性30 s;95 ℃变性5 s、60 ℃退火30 s,40个循环。每个样品均设置3次生物学重复和技术重复,采用2-ΔΔCT法[23]分析黄毛草莓CN基因的相对表达量。
1.3 数据处理
采用EXCEL 2010和SPSS 20.0软件进行数据分析,采用单因素方差分析和Duncan’s多重比较方法进行差异显著性分析。
2 结果和分析
2.1 黄毛草莓FnCN基因和启动子克隆及序列分析结果
2.1.1 黄毛草莓FnCN基因克隆及序列分析 根据获得的黄毛草莓转录组数据与野草莓(FragariavescaLinn.)相同的unigene,通过Primer 5.0软件设计,利用引物FnCN-F和FnCN-R,以黄毛草莓叶片cDNA为模板进行PCR扩增,得到1个长度约1 000 bp的条带(图1)。然后进行连接转化、菌液PCR检测阳性克隆及测序,结果显示:黄毛草莓FnCN基因的开放阅读框长度为933 bp(GenBank登录号MN240290),共编码310个氨基酸残基。通过生物信息学分析,FnCN基因编码的氨基酸序列的N端包含1个Rx-CC结构域,C端包含1个保守的NB-ARC结构域(图2)。上述结果表明:FnCN基因属于NB-ARC类基因家族。

M: DL2000 DNA marker; 1: FnCN基因FnCN gene.图1 黄毛草莓FnCN基因的PCR扩增结果Fig. 1 PCR amplification result of FnCN gene from Fragaria nilgerrensis Schlecht. ex Gay

首尾方框分别示起始密码子和终止密码子The boxes in the beginning and end represent start codon and stop codon, respectively; Rx-CC,NB-ARC: 结构域Domain.图2 黄毛草莓FnCN基因的核苷酸序列及其编码的氨基酸序列Fig. 2 Nucleotide sequence of FnCN gene from Fragaria nilgerrensis Schlecht. ex Gay and its encoding amino acid sequence
2.1.2 启动子克隆及序列分析 利用引物P-FnCN-F和P-FnCN-R从黄毛草莓基因组DNA中扩增得到1个长度约900 bp的启动子条带(图3)。测序结果显示,该启动子序列的长度为910 bp,命名为pFnCN(GenBank登录号MN240291)。利用PlantCARE数据库对该序列进行顺式作用元件预测,结果(图4)表明:该启动子不仅含有TATA-box(核心启动子元件)和CAAT-box(启动子和增强子区的顺式作用元件)等基本顺式作用元件,还存在TGACG-motif(茉莉酸甲酯响应元件)、ABRE(脱落酸响应元件)、MBS(干旱诱导MYB结合位点)、G-box(光响应元件)、GT1-motif(光响应元件)和ARE(厌氧诱导顺式作用元件)等。说明黄毛草莓FnCN基因能响应多种植物激素的诱导,在黄毛草莓受到逆境胁迫时可能发挥重要作用。

M: DL2000 DNA marker; 1: FnCN基因启动子FnCN gene promoter.图3 黄毛草莓FnCN基因启动子的PCR扩增结果Fig. 3 PCR amplification result of FnCN gene promoter from Fragaria nilgerrensis Schlecht. ex Gay

CAAT-box: 启动子和增强子区的顺式作用元件Cis-acting element in promoter and enhancer regions; ABRE: 脱落酸响应元件Abscisic acid responsive element; TATA-box: 核心启动子元件Core promoter element; MBS: 干旱诱导MYB结合位点MYB binding site in drought induction; ARE: 厌氧诱导顺式作用元件Cis-acting element in anaerobic induction; GT1-motif,G-box: 光响应元件Light responsive element; TGACG-motif: 茉莉酸甲酯响应元件Methyl jasmonate responsive element.图4 黄毛草莓FnCN基因启动子序列及其顺式作用元件Fig. 4 Sequence of FnCN gene promoter and its cis-acting element from Fragaria nilgerrensis Schlecht. ex Gay
2.2 黄毛草莓FnCN基因编码氨基酸序列的理化性质及同源性分析
2.2.1 理化性质分析 Expasy-ProParam预测结果表明:黄毛草莓FnCN基因编码氨基酸序列的分子式为C1567H2524N432O475S9,理论相对分子质量为35 304.43,理论等电点为pΙ 5.43,不稳定系数为29.57,脂肪系数为104.00,总平均亲水性(GRAVY)为-0.279,推测FnCN蛋白为稳定的亲脂亲水性蛋白。SignalP 4.1预测结果表明:FnCN基因编码的氨基酸序列无信号肽,说明FnCN蛋白不是分泌蛋白。TMHMM预测结果表明:FnCN基因编码氨基酸序列中第1至第310位的氨基酸残基均在膜外,表明其不存在跨膜区。PSORT Prediction预测结果表明:FnCN蛋白在细胞质中的可能性较大,推测FnCN蛋白位于细胞质中。SOPMA预测结果表明:FnCN蛋白二级结构中包含63.55%的α-螺旋(α-helix)、22.26%的无规则卷曲(random coil)、11.61%的延伸链(extended strand)以及2.58%的β-转角(β-turn)。
2.2.2 同源序列比对和进化树分析 BLAST分析结果显示:黄毛草莓FnCN基因与GenBank上已经公布的野草莓(GenBank登录号XP_004306372.1)、月季花(RosachinensisJacq.,GenBank登录号XP_024155851.1)和白梨(PyrusbretschneideriRehd.,GenBank登录号XP_009334476.1)的CN基因编码的氨基酸序列的相似性分别为95.16%、77.42%和55.77%。氨基酸序列同源性比较结果(图5)表明:黄毛草莓FnCN基因与野草莓CN基因编码氨基酸序列的同源性最高,其次为月季花和白梨。
系统进化树(图6)显示:黄毛草莓和野草莓首先聚在一起,然后再与月季花聚为一个分支,三者均为蔷薇亚科(Subfam. Rosoideae Focke)植物,说明这3个种类的进化关系较近,加之其同源性也较高,推测其蛋白质功能也相近。山荆子〔Malusbaccata(Linn.) Borkh.,GenBank登录号TQE08476.1〕、白梨、梅(ArmeniacamumeSieb.,GenBank登录号XP_008238997.1)、桃(AmygdaluspersicaLinn.,GenBank登录号XP_020420253.1)、苹果(MaluspumilaMill.,GenBank登录号XP_008361183.2)、欧洲甜樱桃〔Cerasusavium(Linn.) Moench,GenBank登录号XP_021802074.1〕和扁桃(AmygdaluscommunisLinn.,GenBank登录号BBH04143.1)聚为另一个分支,与黄毛草莓的亲缘关系较远。
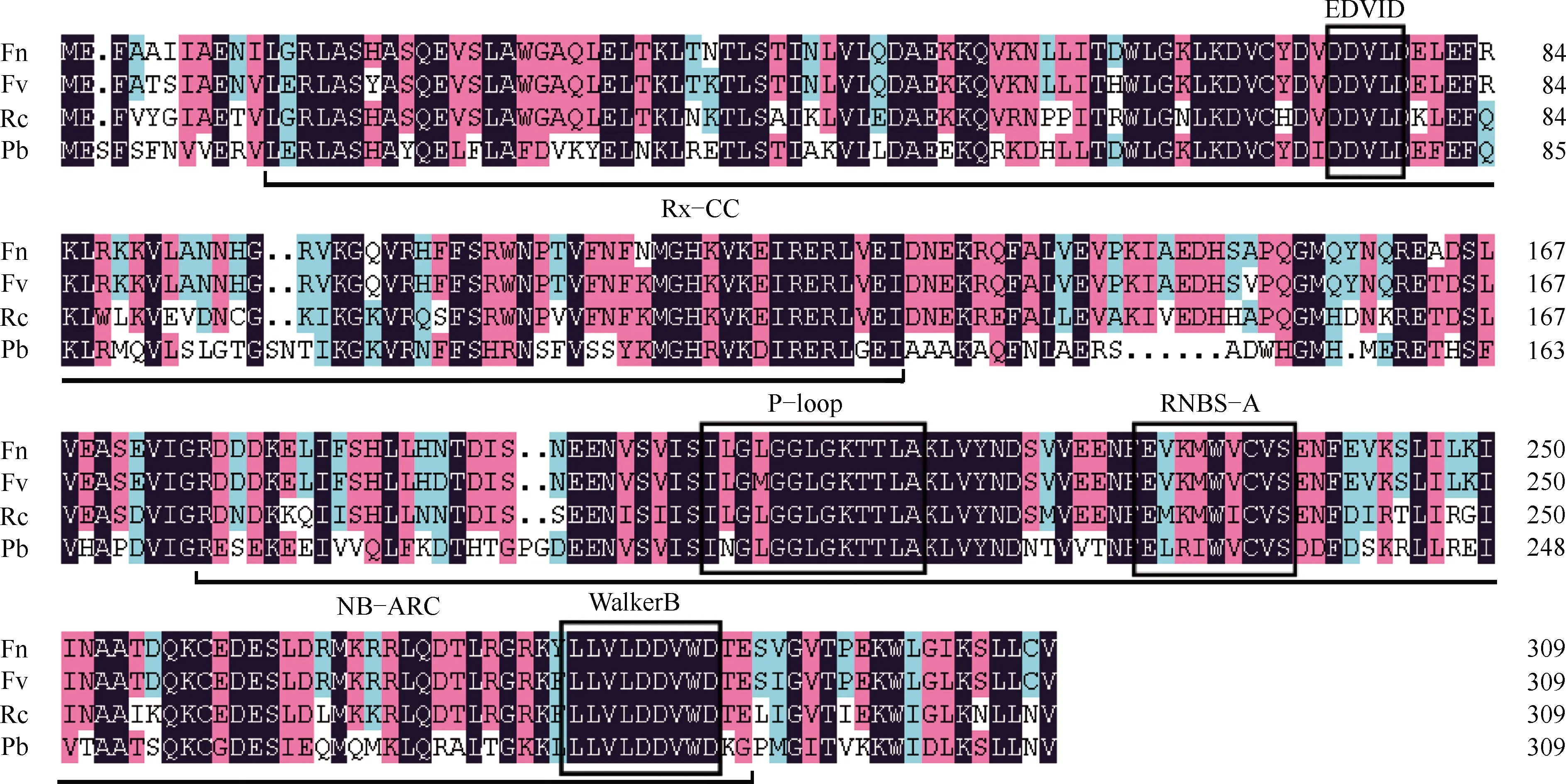
Fn: 黄毛草莓Fragaria nilgerrensis Schlecht. ex Gay; Fv: 野草莓Fragaria vesca Linn.; Rc: 月季花Rosa chinensis Jacq.; Pb: 白梨Pyrus bretschneideri Rehd. EDVID,P-loop,RNBS-A,WalkerB: 基序Motif; Rx-CC,NB-ARC: 结构域Domain.图5 黄毛草莓FnCN基因与其他种类CN基因编码氨基酸序列的同源性比较结果Fig. 5 Homology comparison result of amino acid sequences encoded by FnCN gene from Fragaria nilgerrensis Schlecht. ex Gay and by CN gene from other species

遗传距离 Genetic distance分支上数据为置信度Datums in the branches are confidence. Mb: 山荆子Malus baccata (Linn.) Borkh.; Pb: 白梨Pyrus bretschneideri Rehd.; Am: 梅Armeniaca mume Sieb.; Ap: 桃Amygdalus persica Linn.; Mp: 苹果Malus pumila Mill.; Ca: 欧洲甜樱桃Cerasus avium (Linn.) Moench; Ac: 扁桃Amygdalus communis Linn.; Rc: 月季花Rosa chinensis Jacq.; Fn: 黄毛草莓Fragaria nilgerrensis Schlecht. ex Gay; Fv: 野草莓Fragaria vesca Linn.图6 黄毛草莓FnCN基因与其他种类CN基因编码氨基酸序列的系统进化树Fig. 6 Phylogenetic tree of amino acid sequences encoded by FnCN gene from Fragaria nilgerrensis Schlecht. ex Gay and by CN gene from other species
2.3 植物过表达载体和病毒诱导基因沉默载体的构建
根据序列信息设计带有酶切位点BamHⅠ和KpnⅠ的植物过表达载体引物FnCN-over-F和FnCN-over-R以及BamHⅠ和XbaⅠ酶切位点的病毒诱导基因沉默载体引物TRV2-FnCN-F和TRV2-FnCN-R分别进行PCR扩增,分别获得长度933和445 bp的目的基因片段(图7-A,D)。筛选单菌落进行PCR检测(图7-B,E),提取阳性菌株质粒进行双酶切验证,电泳结果显示2个条带(图7-C,F),对阳性菌株的测序结果与预期构建序列一致,说明成功构建出植物过表达载体pCAMBIA1301-HA-FnCN和病毒诱导基因沉默载体pTRV2-FnCN。
2.4 接种胶孢炭疽菌后FnCN基因的表达分析
实时荧光定量PCR检测结果(图8)显示:对照(接种无菌水)组黄毛草莓叶片FnCN基因的相对表达量变化不大。接种胶孢炭疽菌后,随着时间的推移,FnCN基因的相对表达量呈“降低—升高—降低”的变化趋势,其中,接种后3 hFnCN基因的相对表达量最低;接种后48 hFnCN基因的相对表达量最高,为接种后0 h的3.3倍;接种后24和72 hFnCN基因的相对表达量也显著高于接种后0 h,分别为接种后0 h的2.7和2.6倍。

M1: DL2000 DNA marker; M2: DL5000 DNA marker; 1: FnCN基因过表达区PCR扩增结果PCR amplification result of FnCN gene overexpression region; 2,3: FnCN-over阳性菌株鉴定Positive strain identification of FnCN-over; 4: BamH Ⅰ and Kpn Ⅰ酶切验证pCAMBIA1301-HA-FnCN重组质粒BamH Ⅰ and Kpn Ⅰ digested the recombinant plasmid pCAMBIA1301-HA-FnCN; 5: FnCN基因沉默区PCR扩增结果 PCR amplification result of FnCN gene silencing region; 6-8: pTRV2-FnCN阳性菌株鉴定Positive strain identification of pTRV2-FnCN; 9: BamH Ⅰ和Xba Ⅰ酶切验证pTRV2-FnCN重组质粒BamH Ⅰ and Xba Ⅰ digested the recombinant plasmid pTRV2-FnCN.图7 黄毛草莓FnCN基因植物过表达载体和病毒诱导基因沉默载体的构建Fig. 7 Construction of plant over-expression vector and virus induced gene silencing vector of FnCN gene from Fragaria nilgerrensis Schlecht. ex Gay

: 对照(接种无菌水)The control (inoculated with aseptic water); : 接种胶孢炭疽菌Inoculated with Colletotrichum gloeosporioides (Penz.) Sacc.同一处理不同小写字母表示在0.05水平差异显著 Different lowercases indicate the significant difference at 0.05 level in the same treatment.图8 接种胶孢炭疽菌后黄毛草莓叶片FnCN基因相对表达量的变化Fig. 8 Change in relative expression of FnCN gene from leaf of Fragaria nilgerrensis Schlecht. ex Gay after inoculated with Colletotrichum gloeosporioides (Penz.) Sacc.
3 讨论和结论
植物在生长过程中为抵抗外界不良环境逐渐进化出2个层次的防御机制,一是细胞受体识别病原相关分子模式(pathogen associated molecular patterns,PAMP)触发的免疫反应(PAMP triggered immunity,PTI),二是抗性(resistance,R)蛋白特异性识别病原分泌的效应因子(毒性因子)触发的免疫反应(effectors triggered immunity,ETI)。ETI能进一步引起植物超敏反应(hypersensitive response,HR),较PTI能更加迅速和有效抑制病原菌的侵入[24]。而NB-ARC类抗病蛋白是目前植物中数量最多的一类R蛋白,在不同植物中克隆出的抗病基因中,NB-ARC类抗病基因占80%[25],已成为植物抗病机制研究和抗病育种的研究热点。NB-ARC类抗病蛋白中包含1个或多个结构域,其中,NB-ARC结构域在进化过程中具有较高的保守性,其通过转导核苷酸结合状态ATP/GTP信号,从而调节NB-ARC类抗病蛋白的活性[26]。Rx-CC结构域则缺乏保守性,郝炜[27]发现,Rx-CC结构域的EDVID基序起连接Rx-CC结构域和NB-ARC结构域的桥梁作用,介导二者间的分子相互作用,有利于传递病原效应蛋白的识别信号。本研究利用同源克隆技术从黄毛草莓中克隆到1个NB-ARC类抗病基因FnCN,其编码氨基酸序列中包含1个Rx-CC结构域和1个NB-ARC结构域,表明NB-ARC类抗病基因在进化过程中为了适应多变的环境将具有重要功能的结构域保留下来。
启动子是转录水平上调控基因表达的顺式作用元件,具有转录起始的特异性和表达的高效性[28],Marone等[29]指出,NB-ARC类抗病基因的表达受顺式和反式作用元件的精细调控,因此,对其启动子的结构进行分析对于了解植物的防御机制有重要意义。已有研究结果表明:NB-ARC类抗病基因能响应外源激素胁迫,如‘久香’草莓(Fragaria×ananassa‘Jiuxiang’)叶片经外源茉莉酸甲酯和脱落酸处理后,FaNBS1基因的转录水平发生明显变化,其中,茉莉酸甲酯显著抑制FaNBS1基因的表达[30]。本研究克隆的黄毛草莓FnCN基因上游长度为910 bp的启动子序列中含有植物激素响应元件,如茉莉酸甲酯响应元件TGACG-motif和脱落酸响应元件ABRE等,由此推测FnCN基因的表达受多种激素和环境信号的调控,可能参与了黄毛草莓抵御病害的信号调控。
已有研究结果[31]表明:植物R基因在没有病原体侵染的状态下表达水平相对较低,当植株受到病原体侵染时,R基因表达水平提高,从而增强植株抗性。Wen等[32]研究发现,中国野生华东葡萄(VitispseudoreticulataW. T. Wang)株系白河-35-1(Baihe-35-1)接种白粉菌〔Erysiphenecator(Schw.)〕后,VpCN基因的转录水平是接种前的4.2倍,将该基因进行异源表达,结果表明转基因拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕对白粉病的抗性增强。本研究中,接种胶孢炭疽菌后,黄毛草莓叶片FnCN基因的相对表达量先降低,接种后24~72 h其相对表达量显著高于接种后0 h,表明黄毛草莓FnCN基因在病原菌侵染后先被抑制表达,然后被诱导表达。前人研究发现,SA信号途径主要作用于植物遭受细菌和真菌等病原物侵染,而JA信号途径主要作用于植物受到机械损伤和虫害等创伤,二者在信号转导过程中存在一定的相互拮抗和协同作用[33-34]。张庆雨等[35]研究发现,草莓中FaNBS20基因在外源SA和病原菌的诱导下显著表达,表明FaNBS20基因可能通过SA信号途径参与草莓对炭疽病的防御反应。因此,初步判断FnCN基因可能属于JA信号转导途径上的调控因子,前期黄毛草莓植株通过SA信号途径参与胶孢炭疽菌侵染的防御反应,FnCN基因被抑制表达,随后胶孢炭疽菌侵染信号进一步通过JA信号途径转导,FnCN基因相对表达量显著提高,与SA和JA信号途径上的相关基因共同参与病原菌的抵抗反应。此外,FnCN基因在病原菌侵染前期表达下调的原因可能是FnCN基因在参与识别病原菌侵染信号的过程中,受到上游其他抗病蛋白的调控,所以在侵染前期基因相对表达量呈现降低趋势,在后续研究中将通过酵母单杂交寻找上游调控蛋白。虽然本研究表明FnCN基因可能在黄毛草莓对炭疽病的防御反应中发挥一定作用,但其在黄毛草莓抗炭疽病过程中的具体作用途径尚未明确,在今后的研究中,将利用遗传转化等生物技术对黄毛草莓FnCN基因进行深入研究,进一步明确该基因在黄毛草莓抗炭疽病方面的分子防御功能。
