磷对尾巨桉DH32-29幼苗铝胁迫的缓解效应
2020-08-08黎汤侃潘陆荣李国勇亢亚超滕维超谭长强
黎汤侃,潘陆荣,韦 洁,李国勇,亢亚超,滕维超,谭长强
(1.广西大学林学院,广西南宁 530004;2.南宁市水资源管理服务中心,广西南宁 530218;3.广西壮族自治区林业科学研究院,广西南宁 530002)
铝是地壳中含量最大的金属元素,占地壳总质量的7.7%。我国南方目前大多数的种植地均为酸性土壤,研究表明当pH 值为5.0 以下时,土壤中的铝会从固定状态大量转变为游离状态,形成铝胁迫,即使是微摩尔级别的铝浓度也能影响根系生长,对植物造成损害[1-2]。随着城市化和工业化的大力推进,土壤酸化的情况愈发严重,因此探究植物如何缓解铝胁迫十分必要。
对小麦(Triticum aestivum)[3]和油茶(Camellia oleifera)[4]进行磷缓解铝胁迫的试验,结果表明磷可以缓解铝胁迫对其造成的损害;也有试验结果表明,磷不能缓解铝胁迫造成的损害[5-6]。学者们对磷缓解铝胁迫的机制有多种猜测,一方面可能是磷在酸性环境下与铝离子螯合形成AlPO4沉降,抑制植物对铝的吸收;另一方面可能是由于磷的添加对于植物的生长起到促进作用,改善了植物的营养状态,以此对抗铝胁迫[7];也有学者认为磷激活了植物本身的过氧化氢酶,促进根系分泌有机酸,从而对抗铝胁迫[8];在小麦的分根室试验中,学者推测磷可跨位转移到受铝胁迫的根系部位,发挥缓解机制[9]。对于磷是否能缓解铝胁迫,目前学术界没有较为统一的观点,深入研究磷对铝胁迫的缓解作用及缓解机制有很重要的价值。
桉树是热带亚热带地区极为重要的速生造林树种,也是我国南方木材战略储备的重要材种[10]。目前,城市化和工业化造成的环境污染及持续的施肥使得土壤酸化和重金属污染日益严重[11],酸铝环境对桉树的生长和生理过程产生了显著影响[12-13]。在酸性土壤环境下了解铝胁迫对桉树的危害,对于桉树人工林培育具有重要意义。本研究以尾巨桉(Euca⁃lyptus urophylla×E.grandis)DH32-29幼苗为试验材料,使用分根培养方法,对该树种在不同处理下的生物量、铝含量及磷含量等生长生理指标进行综合分析,研究磷对铝胁迫的缓解作用,并讨论其缓解机制。
1 材料与方法
1.1 试验地概况
试验地位于广西大学林学院实验基地(108°17'E,22°50'N),属亚热带季风气候,年均气温21.6 ℃,年均降水量1 304.2 mm,年均相对湿度80%左右[13]。基地地势平坦,有完备的灌水设施,能保证试验条件完全一致。
1.2 试验材料
材料为尾巨桉DH32-29 组培苗,来源于广西壮族自治区林业科学研究院。组培苗为2 个月的幼苗,高度为(5.4 ± 0.2)cm。培养基质为透水性良好的灭菌河沙,前期使用塑料杯(杯口直径7 cm,高7.8 cm)进行培养,后期移植至容积为14 L(27 cm×21 cm×31 cm)的底部透水塑料桶中进行处理。
1.3 试验设计
采用盆栽试验方法,对幼苗进行分根处理,将幼苗的根系分为两部分,分别栽于2 个相连的塑料桶内。2018年4月14日开始,将桉树幼苗的根基部用自来水洗净,并用1‰的多菌灵整株消毒20 min,将根部平均分为两份,每份置于1个塑料杯中,每个塑料杯底部打1 个直径为2 mm 的小孔,填入灭菌河沙(用0.1mol/L HCl 和0.1mol/L NaOH 配置浇灌用水,将河沙pH 值调至4.5),将苗木固定,每2 个塑料桶培养1 株幼苗。每天每个塑料杯浇灌1 次15 mL蒸馏水,每周浇灌1次15 mL含有磷和铝的Hoagland营养液。Hoagland 营养液具体配方和浓度为KNO3(1 mmol/L)、Ca(NO3)2(1 mmol/L)、MgSO4(0.5 mmol/L)、H3BO3(10 μmol/L)、MnCl2(2 μmol/L)、ZnSO4(2 μmol/L)、CuSO4(0.5 μmol/L)、(NH4)6Mo7O24(0.065 μmol/L)和Fe-EDTA(20 μmol/L)。
2018年4—7月,待分根根系稳固后,进行第2次移栽。2018年7月21日开始,选取长势相同的幼苗,设置4个处理,每处理8个重复,每重复1株幼苗。将幼苗从塑料杯中移入塑料桶,每个塑料桶作为1个分根室,并保持原有的分根方式,填入灭菌河沙。移栽完成后,每2天对每个分根室施浇1次700 mL蒸馏水,隔天浇灌1 次45 mL Hoagland 营养液。8月7日—8月22日,用0.1 mol/L 的HCl 和0.1mol/L 的NaOH 溶液将土壤环境调节至4.5。8月23日开始进行胁迫处理,每6 天为1 个处理循环,第1 天施浇pH 4.5的HCl溶液,第2天进行不同磷铝处理(表1),第3天施浇pH 4.5的HCl溶液,第4天施浇Hoagland营养液,第5天施浇pH 4.5的HCl溶液,第6天空白(不做任何处理)。不同磷铝处理中,设置2个磷浓度,分别为0.1和0.02 g/L P3+,0.12 g/L Al3+为铝胁迫浓度;处理C 中,分根室1 和分根室2 的总磷添加量为0.1 g/L P3+。试验浓度的设置综合考虑了课题组之前的研究及其他植物相关研究中设置的试验浓度[14-15]。
1.4 指标测定
1.4.1 生物量的测定
2018年12月20日,将洗净的根、茎和叶放入烘箱内,在105 ℃条件下杀青30 min,之后将温度调至80 ℃烘干称量,3 次称量结果恒定后分别记录叶干重、茎干重、分根室1 根干重和分根室2 根干重,总生物量为所有干重之和。
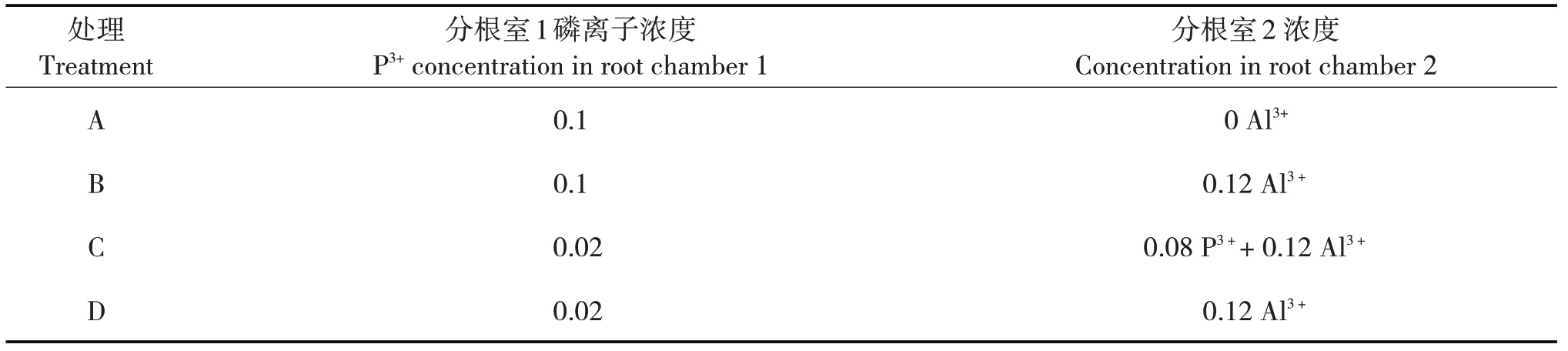
表1 试验处理Tab.1 Experimental treatments(g/L)
1.4.2 铝含量的测定
2018年12月25日,将烘干保存的植株整体用粉碎机磨粉后,用孔径为0.25 mm 的筛子过滤,称取0.1 g 样品,采用H2SO4-H2O2消煮法消煮和铬天青显色法测定[16]。
1.4.3 铝浓度的计算
铝浓度(μg/g)=铝含量(μg)/生物量(g)。
1.5 数据处理
采用Word 和Excel 进行记录与统计;采用Sigma Plot 12.5、SPSS 20.0 和DPS 9.50 进行制图 与分析;采用ANOVA检验进行方差分析;采用Duncan新复极差法进行多重比较。
2 结果与分析
2.1 不同处理对铝胁迫下尾巨桉DH32-29 幼苗生物量的影响
尾巨桉DH32-29 幼苗的叶干重表现为A>B>C>D,组间差异不显著,处理B 和C 的叶干重几乎一样,处理A 比D 高13.47%;茎干重表现为A>B>C>D,处理A 和B 的茎干重显著高于处理C 和D(P<0.05),处理A 与D 的差异最大(36.43%)(图1)。
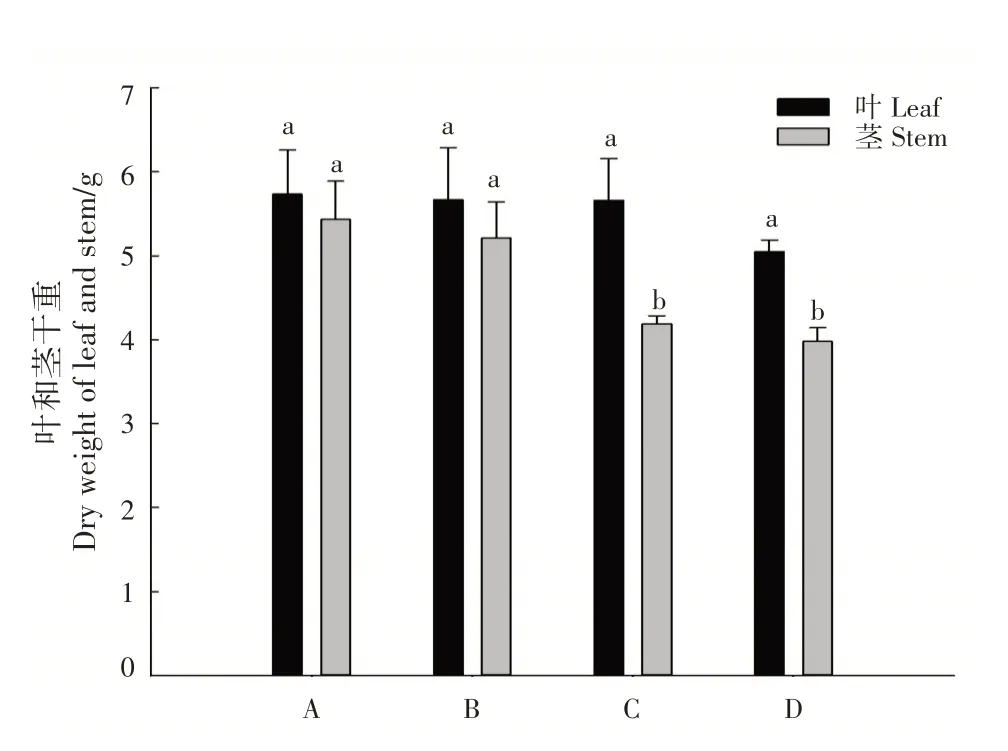
图1 不同处理叶和茎的生物量Fig.1 Biomass of leaves and stems in different treatments
不同处理的分根室中根干重存在差异。分根室1 的根干重表现为A>B>D>C,组间差异不显著;分根室2 的根干重表现为C>A>B>D,处理C显著高于其他处理(P<0.05),处理A、B和D 之间差异不显著;处理C 分根室1 和2 的根干重差异不显著,其他3 组均表现为分根室2 的根干重显著小于分根室1(P<0.05)(图2)。
幼苗总生物量表现为A>B>C>D,组间差异不显著(图3)。

图2 不同处理根系的生物量Fig.2 Biomass of root system in different treatments
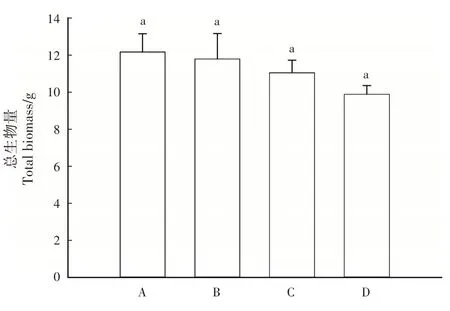
图3 不同处理的总生物量Fig.3 Total biomass in different treatments
2.2 不同处理对铝胁迫下尾巨桉DH32-29 幼苗铝含量和浓度的影响
尾巨桉DH32-29 幼苗叶片中的铝含量表现为B>C>D>A,处理B 和C 的铝含量显著高于处理A(P<0.05);茎的铝含量表现为A>D>B>C,处理A 和D 的铝含量显著高于处理C(P<0.05)(图4)。分根室1 中,根系的铝含量表现为D>B>A>C,处理间差异不显著;分根室2 中,根系的铝含量表现为C>B>D>A,处理C 显著高于其他处理(P<0.05)。

图4 不同处理的铝含量Fig.4 Aluminium contents in different treatments
叶片中的铝浓度表现为B>C>D>A,处理B、C 和D 的铝浓度与未添加外源铝的处理A 差异显著(P<0.05);茎的铝浓度表现为D>A>C>B,处理D 与其他处理差异显著(P<0.05)(图5)。分根室1中,根系的铝浓度表现为D>B>C>A,处理D 显著高于其他处理(P<0.05);分根室2 中,根系的铝浓度表现为B>D>C>A,处理A 显著低于其他处理(P<0.05)。
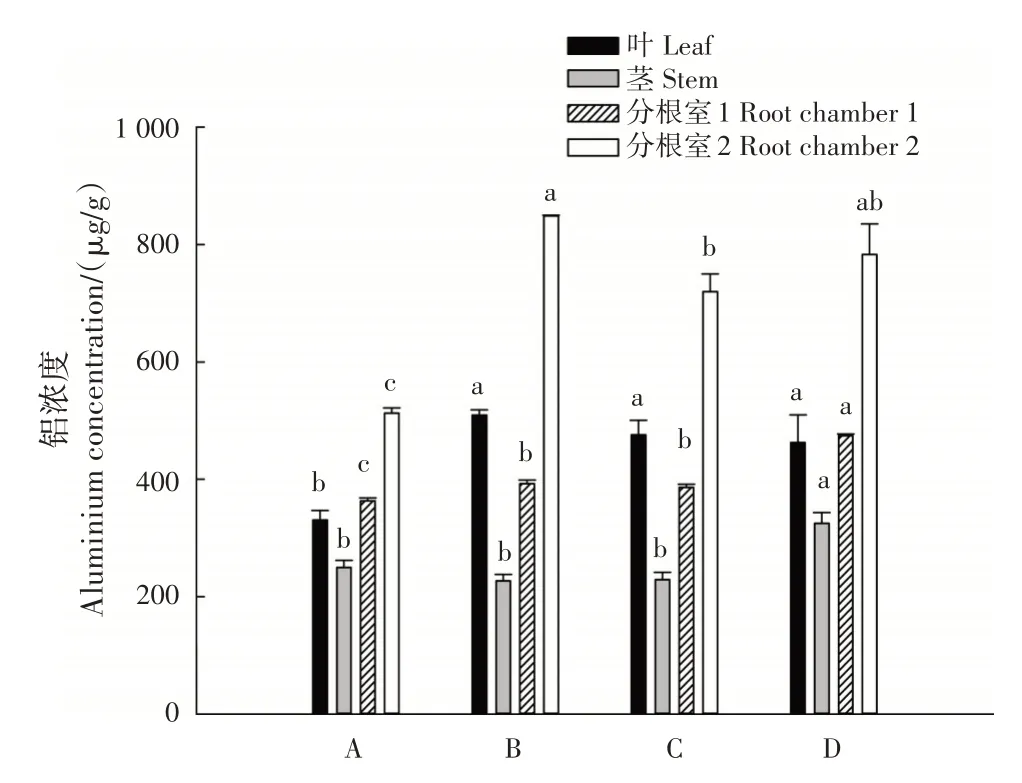
图5 不同处理的铝浓度Fig.5 Aluminium concentrations in different treatments
将茎和叶部分归为地上部分,根部分归为地下部分,进行比较。4 个处理的地上部分铝浓度均低于地下部分铝浓度;地上部分铝浓度表现为D>B>C>A;地下部分铝浓度表现为D>C>B>A(图6)。处理A的地上和地下部分铝浓度均显著低于其他处理(P<0.05)。同一处理的地下部分铝浓度均显著高于地上部分(P<0.05)。
植株整体的铝浓度与地下部分铝浓度有相同的表现。植株整体铝浓度表现为D>C>B>A,处理A显著低于其他处理(P<0.05)(图7)。

图6 不同处理植株地上和地下部分铝浓度Fig.6 Aluminium concentrations in aboveground and underground parts of plants in different treatments
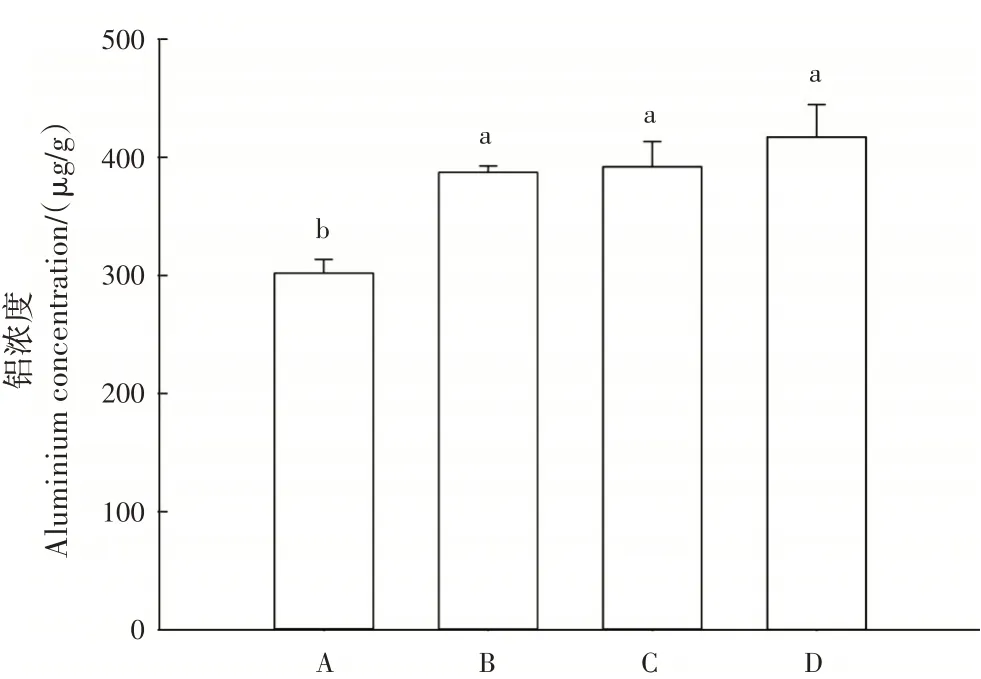
图7 不同处理植株整体铝浓度Fig.7 Aluminium concentration of whole plants in different treatments
3 结论与讨论
磷在某些植物上表现出对铝胁迫的缓解,本试验结果表明磷能对尾巨桉DH32-29 幼苗的铝胁迫起到缓解作用。分根试验表明,磷对于植株铝胁迫的缓解机制主要表现为两方面,一方面磷是植物所需的大量元素,作为一种有效的肥料,磷的添加有利于植物的生长,缓解其缺磷状态;另一方面在酸性环境下,铝容易与土壤中的PO3-4螯合,形成AlPO4沉降,降低游离Al3+的浓度,从而缓解铝胁迫对植株的伤害[17]。相比0.02 g/L 磷添加的处理,0.1 g/L磷添加的植株生物量较高,铝浓度较低,说明0.1 g/L 磷添加的植株有更强的耐铝性。
在生物量方面,从根、茎、叶和总体情况的表现来看,铝胁迫抑制了根系对营养元素的吸收利用,影响桉树幼苗的生长;处理B 和C 的总生物量高于处理D,说明磷的添加在一定程度上缓解了铝胁迫;处理B 和C 施加相同含量的磷和铝,但分根室2 的根生物量间差异显著,可能是因为根系对磷元素的吸收利用不同。
比较处理B、C 和D,添加了0.1 g/L 磷的处理在植株整体的铝浓度上低于添加了0.02 g/L 磷的处理,表明添加磷能缓解尾巨桉DH32-29 幼苗的铝胁迫。处理A 和B 分根室1 根系的铝浓度相近,而添加了铝的处理B 分根室2 根系的铝浓度显著大于处理A,说明铝不会在根系间跨位转移。
比较所有4 组处理的数据得知,0.1 g/L 磷添加的处理可以一定程度降低尾巨桉DH32-29 幼苗茎和根的铝浓度,从而降低铝对植株造成的损害,其效果优于少量磷添加的处理。
