超声辅助ZnCl2-水滑石催化合成嘧啶衍生物
2020-08-07郑兴莉尹晓刚
郑兴莉,杜 莹,王 军,龚 维,陈 卓,尹晓刚
(贵州师范大学 化学与材料科学学院,贵州省功能材料化学重点实验室,贵州 贵阳 550025)
0 引言
含氮杂环化合物因其具有良好的生物活性,所以使其在医药和农药方面得到广泛应用[1-3]。吡啶衍生物具有高效低毒的性质,是其中比较重要的一类含N杂环化合物,吡啶衍生物具有抑制癌细胞生长的药理学作用[4-5],还可以起到保护神经细胞的作用并用于治疗帕金森病[6-8]。吡啶衍生物还具有杀菌、抗过敏、除草等多种活性,其合成方法受到广泛关注[9-10]。自1893年Biginelli[11]反应问世以来,Biginelli反应合成吡啶衍生物的研究就层出不穷,如葛恬[12]等用路易斯酸催化芳醛、脲(硫脲)和环戊酮的“一锅化”Biginelli-type缩合反应,合成一系列的芳亚甲基稠环嘧啶酮化合物,此反应中,催化剂用量少,反应条件温和,产率可达55%~91%。吴小云[13]等采用超声辅助,在低共熔溶剂中用氯化锌催化Biginelli反应合成了9个3,4-二氢嘧啶-2(1H)-酮衍生物,产率最高可达86%。尹晓刚等[14]使用超声辅助蒙脱土负载碘催化Biginelli反应进行研究,研究结果表明:反应温度80 ℃,超声5 min,产率最高可达86.9%。刘晓玲等[15]使用氟化钙为催化剂催化Biginelli反应。然而现有的催化体系仍然存在反应温度高,反应时间长,催化剂用量大的缺点,亟需改进。
负载型催化剂应用于Biginelli反应越来越受关注,此类催化剂有催化效果好,可以重复使用,绿色环保等优点[16]。魏振中等[17]改性高岭土负载Fe(III)后,催化芳香醛、β-二羰基化合物及脲三组分反应,结果表明:产率高、催化剂可回收、循环使用5次仍然具有良好反应活性。水滑石负载型催化剂催化效果优良,如李博等[18]用CuMn/HT催化剂硫醇氧化反应的催化作用来源于催化剂CuMn/HT而非溶液中存在的金属,且该催化剂至少可重复使用5次,二硫化物的收率不低于94%。
以水滑石(LDH)负载路易斯酸为催化剂催化芳香醛、尿素、乙酰乙酸乙酯“一锅化”合成四氢吡啶衍生物,单因素法考察溶剂、催化剂及催化剂用量对产率的影响,通过正交试验优化温度、超声时间及原料摩尔比。通过红外、核磁和熔点对产物结构进行表征。
1 实验部分
1.1 实验试剂及仪器
实验试剂:苯甲醛、对甲氧基苯甲醛、邻甲氧基苯甲醛、对硝基苯甲醛、间硝基苯甲醛,国药集团化学试剂有限公司;对氯苯甲醛、邻氯苯甲醛,阿拉丁试剂;乙酰乙酸乙酯、乙醇、乙酸乙酯(EA)、石油醚(PE,60~90 ℃),成都市科龙化工试剂厂;尿素,天津市致远化学试剂有限公司;所有试剂均为分析纯;柱层析硅胶(0.054~0.077 mm),青岛海洋化工厂分厂;实验所用水为蒸馏水。
实验仪器:AR1140型电子分析天平,美国OHAUS公司;ZF-I型三用紫外分析仪,上海顾村电光仪器厂;RE-52型旋转蒸发仪,上海亚荣生化仪器厂;X-6型显微熔点测定仪,北京泰克仪器有限公司;AVANCEIII型400 MHz核磁共振仪,德国BrukerBiospin公司,氢谱测定以四甲基硅(TMS)为内标,氘代二甲基亚砜为溶剂;IS5型傅立叶变换红外光谱仪,美国赛默飞公司,KBr压片。
1.2 催化剂的制备
参照文献[19]制备,称取0.02 mol的氯化锌,溶于无水MeOH,搅拌使其完全溶解,溶解后加入5 g的LDH,25 ℃下搅拌吸附1 h。旋转蒸发仪除去MeOH后,在120 ℃下活化4 h,制得催化剂ZnCl2-LDH,同样的方法制备得AlCl3-LDH、FeCl3-LDH、NiCl2-LDH、CuCl2-LDH催化剂,放入干燥箱备用。
1.3 实验方法
在放了搅拌子的反应瓶里加入1.2 mmol苯甲醛(1a)、1 mmol尿素(2a)、1 mmol乙酰乙酸乙酯(3a)、0.02 mmol水滑石负载氯化物,室温下,超声反应15 min,离心过滤,旋干得到粗产品,抽滤的固体粗产物,柱层析(V(PE)∶V(EA)=6∶1),得淡黄色固体产品237.4 mg。
1.4 产物的表征
实验中所得化合物4a~4i为已知化合物,通过IR、1H-NMR、熔点进行表征,所得谱图与标准谱图一致。
5-乙氧羰基-6-甲基-4-苯基-3,4-二氢嘧啶-2(1H)-酮(4a):白色固体,IR(KBr):vN-H3 245 cm-1(m)、3 117 cm-1(w);vC=O1 725 cm-1(s)、1 700 cm-1(s);vHN-CO-NH1 648 cm-1(s);vC-O-C1 222 cm-1(s)、1 091 cm-1(s);698 cm-1(m)、757 cm-1(m)。1H-NMR(400 MHz,DMSO-d6):δ1.08 (t,J=7.1 Hz,3H),2.24(s,3H),3.99(q,J=7.7 Hz,2H),5.12(d,J=3.3 Hz,1H),7.21~7.34(m,5H,ArH),7.73(s,1H,NH),9.20 (s,1H,NH)。m.p.:202~204 ℃(lit[20]204~205 ℃)
5-乙氧羰基-6-甲基-4-(3-硝基苯基)-3,4-二氢嘧啶-2(1H)-酮(4b):白色固体,IR(KBr):vN-H3 230 cm-1(w)、3 115 cm-1(w);vC-H2 977 cm-1(w);vC=O1 695 cm-1(s);vHN-CO-NH1 640 cm-1(s);vC-O-C1 228 cm-1(s)、1 096 cm-1(s);745 cm-1(m)。1H-NMR (400 MHz,DMSO-d6):δ0.99 (t,J=7.0 Hz,3H),2.29(s,3H),3.87(q,J=7.1 Hz,2H),5.62(d,J=3.5 Hz,1H),7.28~7.42(m,4H,ArH),7.73(s,1H,NH),9.29(s,1H,NH)。m.p.:222~223 ℃(lit[20]223~225 ℃)。
图1 Biginelli反应的合成Fig.1 Synthesis of Biginelli reaction
5-乙氧羰基-6-甲基-4-(2-硝基苯基)-3,4-二氢嘧啶-2(1H)-酮(4c):白色固体,IR(KBr):vN-H3 230 cm-1(w)、3 115 cm-1(w);vC-H2 977 cm-1(w);vC=O1 695 cm-1(s);vHN-CO-NH1 640 cm-1(s);vC-O-C1 228 cm-1(s)、1 096 cm-1(s);745 cm-1(m)。1H-NMR (400 MHz,DMSO-d6):δ1.07(t,J=7.1 Hz,3H),2.27(s,3H),3.95(q,J=7.3 Hz,2H),5.25(d,J=3.4 Hz,1H),7.42~7.64(m,4H,ArH),7.88(s,1H,NH),9.29(s,1H,NH)。m.p.:209~210 ℃(lit[21]212~214 ℃)。
5-乙氧羰基-6-甲基-4-(3-氯苯基)-3,4-二氢嘧啶-2(1H)-酮(4d):白色固体,IR(KBr):vN-H3 257 cm-1(w)、3 111 cm-1(w);vC-H2 958 cm-1(w);vC=O1 725 cm-1(s)、1 701 cm-1(s);vHN-CO-NH1 636 cm-1(s);v=C-H1 598 cm-1(w)、1 487 cm-1(m)、1 463 cm-1(m);vC-O-C1 216 cm-1(s)、1 026 cm-1(w);787 cm-1(w)、763 cm-1(m)1H-NMR(400 MHz,DMSO-d6):δ1.08 (t,J=7.1 Hz,3H),2.19(s,3H),3.89(q,J=7.1 Hz,2H),5.16(d,J=3.2 Hz,1H),7.31~7.52(m,4H,ArH),7.13(s,1H,NH),9.21(s,1H,NH)。m.p.:259~261 ℃(lit[20]260~262 ℃)。
5-乙氧羰基-6-甲基-4-(2-氯苯基)-3,4-二氢嘧啶-2(1H)-酮(4e):白色固体,IR(KBr):vN-H3 245 cm-1(w)、3 123 cm-1(w);vC-H2 980 cm-1(w);vC=O1 724 cm-1(s);vHN-CO-NH1 648 cm-1(s);vC-O-C1 222 cm-1(s)、1 089 cm-1(s);782 cm-1(m)。1H-NMR(400 MHz,DMSO-d6):δ1.09(t,J=7.1 Hz,3H),2.23(s,3H),3.95(q,J=7.1 Hz,2H),5.16(d,J=3.2 Hz,1H),7.21(d,J=1.3 Hz,2H,Ar),7.74(s,1H,Ar),7.74(s,1H,NH),9.20(s,1H,NH)。m.p.:214~216 ℃(lit[20]212~214 ℃)。
5-乙氧羰基-6-甲基-4-(2-氟苯基)-3,4-二氢嘧啶-2(1H)-酮(4f):白色固体,IR(KBr):vN-H3 230 cm-1(w)、3 115 cm-1(w);vC-H2 977 cm-1(w);vC=O1 695 cm-1(s);vHN-CO-NH1 640 cm-1(s);vC-O-C1 228 cm-1(s)、1 096 cm-1(s);745 cm-1(m)。1H-NMR (400 MHz,DMSO-d6):δ:9.27(d,J=2.0 Hz;1H),7.92~7.69(m,1H),7.66~7.41(m,2H),7.29~7.05(m,4HAr),5.13(d,J=3.3 Hz;1H),3.98(q,J=7.1 Hz;2H),2.25(s,3H),1.10(t,J=7.2 Hz,3H)。m.p.:225~226 ℃(lit[21]224~226 ℃)
5-乙氧羰基-6-甲基-4-(3-溴苯基)-3,4-二氢嘧啶-2(1H)-酮(4g):白色固体,IR(KBr):vN-H3 230 cm-1(w)、3 115 cm-1(w);vC-H2 977 cm-1(w);vC=O1 695 cm-1(s);vHN-CO-NH1 640 cm-1(s);vC-O-C1 228 cm-1(s)、1 096 cm-1(s);745 cm-1(m)。1H-NMR (400 MHz,DMSO-d6):δ:9.25(s,1H),7.77(d,J=1.4Hz,1H),7.37~7.08(m,4H),5.15(d,J=3.3Hz,1H,),4.09~3.86(m,2H),2.25(s,3H),1.09(t,J=7.1 Hz,3H)。m.p.:183.8~184.2 ℃(lit[21]183~185 ℃)
5-乙氧羰基-6-甲基-4-(2-甲氧基苯基)-3,4-二氢嘧啶-2(1H)-酮(4h):白色固体,IR(KBr):vN-H3 245 cm-1(w)、3 114 cm-1(w);vC-H2 956 cm-1(w);vC=O1 724 cm-1(s)、1 705 cm-1(s);vHN-CO-NH1 651 cm-1(s);v=C-H1 612 cm-1(w)、1 513 cm-1(m)、1 458 cm-1(m);vC-O-C1 223 cm-1(s)、1 089 cm-1(s)、1 032 cm-1(m);791 cm-1(m)。1H-NMR (400 MHz,DMSO-d6):δ1.10(t,J=7.2 Hz,3H),2.18(s,3H),3.89(q,J=7.1 Hz,2H),5.05(d,J=3.4 Hz,1H),6.89~7.13(m,4H,ArH),7.13(s,1H,NH),9.11(s,1H,NH)。m.p.:204~206 ℃(lit[20]201~202 ℃)。
5-乙氧羰基-6-甲基-4-(3-甲氧基苯基)-3,4-二氢嘧啶-2(1H)-酮(4i):白色固体,IR(KBr):vN-H3 250 cm-1(w)、3 121 cm-1(w);vC-H2 962 cm-1(w);vC=O1 730 cm-1(s)、1 710 cm-1(s);vHN-CO-NH1 653 cm-1(s);v=C-H1 622 cm-1(w)、1 561 cm-1(m)、1 459 cm-1(m);vC-O-C1 225 cm-1(s)、1 085 cm-1(s)、1 040 cm-1(m);781 cm-1(m)。1H-NMR (400 MHz,DMSO-d6):δ1.12(t,J=7.1 Hz,3H),2.17(s,3H),3.91(q,J=7.1 Hz,2H),5.12(d,J=3.2 Hz,1H),6.92~7.10(m,4H,ArH),7.13(s,1H,NH),9.11(s,1H,NH)。m.p.:200~201 ℃(lit[20]199~200 ℃)。
2 结果与讨论
2.1 反应条件的筛选与优化
2.1.1 催化剂种类对产率的影响
表1是催化剂种类对反应产率的影响,当单独使用ZnCl2作催化剂时,反应产率为60.3%,而未负载LDH作催化剂时反应产率为64.1%。LDH负载氯化物的催化剂总体来说都比单独催化效果要好,其中ZnCl2-LDH作催化剂产率最高,其产率为91.2%;AlCl3-LDH和NiCl2-LDH产率较好,产率分别为86.6%、85.0%;CuCl2-LDH作催化剂时的产率为73.9%,FeCl3-LDH作催化剂时的产率为66.2%,由反应结果可以判断LDH负载氯化物的催化剂具有协同催化的效果。
表1 催化剂对产率的影响Tab.1 Effect of catalyst on yield
在室温下n(苯甲醛)∶n(尿素)∶n(乙酰乙酸乙酯)=1.2∶1∶1,催化剂用量是尿素用量(质量)的20%,在2 mL乙醇溶液中室温、超声下反应15 min。
2.1.2 溶剂对产率的影响
表2为溶剂对产率的影响,从表中可以看出醇类溶液做溶剂时,反应效果较好,甲醇、乙醇、正丁醇做溶剂,产率分别为86.2%、91.2%、79.9%;二氯甲烷、三氯甲烷做溶剂时产率都为74.7%,1,2-二氯乙烷做溶剂时,产率为42.4%,乙酸乙酯做溶剂时产率为67.8%,乙腈做溶剂时,产率为56.4%,水做溶剂时,产率为46.5%。推测原因,反应与溶剂的极性有关,在强极性溶剂中,反应效果不好,例如:水和乙腈;在中强极性溶剂中的反应效果较佳,例如:甲醇、乙醇、正丁醇;在相对较弱的极性溶剂中的反应效果较差,如四氢呋喃,产率只有55.3%。
表2 溶剂对产率的影响Tab.2 Effect of solvent on yield
2.1.3 反应时间和温度对产率的影响
表3为反应时间和温度对产率的影响,由表3可知控制反应温度不变,改变反应时间,随着反应时间的增加,当反应时间为15 min时,产率最好,继续增加反应时间,产率下降,当反应时间为25 min、35 min、60 min时,产率分别为65.9%、66.4%、68.1%。推测原因为延长反应时间,反应中有副反应产生,从而降低反应产率。对比表中的2、6、7、8、9可以看出随着反应温度的增加,反应产率也在增加,反应温度为0 ℃、25 ℃、45 ℃、60 ℃、75 ℃对应的产率分别为68.3%、91.2%、89.5%、82.9%、86.1%。最佳的反应时间和温度为15 min和25 ℃。
表3 反应时间和温度对产率的影响Tab.3 Effect of reaction time and temperature on yield
2.1.4 催化剂用量和原料摩尔比对产率的影响
表4为催化剂用量和原料摩尔比对产率的影响,对比序号1~4可知,随着催化剂用量的增加,催化效果有所提高。催化剂用量为5%、10%、20%、30%时对应的产率分别为59.4%、80.4%、91.2%、49.9%。催化剂用量为20%时产率最好,但是催化剂用量为30%时,催化效果下降,推测原因是,催化剂含量增多阻碍了反应物之间的接触,所以产量下降。对比序号3、5、6、7可知,随着醛的用量增加,反应产率不断增大,n(苯甲醛)∶n(尿素)∶n(乙酰乙酸乙酯)=1.2∶1∶1时的产率最好。该催化剂可循环使用,催化剂循环使用3次后,产率为87.1%。

表4 催化剂用量、原料摩尔比及催化剂循环使用对产率的影响Tab.4 Influence of catalyst dosage、raw material molar ratio and catalyst recycling on yield
2.2 底物扩展
表5为不同芳香醛适应性的考察,在最优条件下考察苯环上不同取代基对产率的影响,结果表明:对硝基苯甲醛的产率为77.0%(4b);邻硝基苯甲醛的产率为82.7%(4c);对氯苯甲醛的反应产率为79.4%(4d);邻氯苯甲醛参与反应的产率较好,为86.3%(4e);邻氟苯甲醛的产率为63.8(4f);间溴取代的苯甲醛的产率为85.3%(4g);邻甲氧基苯甲醛的产率为74.8%(4h),对甲氧基苯甲醛的产率为70.8%(4i);对于该反应空间位阻影响不大,总体底物适应性良好。邻氟取代时,产率最低,推测原因氟的电负性强,处在邻位,存在较大的空间位阻,产率较低。总的来说,吸电子作为取代基时,产率较高。

图2 底物适应Fig.2 Substrate adaptation
表5 芳环上不同取代基对产率的影响Tab.5 Effect of different substituents on aromatic ring on yield
2.3 反应机理推测
如图3所示,ZnCl2-LDH催化剂中可能存在酸中心和碱中心,尿素和乙酰乙酸乙酯进行亲核加成形成中间亚氨基酯,其中来自尿素的质子可能被ZnCl2-LDH碱阴离子夺取,乙酰乙酸乙酯的羰基也被ZnCl2-LDH酸性活化,然后脱水形成中间体A,在ZnCl2-LDH存在下,形成中间体B,再次活化芳香醛的羰基,形成中间体C,最后ZnCl2-LDH酸碱协同作用,得到目标产物D。
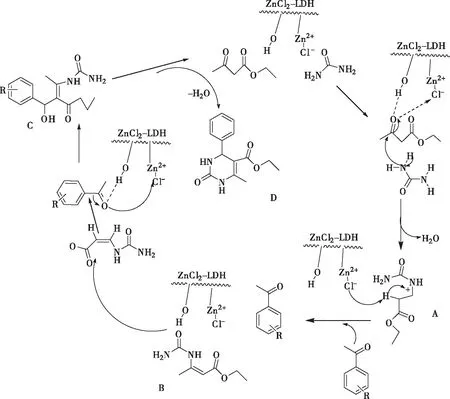
图3 反应机理Fig.3 Reaction mechanism
3 结论
以芳香醛、乙酰乙酸乙酯、尿素为原料,以ZnCl2-LDH为催化剂,反应生成6-甲基-2-氧代-4-苯基-1,2,3,4-四氢嘧啶-5-羧酸乙酯衍生物的反应最优条件为:ZnCl2-LDH为催化剂,乙醇做溶剂,反应温度为25 ℃,反应时间为15 min,n(芳香醛)∶n(尿素)∶n(乙酰乙酸乙酯)=1.2∶1∶1,产率达到91.2%。反应中底物的适应性良好。ZnCl2-LDH为催化剂催化效果好,催化剂可以重复使用3次。
