先天性肺囊性腺瘤样畸形胎儿的妊娠结局▲
2020-08-06邬晋芳师蕊婷
赵 刚 邬晋芳 师蕊婷 孙 露 花 蕾
(西安交通大学第二附属医院1 妇产科,2 超声研究室,陕西省西安市 710002,电子邮箱:464018789@qq.com)
胎儿先天性肺囊性腺瘤样畸形(congenital cystic adenomatoid malformations of the lung,CCAM-L)是由细支气管过度增生导致的肺多囊泡样改变的一种先天性疾病,在我国的发病率约为2.03/10 000~6.00/10 000[1],近年来其发病率有升高趋势[2]。随着超声技术的发展和普及,越来越多的CCAM-L在产前检查中被诊断,由于对该疾病的认识不足及过分追求优生优育,不少经超声诊断为CCAM-L的孕妇选择引产,这极易损伤子宫内膜导致继发性不孕[3]。本研究分析CCAM-L胎儿的妊娠结局,以期为该病的临床诊断、治疗及预后提供参考。
1 资料与方法
1.1 临床资料 回顾性分析2016年4月至2019年3月在我院产检时经超声诊断为CCAM-L并在我院分娩的24例孕妇的临床资料,年龄(27.6±3.6)岁,诊断CCAM-L时孕周为(24.7±3.3)周,终止妊娠(包括顺产及剖宫产)时孕周为(39.2±1.4)周。所有CCAM-L患者均为单胎妊娠活产,未合并其他系统畸形。纳入标准:(1)在我院超声诊断为CCAM-L;(2)在我院分娩;(3)单胎、自然妊娠,胎儿不合并其他系统畸形;(4)对本研究知情同意。排除标准:(1)孕妇合并其他系统严重疾病;(2)无法完成随访者。
1.2 方法
1.2.1 超声诊断:所有孕妇采用GE Voluson E8型彩色多普勒超声诊断仪(美国通用电气公司)进行检查,探头频率为3.5~10 MHz。孕妇取仰卧位,对其腹部进行扫描,扫描频率3.5~4.5 MHz,首先对胎头、脊柱、胸部、四肢及胎儿附属物等结构进行系统的筛查,如发现胎儿肺内出现异常回声时,注意观察肺部病灶大小、形态、血供来源、内部回声等,注意心脏、纵隔是否受压移位,患者肺组织有无压缩,明确有无水肿、积液情况,并排除膈疝、隔离肺等其他肺部病变[4]。根据病灶的声像图特点和病理特点CCAM-L可分为3型[5]:Ⅰ型(大囊型),囊腔直径≥20 mm,肺部病变表现为混合性回声内见多个大的无回声区;Ⅱ型(小囊型),囊腔直径<20 mm,肺部病变表现为较多个小的无回声区;Ⅲ型(实性或微囊型),超声无法测量囊腔大小,肺部病变表现为边界清晰的均质增强回声包块。如符合CCAM-L诊断标准且不合并其他系统畸形,3周后复查B超,至少有两次诊断结果符合诊断标准即可诊断CCAM-L。
1.2.2 计算囊腺瘤容积比值:诊断CCAM-L后计算囊腺瘤容积比值(cystic volume ratio,CVR),CVR=团块长度(cm)×宽度(cm)×高度(cm)×0.523/胎儿头围(cm)。所涉及数据来源于B超测量。CVR对预测CCAM-L预后有重要价值,CVR越大,CCAM-L出现不良妊娠结局的可能性越大,根据文献[6-7]将CCAM-L孕妇分为CVR<1.6组14例及CVR≥1.6组10例。
1.3 观察指标 收集孕妇首次诊断孕周、CVR值、分娩孕周、分娩方式、影像学检查资料,以及新生儿出生后情况、并发症、是否手术及出院后随访情况等资料。新生儿并发症包括胎儿水肿、积液和周围组织受压,胎儿水肿指超声下胎儿广泛性皮肤、皮下组织水肿;积液包括胸腹腔积液(在胎儿心脏四腔观、腹腔内探及游离液性无回声区)、心包积液(胎儿心包腔内探及液性无回声区)、羊水过多(羊水指数≥25 cm,羊水最大暗区垂直深度≥8 cm);周围组织受压指超声下探及胎儿肺脏、心脏、纵隔受肺囊腺瘤压迫偏离正常解剖位置。预后不良指新生儿死亡或经治疗后呼吸困难、呼吸衰竭等症状无法缓解;预后良好指CCAM-L自愈或出生后无症状或经治疗后呼吸困难、呼吸衰竭等症状明显缓解。
1.4 统计学分析 采用SPSS 17.0软件进行统计分析。计量资料以(x±s)表示,比较采用t检验,计数资料以例数或百分比表示,比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结 果
2.1 CCAM-L孕妇妊娠结局 24例CCAM-L孕妇除1例早产外,其余均妊娠至足月。所有新生儿均活产,其中剖宫产6例,2例预后不良;顺产18例,1例预后不良。共7例新生儿存在并发症,其中合并羊水过多1例,胸腔积液1例,纵隔受压2例,患侧肺组织结构消失合并纵隔受压及心脏移位1例,胸腔积液合并心脏移位2例。11例新生儿出生后一般情况良好,无需手术治疗,其中5例在产前或产后3 d检查发现肺囊腺瘤消失,即自愈;13例新生儿出生后出现呼吸困难、呼吸衰竭,1例因病情危重家属放弃治疗(患侧肺组织结构消失合并纵隔受压及心脏移位),其余12例行胸腔镜下部分肺叶切除术治疗,其中10例预后良好,2例预后不良。
2.2 CVR<1.6组及CVR≥1.6组观察指标比较 两组孕妇年龄、确诊CCAM-L时孕周、分娩时孕周、分娩方式,以及新生儿自愈率、手术率、预后良好率比较,差异均无统计学意义(均P>0.05),而CVR≥1.6组新生儿并发症发生率高于CVR<1.6组(P<0.05)。见表1。
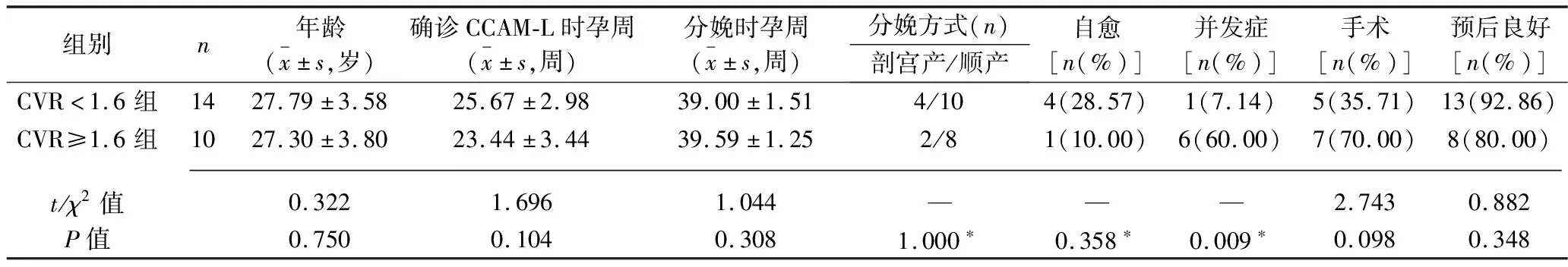
表1 CVR<1.6组及CVR≥1.6组观察指标比较
3 讨 论
近年来,随着超声技术的提高,胎儿先天性肺部畸形的检出率日益增高。CCAM-L是先天性肺部畸形中常见的一种类型,发病率占胎儿先天肺部畸形的25%,占胎儿肺部肿块的76%~80%[4]。CCAM-L的主要特征是缺乏正常肺泡,支气管末梢增殖异常,如过度性增长或腺瘤样增长,最终导致肺泡发育不良。该病多见于一叶或者一侧肺,染色体异常相对少见。CCAM-L的发病机制目前尚未完全明确,可能与胚胎发育过程中终末细支气管的异常增殖有关[2]。异常增殖的细支气管使胎儿的支气管结构发生紊乱,阻碍肺泡正常发育,使得病变部位肺泡无法与其他支气管之间的相通,影响胎儿肺部正常功能[7]。
目前超声检查可作为CCAM-L诊断和随访的首选检查方式[8],对于超声诊断困难或疑诊的患者可行MRI辅助诊断。既往多认为实质性病变预后差,确诊CCAM-L的孕妇多建议其引产[1],而随着围产技术及新生儿外科的发展与进步,近年来CCAM-L孕妇及新生儿的预后有了明显改善。研究发现,CCAM-L患儿预后与胎儿是否合并水肿(腹水、胸水、羊水过多等)、周围脏器压迫(纵隔移位,心脏、肺脏受压)等症状有关[8],存在上述症状提示患儿预后不良,而无上述症状的患儿预后相对良好[9]。本研究3例预后不良患儿中,1例为肺组织结构消失合并纵隔受压及心脏移位,另外2例为胸腔积液合并心脏移位,而11例无症状的患者均预后良好。CVR是目前最常用于评估CCAM-L预后的指标,CVR增大时,进展为水肿胎儿或脏器受压的比例明显增加,预后差[9]。本研究结果显示,CVR≥1.6组新生儿并发症发生率高于CVR<1.6组(P<0.05),说明CVR越大,新生儿并发症发生率越高。由于肺部大肿块可使胎儿纵隔及心脏受压移位、肺压缩,同时出现胸腹腔积液,提示预后不良可能,必要时应考虑引产。本研究3例预后不良患儿均合并以上不良因素,其中1例CVR仅为1.78,考虑其可能因肺组织结构消失合并纵隔受压及心脏移位导致预后不良,说明预测CCAM-L预后应综合考虑CVR大小及其他临床表现。
CCAM-L的治疗包括宫内治疗和出生后手术治疗,宫内治疗包括胎儿肺囊性病变供血动脉激光消融[10]、积液穿刺或羊膜腔分流术[11],对于孕期病变严重的病例尽早施行宫内治疗可改善新生儿预后,但因该方法技术难度高,且易并发宫内感染,目前国内开展较少。部分CCAM-L可在分娩前后消失,对于没有临床症状的CCAM-L活产患儿,产后应行影像学检查确认畸形是否存在或随访其变化[12],此时胸部CT检查的效果优于超声检查。对于无症状的CCAM-L可行保守治疗[13-14],但也有研究指出,与保守治疗相比,CCAM-L患儿应首选外科治疗[15-16]。目前,胸腔镜下肺叶切除/部分切除术是治疗CCAM-L患儿的首选手术方式,具有微创、出血少、术后恢复快等优势[17-18]。本研究中12例CCAM-L患儿生后行胸腔镜下肺叶切除/部分切除术,其中10例预后良好,2例患儿因胸腔积液、心脏严重受压后发生Ⅱ型呼吸衰竭,最终导致术后预后不良。
综上所述,大部分未合并其他系统畸形的CCAM-L胎儿预后良好;对于早期即出现水肿、周围脏器压迫症状的CCAM-L胎儿,预后不良的可能性较大,综合评估后应适时终止妊娠。然而目前仍缺乏大样本、多中心及长期随访的研究,对CCAM-L发病机制也尚未完全明确,仍需进一步研究。
