低场核磁共振检测食品中总无机硫
2020-08-06辛家祥杨仲丽王艳玲胡凯瑞黄海龙
王 睿,辛家祥,杨仲丽,王艳玲,胡凯瑞,黄海龙,徐 敏
(华东师范大学 物理与电子科学学院 上海市磁共振重点实验室,上海 200062)
随着经济的快速发展,人民生活水平的不断提升,人们对食品安全也有了更高的要求。由于SO2、亚硫酸盐、亚硫酸氢盐、低亚硫酸盐、焦亚硫酸盐等含硫化合物具有漂白、防腐和抗氧化的作用,所以在食品、药材的生产加工过程中,经常用作漂白剂,抑制或破坏食品与药材中的变色因子,避免食品褐变并延长存放时间。上述物质就是食品中无机硫的人为来源[1],这些物质的过量使用不仅会破坏食品和药材的品质[2],还会严重影响消费者的健康。如SO2及其衍生物具有腐蚀性,刺激支气管和肺等器官,使食用者极易患上呼吸道炎症[3];此外,还会损害人的肝、胃以及肾等器官,甚至会损害人体中的细胞遗传物质[4]。因此必须严格控制食品中无机硫的含量。
当前常规检测SO2的方法有滴定碘量法和比色法。如国家标准的盐酸副玫瑰苯胺法[5],虽然准确,但耗时长,终点难以判定[6],不适用于大批量检测;比色法中试剂要求严格,有颜色时会产生干扰。较为新型的检测SO2和亚硫酸根的方法有荧光法、化学发光法、电化学法[7]和酶法,检测负二价硫化物的方法有乙酸铅试纸法[8]。这些方法虽然灵敏度和准确度相对较高,但存在耗时长、价格相对昂贵以及操作难度大等缺点,操作过程中有些还涉及了四氯化汞这类毒性较大的化学试剂[9]。故对于食品中的含硫化合物的监督和检测,发展一种携带方便、操作简单,适用于现场大批量检测的快速方法迫在眉睫[10]。
低场核磁共振(LF-NMR)分析仪是近年来快速发展的一种分析设备,通常采用较低成本的永磁体构建主磁场,不仅设备成本低,维护、屏蔽和场地成本也大幅降低,使之从专业实验室转向大众应用成为可能。与高场仪器相比,低场仪器体积小、质量轻,甚至可以将其携带至检测地点,开展现场检测。同时,LF-NMR检测技术还具有快速、无损和实时的特点,因此在食品领域中的应用正在不断扩大[11-13]。目前,其在食品检测中的常见方法包括对纵向弛豫时间(T1)、横向弛豫时间(T2)的检测,并可实现波谱采集和成像[14]。
由于弛豫时间对原子核所处环境敏感,因此笔者考虑设计一种检测试剂,通过含硫化合物影响检测试剂的弛豫时间,从而实现利用LF-NMR对含硫化合物进行检测。基于这一思路,同时考虑到检测试剂的稳定和易携带性,笔者设计了一种水凝胶[15]作为检测试剂。参照乔从德[16]和Tang等[17]的研究,选用水溶性良好、无毒的聚乙二醇丙烯酸酯(PEGA)[16]为基,并以2-丙烯酸-2-甲氧基乙酯(MEA)和丙烯酰胺(AM)作为共聚单体,以增强水凝胶的强度和韧性[17],同时加入钡盐作为检测剂,应用溶液聚合法,成功得到多组分高浓度含盐水凝胶。

1 材料与方法
1.1 材料与试剂
MEA(98%)、PEGA(Wm)=480)、重水(D2O,99.9%氘代),美国 Sigma-Aldrich公司;AM(99%),Greagent公司;偶氮二异丁腈(AIBN,98%)、过氧化苯甲酰(BPO,75%)、BaCl2·2H2O(99%),Adamas公司;过硫酸铵(APS,98%),国药集团化学试剂有限公司。其他试剂均为分析纯。以上试剂未经处理直接使用。
1.2 仪器与设备
NMRC12-010V-T型核磁共振仪(磁场强度:(0.3±0.05)T;温控范围:(30±0.1)℃),苏州纽迈分析仪器股份有限公司;Bruker AVANCE III 500型 NMR核磁共振波谱仪(质子共振频率为 500.13 MHz),德国Bruker公司;alpha1-2型冷冻干燥机,德国Chirst公司。
1.3 方法
1.3.1 合成方法
1.3.1.1 PEGA-MEA-AM共聚水凝胶的合成
将3.0 g(6.25 mmol)PEGA溶于10.40 g水中,然后加入1.20 g(9.22 mmol)MEA,搅拌30 min确保单体完全溶解。之后,向溶液中加入1.20 g(16.88 mmol)AM和少量APS引发剂,并在60 ℃下搅拌反应6 h形成凝胶。然后将所得水凝胶静置并冷却至室温。
1.3.1.2 高含盐量PEGA-MEA-AM凝胶的合成
第一步,在0.006 g(0.04 mmol)AIBN中加入1.20 g(9.22 mmol)MEA,在15 ℃避光的条件下搅拌30 min,至白色晶体完全溶解。第二步,将3.0 g(6.25 mmol)PEGA与1.40 g水中搅拌30 min确保单体完全溶解,并加入第一步的溶液中搅拌至溶解。第三步,将2.44 g(10 mmol)二水合氯化钡在7 g水溶解之后加入第二步溶液中。最后,向2.0 g水中加入1.2 g(16.88 mmol)AM,15 ℃避光搅拌15 min至完全溶解后,加入第三步溶液中搅拌至完全溶解。将上述溶液注入模具,在70 ℃下梯度升温反应8 h形成凝胶。然后将所得水凝胶静置并冷却至室温。部分样品置于冻干机中冻干12 h,以得到干燥样品。
1.3.1.3 氘代水凝胶的合成
在原操作条件和操作方法的基础上,将反应中的水改为等量的氘代水(D2O)进行合成,可以得到对应的氘代水凝胶。用于凝胶的NMR表征。
1.3.2 凝胶的表征
分别使用高场和低场核磁共振进行测试。使用NMR核磁共振波谱仪对氘代凝胶样品进行1H NMR测试。使用核磁共振仪横向弛豫时间T2的测试,质子共振频率为21.56 MHz,磁感应强度0.5 T,磁体的温度30 ℃,样品通过加热保持与磁体温度相同。样品管是直径为10 mm的核磁管,核磁管中样品的高度是1.5 cm左右。选择 CPMG序列(图1),采样参数如下:采样频率(SW)=100 kHz、重复扫描次数(NS)=16、回波个数(Echo Count)=15 000、重复采样等待时间(TW)=5 000 ms。所得CPMG指数衰减曲线采用仪器自带的MultiExpInv Analysis软件进行反演得到T2图谱,并对各峰面积进行积分。

图1 测定1H T2的CPMG脉冲序列
1.3.3 食品样品的前处理方法

1.3.4 水凝胶的弛豫时间测量
将加工处理好的冻干水凝胶置于10 mm低场核磁管底部,分别加入0、1、10和100 mg/kg的Na2SO4溶液1.5 mL,15 min后用低场核磁共振仪器,采用CPMG序列进行1H T2测量,采集到指数衰减曲线后进行反演,得到低场的T2弛豫谱。
2 结果与讨论
2.1 PEGA-MEA-AM多组分凝胶及含盐水凝胶的合成
在不存在Ba2+的情况下,凝胶可以按照自由基聚合的机制,在水溶液中以PEGA、MEA和AM作为聚合单体,使用APS作为引发剂。3种单体的1H NMR谱图见图2。单体的相应结构和每个氢原子的出峰位置均标在相应谱图中。由图3可知,在δ5.5~6.5范围内均出现明显的双键峰。
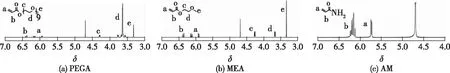
图2 聚合单体PEGA、MEA和AM的1H NMR谱图
虽然三组分凝胶已被成功合成,但是在有较高浓度离子存在的情况下,则不能达到聚合效果,得到的凝胶极不均匀。由该现象推断有两个原因,一个原因是离子的阻聚。因为在较高浓度无机金属离子存在的情况下,离子会对引发剂产生影响,进而阻聚。对此原因的验证,尝试进行降低离子浓度的操作,但较低的离子浓度仍然不能形成凝胶。第二个原因则是反应前期APS中的过硫酸根引发反应,产生硫酸根类似结构的初级自由基(引发历程见图3),其与Ba2+结合而失去了引发的效果。因此,此反应改用偶氮二异丁腈(AIBN)替代APS作为引发剂,并在较低温度下使用较少量的引发剂,小心地避光搅拌,在后期形成凝胶时使用梯度升温,以减少暴聚和气泡的产生。引发剂和单体调整到物质的量比为n(AIBN)∶n(MEA)∶n(PEGA)∶n(AM)=1∶ 230∶ 150∶ 420的最优比例,既可以在聚合前完全溶解成为一个澄清的体系,又可以在合适的速率进行聚合,得到没有气泡的均匀凝胶。
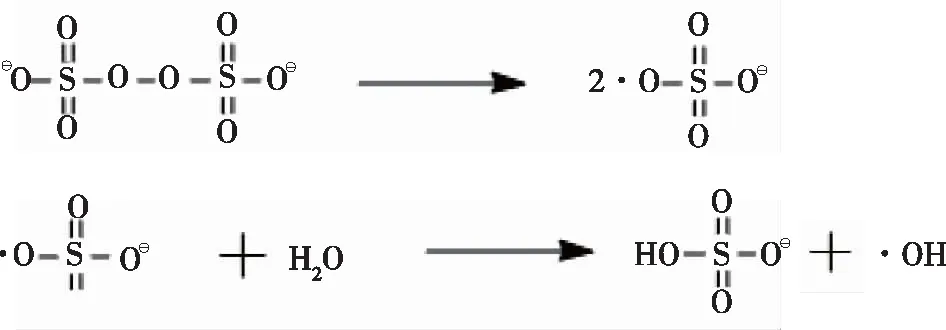
图3 过硫酸铵引发聚合的初级反应历程
按照之前相同的操作将水替换为氘水后,利用NMR进行了凝胶的氢谱表征,1H NMR谱图如图4所示,相应的结构也标在谱图中。与图2进行对照,发现3种对应的单体碳碳双键位置δ5.5~6.5谱峰完全消失,说明双键全部参与聚合,多组分共聚水凝胶已被成功合成。
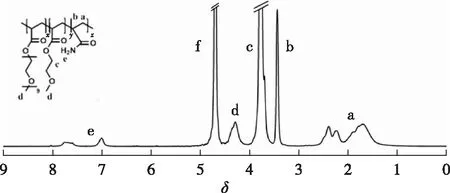
图4 PEGA-MEA-AM水凝胶的1H NMR谱
2.2 PEGA-MEA-AM水凝胶用于快速检测硫酸盐
为了保证硫酸盐浓度的准确性,笔者直接采用Na2SO4水溶液进行测试。将加工处理好的冻干水凝胶用纯水和不同浓度的Na2SO4溶液浸泡,然后用低场核磁共振仪器,采用CPMG序列进行1H T2测量,采集到指数衰减曲线后进行反演,得到低场的T2弛豫谱,如图5所示。
在核磁共振实验中,对样品施加一个射频场,使样品跃迁到激发态,撤去射频场后,原子核会逐渐回到平衡态,这个过程就是弛豫。弛豫分为纵向弛豫和横向弛豫,本文用到的是横向弛豫T2。原子核的弛豫时间除了与物质本身有关以外,还与原子核所处环境有关,因此在水凝胶内成分改变时,可通过测量T2时间来反映物质的内部性质[18]。
在水凝胶中水的含量很高,远远超过高分子链的含量,且高分子链上的1H弛豫时间很短,因此近似认为除干凝胶的谱图外,其他谱图中显示出来的为水分子的T2。从图5谱图中可以看出,T2主要有3个分布区域。根据水的运动性可以对这几个组分进行大致的分类[19-20]:T2在1 000~10 000 ms的组分运动性强,称之为自由水,谱图上标记为T21;T2小于10 ms的组分,水分子被束缚,运动性差,称之为结合水,谱图上标记为T23;而T2在10~100 ms的组分,分子运动受到一定的阻碍,称之为中间水,谱图上标记为T22。在本实验中,中间水组分对离子之间的相互作用和凝胶的限制作用比较敏感,运动性发生了显著变化,表现在谱图上就是峰形、峰宽和峰位的改变。在干凝胶中也有水分的存在,即中间水和结合水,其中,中间水含量较少,结合水含量较多。(需要指出的是,干凝胶中水分含量少,谱峰强度低,为了和其他样品进行比较,已将谱图放大,因此谱峰的强度不具有定量意义。)在干凝胶中加入纯水后,立即出现大量自由水(T21,图5(a)),而中间水裂分成为双峰,同时明显向左偏移。将弛豫时间较长的标记为T22-1,在图中用黑色箭头标出;弛豫时间较短的标记为T22-2,在图中用绿色箭头标出。可以看出,随着浓度的增加,T22-1 和T22-2的峰位都向左移动,对不同浓度Na2SO4溶液处理的凝胶体系的T22-1 和T22-2的峰位分布进行分析(图5(c)),可以发现得到相同的变化趋势,均类似指数变化,低浓度即可引起明显变化,随着浓度升高变化趋缓。因此该方法对低浓度的检测具有优势。因此,对于未知样品,可以根据T22-1 和T22-2的位置,大致了解其硫含量的范围,再进行进一步分析。
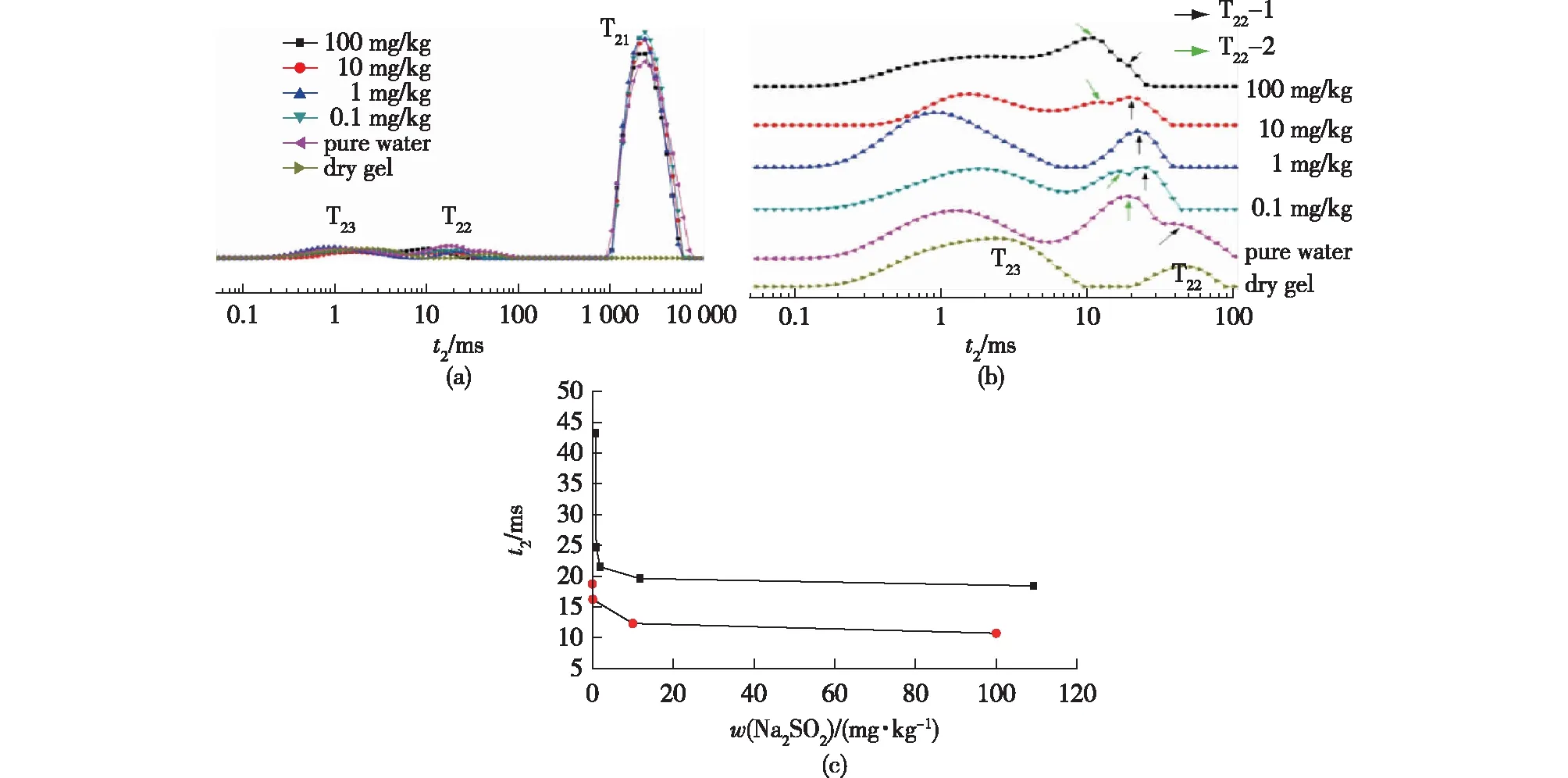
图5 凝胶样品及其在纯水及不同浓度Na2SO4溶液中的T2弛豫谱(a),中间水和结合水区域放大图(b),T2随Na2SO4浓度的变化(c)
基于上述实验现象,可以认为PEGA-MEA-AM多组分凝胶有望对食品中无机硫含量进行定量或半定量的检测,之后再将疑似超标的样品进行国家标准方法的检测,即快检与法检的有机结合,加快检验速度、降低检测成本。尤其是前处理和核磁检测都具有方法简单,快速的特点,符合食品快检的要求。但仍需进一步研究包括优化凝胶组分、确定检测限和标定标准曲线等,力争实现定量检测。相关工作仍在进行当中。
3 结论
本研究中,笔者制备了一种多组分含盐水凝胶,冻干后加工成型得到检测试剂,通过低场核磁共振技术可以在0~100 mg/kg(以Na2SO4计)的范围内定量或半定量测定总无机硫的含量,此外,本方法前处理简单无污染,符合食品快检的要求和趋势,有望为食品药品含硫熏蒸或过量添加的检测提供一种新的有效手段和方法。
