胰腺导管内管状乳头状肿瘤的影像表现并文献复习
2020-08-05柴丽王婷王晴柔朱乃懿柴维敏
柴丽 王婷 王晴柔 朱乃懿 柴维敏
胰腺导管内管状乳头状肿瘤 (intraductal tubulopapillary neoplasm,ITPN)是罕见的胰腺导管内肿瘤,仅占胰腺外分泌肿瘤的0.9%[1]。2010版WHO消化系统肿瘤分类[2]将ITPN列为上皮源性肿瘤的癌前病变,主要表现为导管内生长的小管状结构伴上皮重度异型增生,能分泌极少量的黏液,可伴有浸润性癌成分[1]。本文通过回顾5例ITPN临床及病理资料、影像学表现并进行文献复习,以提高对ITPN的认识。
1 资料与方法
1.1 一般资料 回顾性分析2016年1月—2019年1月在上海交通大学医学院附属瑞金医院经手术病理证实为ITPN的5例病人资料,其中3例ITPN伴浸润性癌。男3例,女2例,年龄56~78岁,中位年龄60岁。腹痛3例,腹泻伴恶心1例,无临床症状1例。肿瘤标志物糖类抗原(CA)199(>35 U/mL)升高 4 例,CA 242(>25 U/mL)升高 1 例,癌胚抗原(CEA)(>5.0 ng/mL)升高 1 例,肿瘤标志物均处于正常水平1例。
1.2 检查方法 采用GE Discovery CT 750 HD、Siemens IQon-spectral的MDCT设备对5例病人进行胰腺CT动态增强检查,管电压120 kV,管电流91 mA、204~206 mA。采集3~4期动态增强CT影像,即增强扫描动脉期(35 s)、门静脉期(60~70 s)、延迟期(120~180 s)影像。 采用 GE Signal HDxt 1.5 T、Philips Ingenia 3.0 T MR设备对3例病人进行动态增强MRI检查,腹部相控阵线圈。扫描序列为平扫T1WI、快速自旋回波(FSE)脂肪抑制 T2WI,扩散加权成像 (DWI)(b=0、800 s/mm2或 600 s/mm2),T1WI多期动态增强扫描。1例病人行磁共振胆胰管成像(MRCP)检查。
2 结果
2.1 CT表现 5例ITPN中4例为胰管内实性病灶,其中3例单发,分别位于胰头部(2例)和体尾部(1例)(图1A),1例呈多发病灶并分布于整个主胰管;另外1例为弥漫多发囊性病灶。4例实性病灶在CT平扫上呈等或稍低密度,病灶长轴与主胰管长轴相一致(图1B);增强影像上病灶均呈轻度渐进性延迟强化,各期强化程度均低于周围胰腺实质。3例胰管内肿块被低密度的胰液围绕,即 “双色导管征”(图1C),1例病灶与周围胰腺实质分界欠清,“双色导管征”不明显。1例弥漫多发囊性病灶于CT平扫上表现为囊内容物密度均匀,CT值为12~25 HU,最大囊性灶长径约7.3 cm,部分囊壁及分隔不规则增厚;增强CT上囊内容物未见强化,实性成分呈轻度渐进性延迟强化。5例ITPN病灶内及胰腺实质均未见钙化灶。
2.2 MRI表现 3例病人行MRI增强检查,其中2例为实性,1例为弥漫囊性,病灶分布与CT所见一致。实性病灶在T1WI上呈稍低及等信号,T2WI上呈稍高及等低信号(图2A),可见“双色导管征”(明显高信号的胰液包绕胰管内的肿块);DWI呈高信号,ADC信号较周围胰腺实质减低;MRCP检查可见“酒瓶软木塞征”,即扩张胰管内的肿块被高信号胰液包绕的表现(图2B)。弥漫囊性病灶在T2WI上囊液显示清晰,可见不规则增厚的囊壁及分隔,与CT表现相对应;增强后实性成分呈轻度延迟强化,强化程度各期均低于周围胰腺实质(图2C),强化模式与CT增强类似。
2.3 病理表现 5例中有3例为ITPN伴浸润性癌。大体标本主要表现为胰管扩张,内见乳头状或息肉状结构,切面均灰白,质中偏软。实性病灶中可见少量黏液,囊性病灶中黏液较多。镜下可见肿瘤组织位于导管腔内,衬覆柱状上皮,腺体呈背靠背生长,呈乳头状及管状生长(图2D),局部呈筛网状结构,肿瘤细胞呈柱状或立方形,核深染,呈中至重度增生改变。3例行免疫组化:CK7(+)、β-catenin(+)、CK19(+)、MUC-1(+)(图 2E)、SMAD-4(+)、P16(-)、CK20(-)、MUC-2(-)、Syn(-)、MUC5AC(少量+)(图 2F)、Ki-67(高密度区 10%+~30%+)。
3 讨论
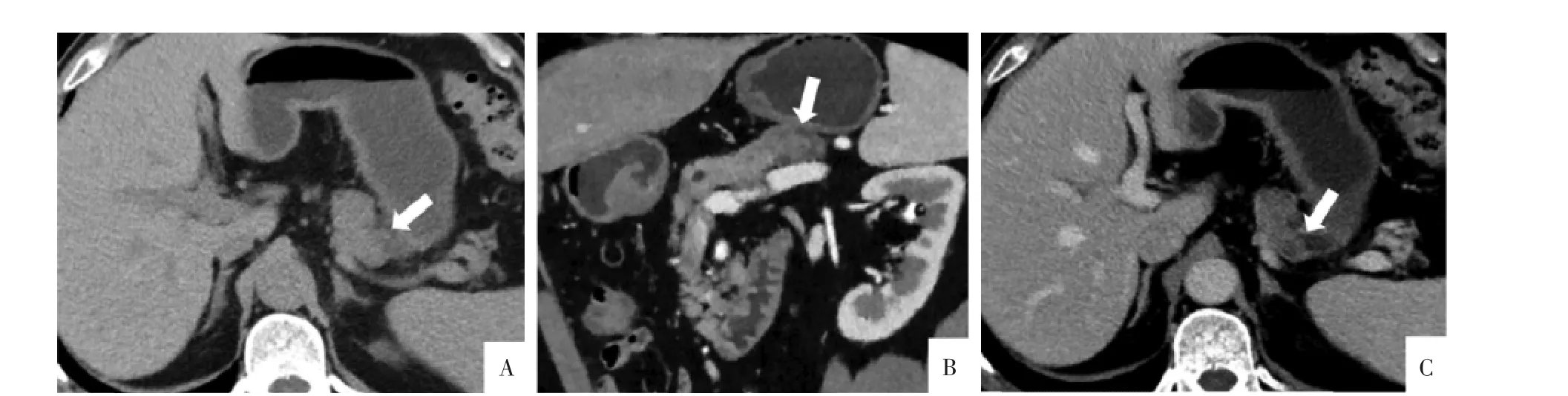
图1 ITPN病人,男,62岁。A图,CT平扫,病灶位于胰腺体尾部的胰管内(箭),上游主胰管扩张。B图,增强CT动脉期斜冠状面,胰管内的病灶呈轻度强化,病灶长轴与主胰管一致。C图,增强CT延迟期,病灶呈轻度延迟强化(箭)且强化程度低于周围胰腺实质强化。
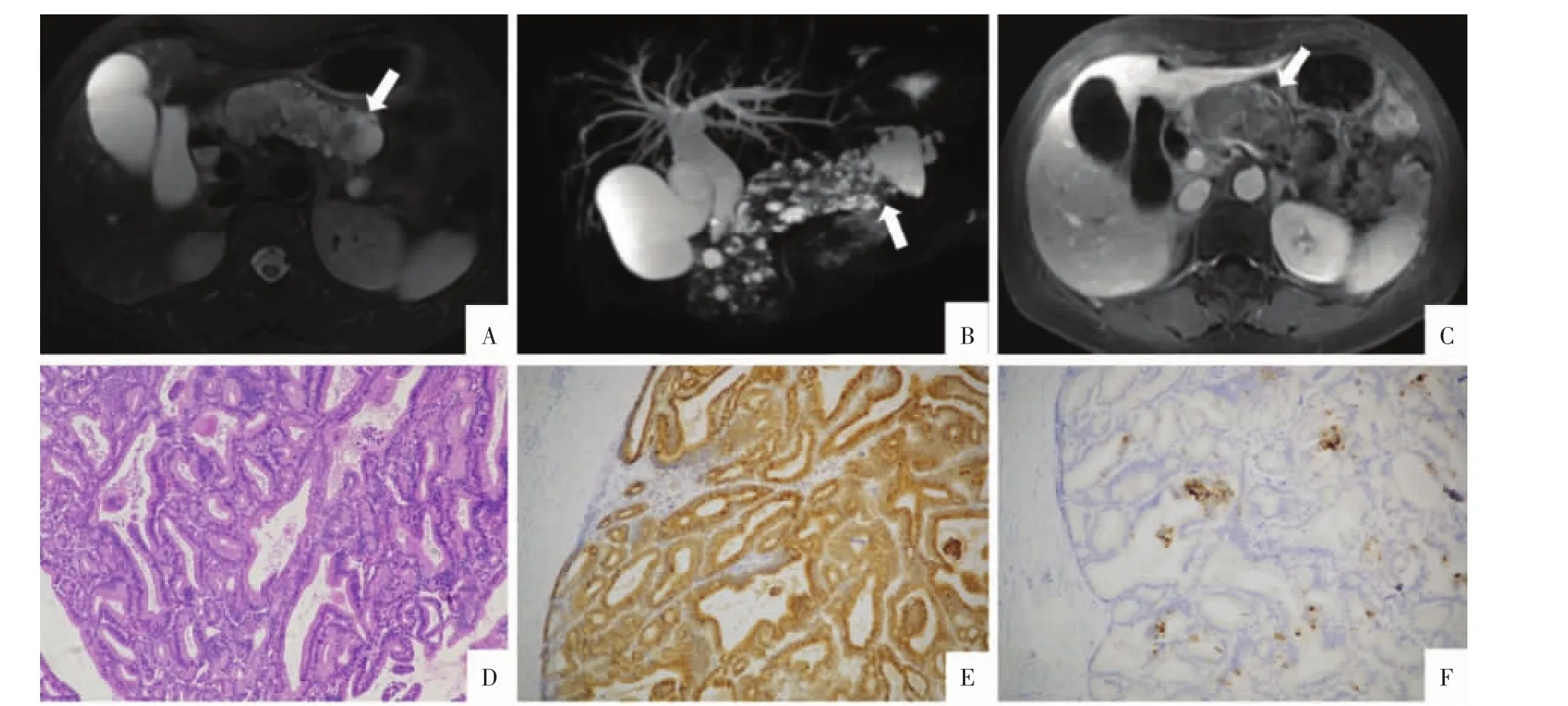
图2 ITPN病人,女,58岁。A图为抑脂T2WI,胰管内的软组织呈稍高信号,周围可见更高信号的胰液(箭),主胰管全程扩张。B图为MRCP,胰腺形态增大,扩张的主胰管内见多发不规则块状充盈缺损被高信号的胰液包绕(“酒瓶软木塞征”)(箭),胆总管、肝内胆管扩张,胆囊增大。C图为T1WI增强门静脉期,病灶呈轻度延迟强化(箭)。D图为病理图,镜下可见肿瘤组织呈管状乳头状生长,大部分区域腺体背靠背排列,部分呈筛状(HE,×100)。E图为MUC-1免疫组化染色阳性(免疫组化,×100)。F图,MUC5AC免疫组化染色大部分阴性,少量阳性(免疫组化,×100)。
3.1 ITPN临床表现 ITPN的发病年龄为35~84岁(平均年龄56岁),在性别上无明显差异,但也有报道女性略多于男性,男女比例约1∶1.2[1,3]。ITPN病灶可发生于胰腺的任何部位,可呈弥漫分布并累及胰腺腺体,但最常位于胰腺头部,病灶的平均直径约3 cm;临床症状最常见为腹痛,还可出现恶心、呕吐、体质量减轻和黄疸等表现[4-5]。Basturk等[5]报道约67%的ITPN伴有浸润性癌,本研究5例中有3例伴有浸润性癌。文献[5]报道不伴浸润性癌的ITPN与伴有浸润性癌的ITPN 5年总生存率分别为100%、71%;即使ITPN伴有浸润性癌,预后也相对良好[7]。
3.2 ITPN病理特点 ITPN为胰腺导管内乳头状及息肉状肿物,常无明显黏液。本研究中的实性病灶内可见少量黏液,囊性病灶内黏液较多。光镜下扩张的导管内小管状腺体呈管状生长方式,大部分区域腺体背靠背排列,部分呈筛状,可见类似粉刺样坏死。肿瘤周围间质中出现细条索状细胞或成角的腺体时,提示存在浸润性癌,本研究中有3例。免疫组化常表达 CK7、CK19、MUC-1、MUC-6,基本不表达 MUC-2、MUC5AC、CgA、Syn、CD56[1,7-9]。
3.3 影像表现 目前关于ITPN影像表现的报道较少,其术前准确诊断十分困难,但当胰管内出现肿块时应该考虑到ITPN。Zhang等[9]研究发现ITPN中有78%表现为实性病灶,22%表现为囊性病灶。本研究中4例表现为实性病灶,1例为伴有少许实性成分的囊性病灶,与上述研究结果相符。当ITPN为实性病灶并分布于胰管内时主胰管扩张,病灶被胰液包绕时影像表现可见“双色导管征”。Motosugi等[10]报道“双色导管征”、“酒瓶软木塞征”为ITPN特征性的影像表现,提示其为导管内生长方式。本研究发现有4例ITPN的导管内病灶长轴与胰管一致,此特征在之前的文献中未见报道,笔者推测由于ITPN缓慢的生长方式并且侵袭性不如胰腺导管腺癌,胰管内肿块生长受到胰管的限制。本研究中,5例ITPN的增强CT/MRI均表现轻度延迟强化且强化程度各期均低于周围胰腺实质,与文献[3,9]报道ITPN的强化方式类似;但极少数ITPN增强早期可有明显强化,此时与胰腺神经内分泌肿瘤鉴别困难[11]。此外,ITPN的胰腺病灶内可能会出现钙化。Takayama等[11]发现IPTN病灶在增强CT上早期明显强化并伴有粗糙钙化,相应病理结果发现病灶内有沙砾体和非沙砾体钙化,而且周围胰腺实质无慢性胰腺炎的表现;但本研究中5例病人均未发现胰腺病灶内钙化,可能与ITPN组织学类型不同有关。因此,胰腺病灶内出现钙化时,应考虑到ITPN的可能。
3.4 鉴别诊断 ITPN主要与以下疾病进行鉴别:①胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm,IPMN),与ITPN同属于胰腺导管内肿瘤,可分泌大量的黏液,分为主胰管型、分支型及混合型。在免疫组化及分子病理方面,大多数ITPN通常 MUC-6呈阳性,MUC5AC呈阴性,而IPMN相反。ITPN的Ki-67指数较IPMN更低,K-ras基因突变也更少见。在影像学表现上,IPMN可产生大量黏液,主胰管和/或分支胰管明显扩张,部分可见壁结节,囊性病灶与主胰管相交通[12-13];ITPN多为实性病灶,极少量分泌黏液,主要表现为胰管软组织肿块而引起胰管的扩张,据此可以鉴别两者。但是,当IPMN伴浸润性癌时,由于实性成分增加形成较大软组织肿块,致使两者难以鉴别。②胰管结石,CT或MRI上表现为不规则扩张胰管内结节状的高密度影或充盈缺损,增强后无强化[14],能够与ITPN很好地鉴别。③导管内生长方式的胰腺肿瘤,包括胰腺腺泡细胞癌、神经内分泌肿瘤和未分化癌等,均以导管内的实性肿块为表现,目前仅为个案报道,需要根据病理结果确诊[15]。④胰腺病灶内钙化的胰腺肿瘤,如胰腺神经内分泌肿瘤、实性假乳头状肿瘤、浆液性囊腺瘤及黏液性囊腺瘤等,这些肿瘤的钙化有一定的特征[16],且非导管内的生长方式,可与ITPN鉴别。
