茶树花Cu/Zn-SOD酶活性及其基因表达分析
2020-08-04王梦馨吴国火崔林韩宝瑜
王梦馨 吴国火 崔林 韩宝瑜

摘 要:為研究Cu/Zn-SOD基因在茶树花不同发育阶段、不同品种间的表达规律以及Cu/Zn-SOD基因表达量与酶活性之间的关系,本研究将‘龙井43品种茶树花分为4个发育阶段,选择15个品种的茶树花为研究对象,采用实时荧光定量PCR技术对3个Cu/Zn-SOD基因表达水平进行定量分析,同时测定Cu/Zn-SOD酶活性。结果表明:在茶树花的4个发育阶段中,第4阶段Cu/Zn-SOD酶活性最低,与其他3个阶段具有显著差异;不同品种的茶树花Cu/Zn-SOD酶活性有较大差异,其中‘紫鹃茶树花Cu/Zn-SOD酶活性最高,其次是‘黄金芽和‘白叶1号,‘黄观音的Cu/Zn-SOD酶活性最低。茶树花不同发育阶段中Cu/Zn-SOD基因表达水平存在较大差异,细胞质型Cu/Zn-SOD1基因表达水平远高于叶绿体型Cu/Zn-SOD2和过氧化物酶体Cu/Zn-SOD3;不同品种茶树花Cu/Zn-SOD基因表达水平有较大差异,Cu/Zn-SOD1基因在‘黄牡丹茶树花中表达量最高,Cu/Zn-SOD2基因在‘白叶1号和‘黄观音茶树花中表达量最高,Cu/Zn-SOD3基因在‘紫鹃茶树花中的表达量最高。相关性分析得知‘龙井43茶树花不同发育阶段Cu/Zn-SOD酶活性与Cu/Zn-SOD基因表达量之间的相关性不明显,而不同品种茶树花的Cu/Zn-SOD酶活性与Cu/Zn-SOD3基因表达量存在显著相关性。本研究初步明确了Cu/Zn-SOD酶活性较高的茶树品种和茶树花适宜的采摘时间,为茶树花SOD进一步研究提供参考。
关键词:茶树花;Cu/Zn-SOD基因;实时荧光定量PCR;Cu/Zn-SOD酶活性;‘龙井43中图分类号:S571.1 文献标识码:A
Enzyme Activity Characteristics and Expression ofCu/Zn-SODGene in Tea Flowers
WANG Mengxin, WU Guohuo, CUI Lin, HAN Baoyu*
College of Life Sciences, China Metrology University / Zhejiang Provincial Key Laboratory of Biometrology and Inspection & Quarantine, Hangzhou, Zhejiang 310018, China
Abstract:In order to study the expression characteristics ofCu/Zn-SODgene in the flowers within different developmental stages and various cultivars of tea plant flowers, and to discuss the correlationship between the expression ofCu/Zn-SODgene and its enzyme activity, four developmental stages of cultivar ‘Longjing 43 tea flower and 15 tea plant cultivars of fresh flowers were studied. The expression of threeCu/Zn-SODgenes was quantitatively analyzed by real-time fluorescent quantitative PCR techniques, and the enzyme activity of the three Cu/Zn-SOD was also determined simultaneously. The lowest Cu/Zn-SOD enzyme specific activity was found in the fourth stage, and the difference was significant when compared with the other developmental stages. The specific activity of Cu/Zn-SOD enzyme in different cultivars of tea flowers was significantly different. The Cu/Zn-SOD enzyme specific activity of ‘Zijuan tea flower was the highest, followed by ‘Huangjinya and ‘Baiye 1. The activity of Cu/Zn-SOD enzyme of ‘Huangguanyin tea flower was the lowest. The expression level ofCu/Zn-SODdiffered among the developmental stages, and the expression of cytoplasmicCu/Zn-SOD1gene was much higher than those of chloroplast typeCu/Zn-SOD2and peroxisomeCu/Zn-SOD3. The expression ofCu/Zn-SODin different cultivars was significantly different.Cu/Zn-SOD1had the highest expression in cultivar ‘Huangmudan tea flower,Cu/Zn-SOD2gene had the highest expression in cultivars ‘Baiye 1 and ‘Huangguanyin tea flowers, andCu/Zn-SOD3gene had the highest expression in cultivar ‘Zijaun tea flowers. The result of correlation analysis showed that the specific activity of Cu/Zn-SOD had no correlation withCu/Zn-SOD gene expression in different developmental stages of ‘Longjing 43 tea flowers, but had considerable correlation withCu/Zn-SOD3 gene expression in different tea cultivars. In this study, both tea cultivars and suitable plucking stage with high Cu/Zn-SOD activity were preliminarily expounded, which would provide references for the further research on SOD.
Keywords: tea plant flowers;Cu/Zn-SODgene; real time fluorescence quantitative PCR; Cu/Zn-SOD enzyme activity; cultivar ‘Longjing 43
DOI: 10.3969/j.issn.1000-2561.2020.06.014
茶树花是茶树(Camellia sinensis(L.) O. Kuntze)的有性生殖器官[1],含有丰富的蛋白质、氨基酸、香精油、茶多糖、维生素等营养和功能成分及超氧化物歧化酶(superoxide dismutase,SOD)等活性物质[2-6],对人体具有解毒、降脂、降糖、保护肠胃、增强免疫力和抗氧化等功效[7-8]。2013年卫生部第1号文件批准茶树花为新资源食品,允许直接开发和利用。研究发现茶树花含有抗氧化活性物质,有较强抗氧化功能,可与抗氧化植物迷迭香相媲美[9],其中SOD酶起重要作用[10]。SOD酶是一种生物内源性抗氧化剂,可通过歧化作用清除体内超氧阴离子自由基,减轻对细胞的损伤,在维持细胞膜的结构和功能中起着十分关键的作用[11],其研究已深入到食品、医药、化妆品等领域,应用范围广泛。根据金属辅因子的不同SOD酶可分为3类,即Cu/Zn-SOD、Mn-SOD和Fe-SOD[12]。Cu/Zn-SOD酶是SOD结构的第一族,在SOD酶中比例最大,占SOD总量86%[13]。一般植物来源的SOD为Cu/Zn-SOD,包括细胞质型、叶绿体型及过氧化物酶体型3个类型[14],其在活性氧清除的酶系中尤为重要,与植物的抗寒、耐盐碱等多种抗逆性关系密切[15-16],且植物源SOD有利于人体吸收,使用安全性高,对社会和经济效益明显,市场前景广阔。目前有关茶树中超氧化物歧化酶的研究主要集中于SOD酶在逆境胁迫中的作用[17-18],对茶树花中超氧化物歧化酶的研究主要在SOD酶抗氧化、提取工艺方面[19-20],对SOD酶活及其基因表达的报道较少。
本研究采用实时荧光定量PCR技术,对上述3类Cu/Zn-SOD基因在‘龙井43品种茶树花不同发育阶段中和15个栽培品种茶树花表达水平做定量分析,同时测定Cu/Zn-SOD酶活性,以探明3类Cu/Zn-SOD基因在茶树花不同发育阶段之间、茶树品种之间的表达差异,解析Cu/Zn-SOD基因表达水平与Cu/Zn-SOD酶活性之间的关系,以初步明确茶树花适宜采摘时间和Cu/Zn-SOD基因表达量高的茶树花品种,为茶树花SOD酶的研发提供参考。
1 材料与方法
1.1 材料
2017年11月于中国计量大学试验茶园(30°19?29.90? N,120°21?19.16? E,海拔11 m)中,参照刘晶晶等[21]方法采摘5年生的‘龙井43品种茶树上4个不同发育阶段的花(第1阶段:花瓣露白,第2阶段:花瓣初绽,第3阶段:完全绽放,第4阶段:花瓣开败)以及另外14个国家级茶树良种5年生茶树上第3阶段的花(图1)。液氮速冻后,置于?80 ℃冰箱中保存备用。
1.2方法
1.2.1 Cu/Zn-SOD酶活性的测定 准确称取样品0.25 g,加入1 mL预冷的匀浆介质(pH 7.4,0.01 mol/L Tris-HCl,0.0001 mol/L EDTA-2Na,0.01 mol/L蔗糖,0.8% NaCl),冰浴条件下进行匀浆,制成20%的匀浆液,3500 r/min,离心10 min,取上清液待测。采用南京建成生物工程研究所提供的黄嘌呤氧化酶法(植物铜锌超氧化物歧化酶测试盒A001-4)测定样品Cu/Zn-SOD酶活性。每毫克植物组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量定义为1个SOD活力單位(U)。
1.2.2 总RNA提取及cDNA合成 参照天根RNAprep Pure Plant Plus Kit试剂盒操作方法提取各样品总RNA,测得RNA浓度及A260/A280值在1.8~2.0之间。RNA的完整性通过1%琼脂糖凝胶电泳检测,提取的总RNA有明显的28S和18S两条带,亮度比例大致为2∶1左右,且无拖尾现象,说明所提取的总RNA完整。按照PrimSctiptTM RT Reagent Kit (Perfect Real Time) 操作方法,将各样品总RNA反转录合成cDNA第1链。获得的cDNA产物直接用于PCR或–20 ℃贮藏备用。
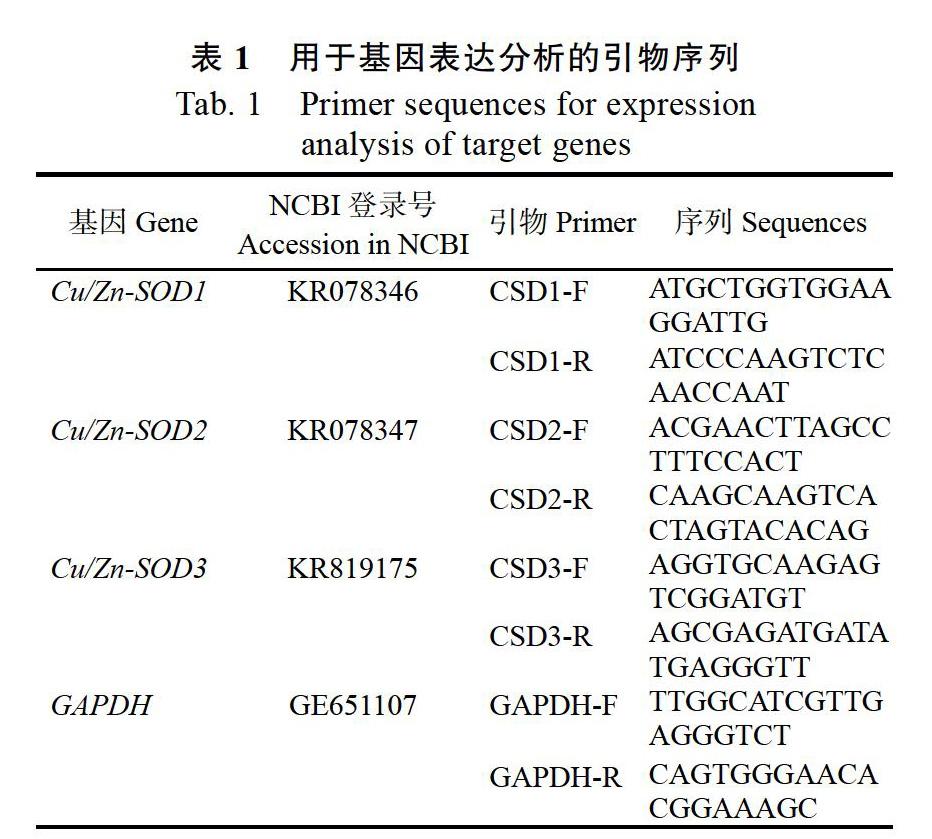
1.2.3 实时荧光定量PCR分析 以反转录产物为模板,用基因专一性引物[22](表1)进行相关基因的荧光定量分析。实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)选取GAPDH作为内参基因[23]进行校正。qRT-PCR方法参照SYBR Premix Ex TaqTM(TaKaRa)试剂盒。总体系20 μL﹕10 μL SYBR Premix Ex Taq(2×)、10 ?mol/L上引物和下引物各0.4 ?L、ROX Reference Dye(50×)0.4 ?L、2 ?L cDNA、加无菌水补足至20 ?L。反应在荧光定量PCR仪(ABI stepone plus)上进行。扩增程序为:95 ℃预变性1 min;95 ℃变性15 s, 58 ℃退火25 s,共45个循环,最后从55~95 ℃记录溶解曲线。通过分析溶解曲线,确定扩增产物为单一PCR产物。样品和内参分别重复3次。采用2-ΔΔCt方法进行基因表达水平分析。
1.3数据处理
采用DPS数据分析软件对试验数据做统计分析,利用Duncans 新复极差法进行显著性分析;采用SPSS 22.0统计分析软件进行Pearson相關性分析。
2 结果与分析
2.1 ‘龙井43茶树花的4个发育阶段及不同品种茶树花Cu/Zn-SOD酶活性的差异分析
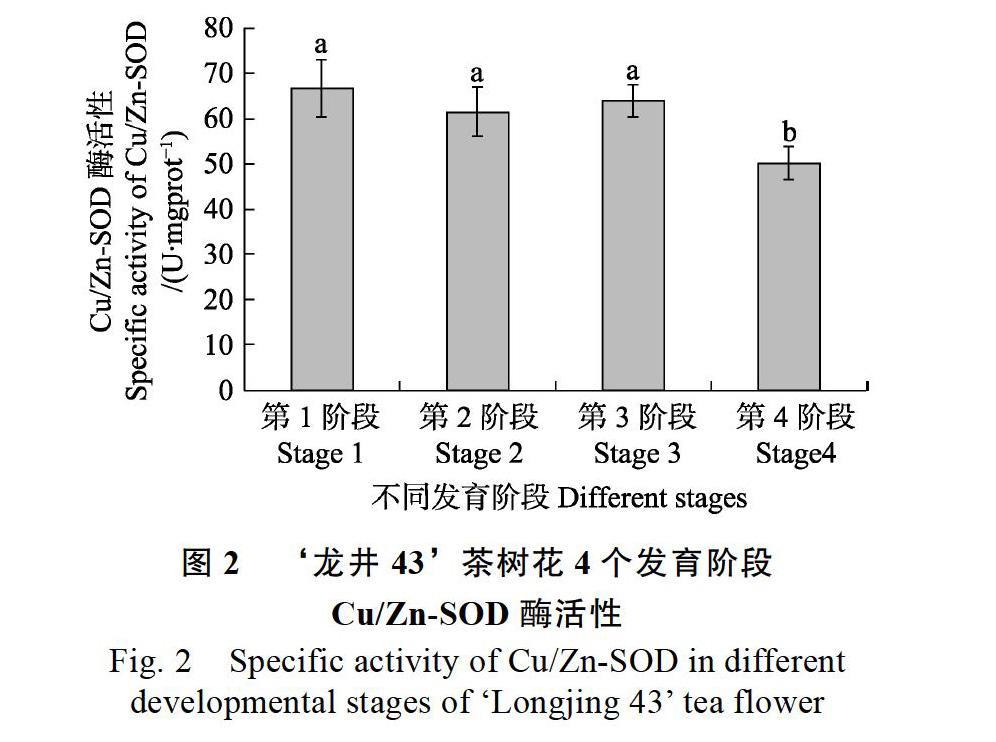
在‘龙井43茶树花的4个发育阶段中,Cu/Zn-SOD酶活性具有差异(图2)。随着茶树花的逐渐发育,Cu/Zn-SOD酶活性呈下降趋势。Cu/Zn-SOD酶活性由高到低顺序依次为:第1阶段>第3阶段>第2阶段>第4阶段。第1阶段Cu/Zn-SOD酶活性最高,显著高于第4阶段(P< 0.05),但与第2、第3阶段酶活性差异不显著。
对15个茶树品种茶树花第3发育阶段的酶活性测定中,发现:‘紫鹃(编号15)和‘黄金芽(编号9)茶树花Cu/Zn-SOD酶活性最高,显著高于其他品种茶树花(P<0.05)。其次是‘白叶1号(编号5)、‘中茶108(编号3)和‘龙井43(编号1)。‘黄观音(编号12)茶树花酶活性最低,‘紫鹃酶活性是‘黄观音的2.3倍左右(图3)。
2.2‘龙井43茶树花Cu/Zn-SOD基因表达的变化
在‘龙井43品种茶树花的4个发育阶段中,选择第3发育阶段3个Cu/Zn-SOD基因的表达水平为对照,即1个标准单位,据此分别计算3个Cu/Zn-SOD基因在其他3个发育阶段的相对表达水平。结果发现每个Cu/Zn-SOD基因在‘龙井43茶树花的4个不同发育阶段的表达水平都有较大差别(图4)。其中,Cu/Zn-SOD1基因的表达水平随着茶树花的发育而上调,在第4阶段达到最大值,显著高于其他阶段(P<0.05),是对照的1.2倍左右;Cu/Zn-SOD2基因表达水平呈先下降、后上升、再下降的趋势,在第3阶段达到最大值;Cu/Zn- SOD3基因表达水平呈先上升、后下降的趋势,在第2阶段达到最大值,是对照的1.2倍左右。
茶树花的4个发育阶段中的表达差异:在各个发育阶段中分别选用Cu/Zn-SOD1基因的表达水平为对照,即1个标准单位,据此计算Cu/Zn-SOD2、Cu/Zn-SOD3基因在第1、2、3、4发育阶段的相对表达水平(图5),发现‘龙井43茶树花的4个发育阶段中Cu/Zn-SOD1基因表达水平最高,均显著高于其他2个基因(P<0.05);在茶树花第1发育阶段,Cu/Zn-SOD1基因表达水平是Cu/Zn- SOD2基因表达水平的8倍左右,是Cu/Zn-SOD3基因的30倍以上;在茶树花的第2发育阶段,Cu/Zn-SOD1表达水平是Cu/Zn-SOD2的18倍,是Cu/Zn-SOD3的30倍;在茶树花的第3发育阶段,Cu/Zn-SOD1表达水平是Cu/Zn-SOD2、Cu/Zn- SOD3的30倍以上,Cu/Zn-SOD2的是Cu/Zn-SOD3的1.4倍左右;在茶树花的第4发育阶段,Cu/Zn- SOD1的是Cu/Zn-SOD2的40倍,是Cu/Zn-SOD3的80倍以上。
2.3不同品种茶树花Cu/Zn-SOD基因的表达差异分析
在15个茶树品种的茶树花发育的第3阶段中,Cu/Zn-SOD基因的表达水平存在明显差异(图6)。分别以‘龙井43茶树花的3个Cu/Zn-SOD基因的表达水平作为对照。结果显示,Cu/Zn- SOD1基因在‘黄牡丹(编号14)茶树花中表达量最高,是对照的2.4倍左右,与其他品种差异显著(P<0.05)。其次为‘鸠坑早(编号7)和‘紫鹃(编号15),皆显著高于其他品种茶树花(P<0.05),而在‘金观音(编号11)中表达量最低。Cu/Zn-SOD2基因在‘白叶1号(编号5)、‘黄观音(编号12)和‘龙井43(对照,编号1)茶树花中表达量最高,‘金观音(编号11)和‘中茶108(编号3)表达量最低。Cu/Zn-SOD3基因在‘紫鹃(编号15)茶树花中表达量最高,是对照的2倍左右,其次为‘黄金芽‘白叶1号‘紫牡丹‘金观音等,其中‘平阳特早(编号2)表达量最低。
2.4茶树花Cu/Zn-SOD酶活性与基因表达水平的相关性
对15个品种茶树花中每个Cu/Zn-SOD基因表达水平与Cu/Zn-SOD酶活性之间关联度进行相关性分析,发现Cu/Zn-SOD3基因的表达水平与Cu/Zn-SOD酶活性呈显著性相关性(P<0.05),其他2个Cu/Zn-SOD基因的表达水平与Cu/Zn-SOD酶活性的相关系数均未达到显著性水平(表2)。分析‘龙井43茶树花整个发育阶段(第1~4阶段)每个Cu/Zn-SOD基因表达量与Cu/Zn-SOD酶活性之间关联度(表3),相关系数均未达到显著性水平。
[5] 田国政, 王东辉, 周光来, 等. 茶树花营养成分的分析与评价[J]. 湖北民族学院学报(自然科学版), 2004(2): 26-28.
[6] 黄阿根, 董瑞建, 韦 红. 茶树花活性成分的分析与鉴定[J]. 食品科学, 2007(7): 400-403.
[7] Yang Z Y, Xu Y, Jie G L,et al. Study on the antioxidant activity of tea flowers (Camellia sinensis)[J]. Asia Pacific Journal of Clinical Nutrition, 2007, 16(S1): 148-152.
[8] Yoshikawa M, Sugimoto S, Kato Y,et al. Acylated oleanane-type triterpene saponins with acceleration of gastrointestinal transit and inhibitory effect on pancreatic lipase from flower buds of Chinese tea plant (Camellia sinensis)[J]. Chemistry and Biodiversity, 2009, 6(6): 903-915.
[9] 王秋霜, 赵超艺, 凌彩金, 等. 国内外茶树花研究进展概述[J]. 广东农业科学, 2009(7): 35-38.
[10] 陈鸿鹏, 谭晓凤. 超氧化物歧化酶(SOD)研究综述[J]. 经济林研究, 2007(1): 59-65.
[11] Kim K Y, Lee S Y, Cho Y S,et al. Molecular characterization and mRNA expression during metal exposure and thermal stress of copper/zinc-and manganese-superoxide dismutases in disk abalone,Haliotis discusdiscus[J]. Fish and Shellfish Immunology, 2007, 23(5): 1043-1059.
[12] KenIchi O, Sumio K, Kozi A. Intra- and extra-cellular localization of “Cytosolic” CuZn-superoxide dismutase in spinach leaf and hypocotyl[J]. Plant and Cell Physiology, 1996, 37(6): 790-799.
[13] 饒丽莎, 许珊珊, 黄田盛, 等. 杉木Cu/Zn-SOD基因克隆、序列特征及组织特异性表达[J]. 西北林学院学报, 2018, 33(2): 75-82.
[14] Kliebenstein D J, Monde R A, Last R L. Superoxide dismutase inArabidopsis: an eclectic enzyme family with disparate regulation and protein localization[J]. Plant Physiology, 1998, 118(2): 637-650.
[15] 冯昌军, 罗新义, 沙 伟, 等. 低温胁迫对苜蓿品种幼苗SOD、POD活性和脯氨酸含量的影响[J]. 草业科学, 2005(6): 29-32
[16] Song F N, Yang C P, Liu X M,et al. Effect of salt stress on activity of superoxide dismutase (SOD) inUlmus pumilaL.[J]. Journal of Forestry Research, 2006, 17(1): 13-16.
[17] 屠幼英, 杨秀芳, 杨贤强. 茶树抗逆境生理与超氧歧化酶(SOD)的相关性[J]. 茶叶, 1996(2): 40-43.
[18] 朱 政, 蒋家月, 江昌俊, 等. 低温胁迫对茶树叶片SOD、可溶性蛋白和可溶性糖含量的影响[J]. 安徽农业大学学报, 2011, 38(1): 24-26.
[19] 白婷婷, 孙威江, 黄伙水. 茶树花的特性与利用研究进展[J]. 福建茶叶, 2010, 32(Z1): 7-11.
[20] 翁 蔚. 茶(Camellia sinensis)花主要生物活性成分研究及应用展望[D]. 杭州: 浙江大学, 2004.
[21] 刘晶晶, 王富民, 刘国峰, 等. 茶树萜类香气物质代谢谱与相关基因表达谱时空变化的关系[J]. 园艺学报, 2014, 41(10): 2094-2106.
[22] 王 仲. 铁观音茶树SOD家族成员基因克隆及其低温胁迫表达分析[D]. 福州: 福建农林大学, 2016.
[23] 孙美莲, 王云生, 杨冬青, 等. 茶树实时荧光定量PCR分析中内参基因的选择[J]. 植物学报, 2010, 45(5): 579-587.
[24] Mckersie B D, Murnaghan J, Jones K S,et al. Ironsuperoxide dismutase expression in transgenic alfalfa increases winter survival without a detectable increase in photosynthetic oxidative stress tolerance[J]. Plant Physiology, 2000, 122(4): 1427-1437.
[25] 汪本勤, 陳 曦, 向成斌. SOD活性增高的拟南芥晚花突变体具有增强的非生物胁迫耐受性[J]. 植物学通报, 2007(5): 572-580.
[26] 姜慧芳, 任小平. 干旱胁迫对花生叶片SOD活性和蛋白质的影响[J]. 作物学报, 2004(2): 169-174.
[27] 李 敏, 王维华, 王 然, 等. 高温胁迫对菠菜叶片保护酶活性和膜透性的影响[J]. 园艺学报, 2004(1): 99-100.
[28] 王 盛, 张保青, 黄 杏, 等. 甘蔗Cu/Zn-SOD的克隆和表达分析[J]. 中国农业科学, 2013, 46(15): 3277-3284.
