甘薯近缘种Ipomoeacordatotriloba基因组大小测定及高通量调查测序
2020-08-04王珧邓逸桐戴习彬张安曹清河陈艳丽
王珧 邓逸桐 戴习彬 张安 曹清河 陈艳丽
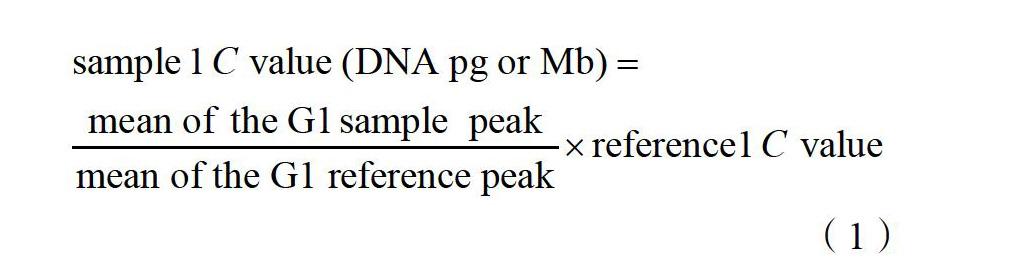
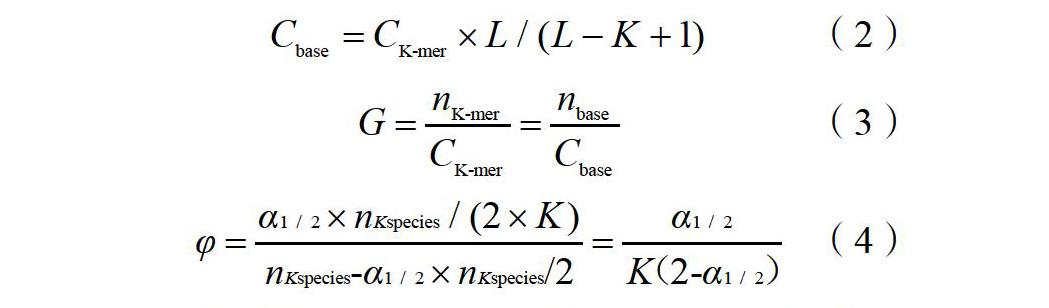
摘 要:利用流式细胞术,以大豆Williams 82为内参,对甘薯近缘野生种Ipomoea cordatotriloba进行基因组大小测定,结合染色体压片技术进行倍性鉴定,并利用二代高通量测序技术对测定结果进行验证。结果表明:利用流式细胞术测得I. cordatotriloba基因组大小为(539.69±13.76)Mb;染色体压片结果显示其染色体数目为30条,由于其基数x=15,从而获知I. cordatotriloba為二倍体;经K-mer计算并修正后得出的C值为560.70 Mb,与流式细胞分析结果相近;同时,测序结果显示其基因组杂合率为0.40%;重复序列比率为57.93%;GC含量为38.10%。以上结果为此物种全基因组精细图谱绘制打下基础,同时为甘薯近缘野生种的利用提供参考。
关键词:甘薯;Ipomoea cordatotriloba;基因组大小;流式细胞法;K-mer计算中图分类号:S531;Q75 文献标识码:A
DNA Amount Estimation and Genome Survey of Sweetpotato Wild RelativesIpomoea cordatotriloba
WANG Yao1, 2, DENG Yitong2, DAI Xibin2, ZHANG An2, CAO Qinghe2, CHEN Yanli1*
1. College of Horticulture, Hainan University, Haikou, Hainan 570228, China; 2. Jiangsu Xuhuai Regional Xuzhou Institute of Agricultural Sciences, Xuzhou, Jiangsu 221131, China
Abstract: DNA content of sweetpotato wild relativesIpomoea cordatotrilobawas determinated by flow cytometry using soybeanWilliams 82 as the internal reference in this study. The ploidy was determined by chromosome counting. In order to verify the reliability of the results, the next-generation sequencing was used to further test and verify. It was a diploid species with base number was 15. The genome size was (539.69±13.76) Mb by the flow cytometry analysis. The C-value determined by sequencing was similar to the results of flow cytometry. Furthermore, the genomic heterozygosity rate, repeat sequence ratio and GC content was 0.40%, 57.93% and 38.10%, respectively. The above results would lay the foundation for the whole genome sequencing and assemble of this species, and provide references for the utilization of sweetpotato relatives.
Keywords: sweetpotato;Ipomoea cordatotriloba; genome size; flow cytometry; sequencing
DOI: 10.3969/j.issn.1000-2561.2020.06.012
甘薯因具有营养丰富、适应性广等优点大面积种植于热带、亚热带地区[1],是世界第七大主粮作物(FAO,2018)。甘薯属植物约有800~900个种,其中有二倍体、四倍体和六倍体等不同倍性的物种资源,且许多野生种具有优良的抗性基因[2-3]。基因组特征研究是植物基因资源开发、利用的前提。基因组大小、重复序列比例、杂合率和GC含量等参数会影响基因组的拼接组装过程[4]。基因组大小是指物种单倍体所含的DNA量,是表征生物基因组多样性的基本参数[5]。目前测定基因组大小的方法很多,流式细胞法(Flow cytometry,FCM)因其快速、准确的特点而被广泛应用[6],超过80%的物种都是采用该方法进行基因组大小测定[7],如枣、月季、草莓、灵芝[8-11]等。近年来,采用低深度测序后进行K-mer分析也是常用方法之一[12]。通过低深度高通量测序(Survey分析)判断基因组大小及复杂程度,以此选择合适的后续测序方案,从而增加测序的准确性[13]。
由于倍性复杂,甘薯遗传基础薄弱,导致甘薯的物种起源和基因组学研究落后于其他主要农作物[14]。近年来甘薯基因组研究逐渐兴起,然而甘薯属多数物种仍缺乏基本的基因组信息。Ipo?moeacordatotriloba是甘薯组与栽培甘薯亲缘关系较近的13个物种之一,对研究甘薯亲缘关系及物种起源具有重要意义。本研究利用流式细胞术和染色体计数法,结合高通量测序技术,对I. cordatotriloba的基因組大小、倍性及基因组特征进行评估,为下一步全基因组测序提供参考并为甘薯野生资源利用提供支撑。
1 材料与方法
1.1材料
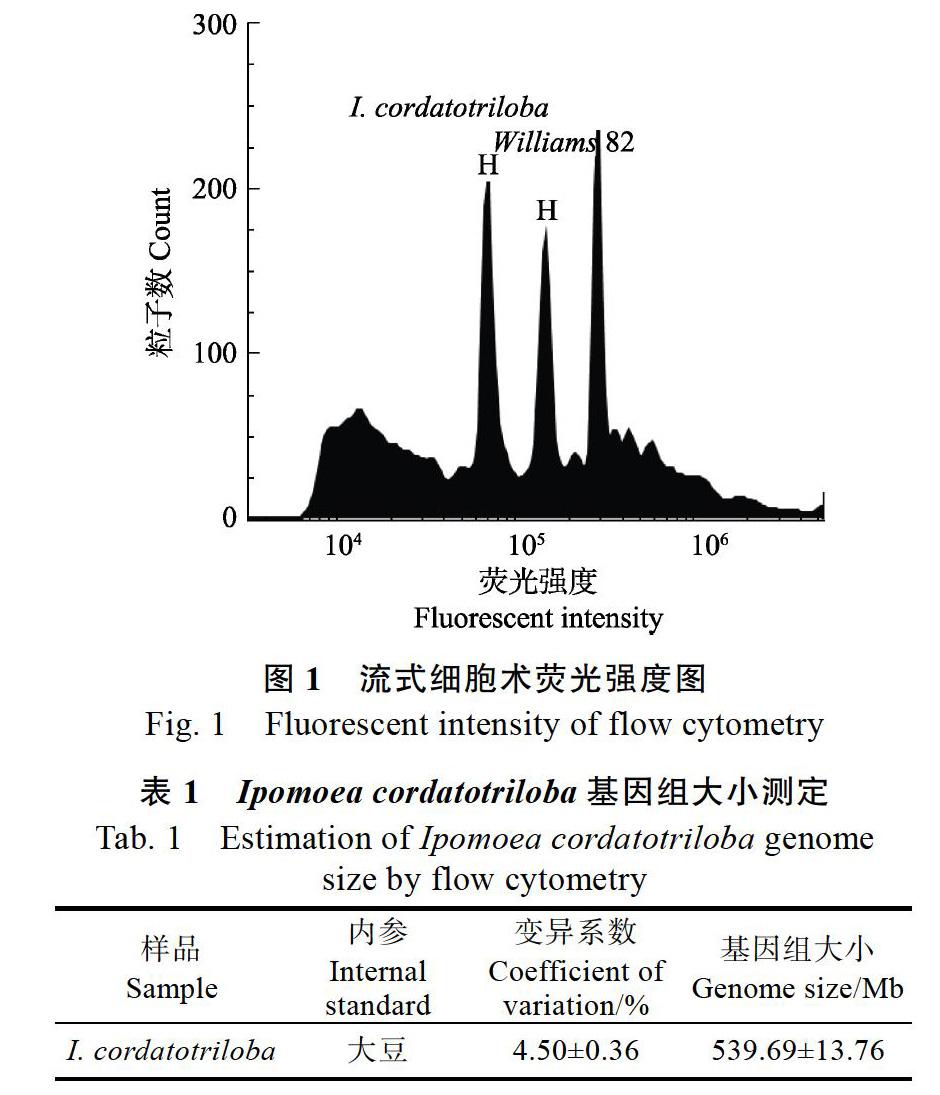
Ipomoea cordatotriloba(PI 518495)引自美国国家种质资源库,来源地为墨西哥Tabasco州。用已知基因组大小的大豆Williams 82(1 C= 1127 Mb[15])作为内参。
1.2方法
1.2.1 流式细胞术 将搜集的野生种种子浸种催芽之后置于25 ℃的温室内生根,于1~2 d后取200 mg根尖进行实验;参照Peggy Ozias-Akins[16]的实验方法,取样后用蒸馏水洗净、晾干,放入预冷的无菌培养皿中,加入预冷4 ℃的改良硫酸镁裂解液600 μL。材料须浸没在裂解液中,用一次性灭菌刀片在一分钟内快速切碎该组织;用38 μm筛网过滤到1.5 mL EP管中;以2000 r/min离心6 min,弃上清液;加入200 μL PI染液(含浓度为50 μg/mL的RNase酶)置于4 ℃冰箱避光染色15 min,添加染料后震荡EP管;最后用BD公司C6流式细胞仪收集10 000个事件,重复测定3次。通过公式(1)计算基因组大小[17](单位用pg或Mb来表示,两者间的换算关系为1 pg=978 Mb[18])。
1.2.2 染色体压片 参照杨慧娴等[19]的方法,取I. cordatotriloba新鲜1 cm根尖于8-羟基喹啉中处理2~3 h,经蒸馏水洗净后转移至卡诺固定液中,24 h后于70%酒精中保存备用。实验时,取出根尖先用无菌水冲洗2~3次,再用柠檬酸冲洗2次,吸干柠檬酸后加入200 μL 2%纤维素酶和1%果胶酶的混合酶液进行酶解。切取根尖于载玻片上,用滤纸吸走多余水分,取干净的镊子轻轻敲打根尖。制片成功后加DAPI染色,于荧光显微镜下观察并拍照。
1.2.3 基因组survey分析 取4~6片甘薯野生种I. cordatotriloba叶片,洗净后置于液氮保存,委托北京诺禾致源科技股份有限公司进行测序。通过Covaris超声波破碎仪将DNA样品随机打断,构建250 bp小片段测序文库。将得到的原始序列数据进行质控,去除污染序列,得到有效数据,采用K-mer计算方法[20]分析有效数据。通过公式(2)、(3)可估计基因组大小。通过公式(4)(适用于重复序列影响较小的基因组)计算杂合率,参照霍恺森等[12]的方法(纯合峰深度1.8倍后面的K-mer数/K-mer总数?100%)来估计重复序列比例。
1.2.4 基因组初步组装 通过被reads截断的更小序列片段之间的重叠关系构建de Brujin图,去掉测序错误造成的分支,随机选择少量杂合位点并合并。将简化后的de Brujin图的每个分叉位点的序列截断,即为最初的Contigs。再将reads和Contigs进行比对,将Contigs组装成Scaffolds。
2 结果与分析
2.1流式分析结果
图1为大豆作为内参时,参照物与待测样本的荧光强度图。图中I. cordatotriloba和大豆主峰清晰可见,区分明显。图1中3个峰分别为I. cor?datotriloba的G1峰,Williams 82大豆的G1峰以及G2峰。参照物和样本峰的CV值均小于5%,表明测定结果稳定可靠。通过对参照物和待测样品3个生物学重复测定,I. cordatotrilobaG1峰的平均荧光强度为71 291.67,Williams 82大豆G1峰的平均荧光强度为148 601.00,根据公式(1)计算得出(表1),I. cordatotriloba基因组大小为(539.69±13.76)Mb。
2.2染色体压片结果
通过染色体压片计数法,确定I. cordatotriloba的倍性。DAPI染液只对染色体进行特异性染色,杂质无法被染色,因此较易判断染色体的轮廓,背景干净,计数较方便。I. Corda?totri?lo?ba染色体形态清晰,呈长棒状,分散良好,粘连现象较少,存在拖尾现象但不影响计数(图2)。通过观察10个细胞的分裂相,染色体数目均为30条,由于甘薯属植物染色体基数x=15,从而获知I. cordatotriloba为二倍体。
2.3基因组survey分析结果
2.3.1 测序产出数据统计 对经过Illumina高通量测序技术得到的数据进行严格过滤,得到24.46 Gb的有效数据用于K-mer分析。由表2可知,测序质量≥20的碱基比率为97.01%,测序质量≥30的碱基比率达到92.05%,说明I. cordatotriloba基因组的测序质量较高。
2.3.2 K-mer分析及基因组特征预估 本研究选用K-mer=17进行分析,其频率分布图(图3)显示,I. cordatotriloba的期望深度即图中的主峰,在38附近,且主峰的2倍处有凸起,表明样品有一定重复率,经计算I. cordatotriloba的重复序列比率为57.93%,并根据公式(4)得到杂合率为0.40%。由表3可知,I. cordatotriloba的K-mer数量为18 867 813 720,通过公式(3)计算得出I. cordatotriloba基因组大小为571.75 Mb,经修正后为560.70 Mb。
2.3.3 基因组组装结果分析 K-mer值取41时可得到最优的拼接效果。将24.46 Gb有效数据进行拼接,分别得到978 566条Contigs和961 850条Scaffolds;由表4可知,I. corda?to?triloba经组装后得到Contigs总长度为466 005 979 bp,占基因组大小的81.3%,其中最长为67 068 bp。Scaffolds总长度为467 229 510 bp,占基因组大小的81.5%,最长为67 068 bp。
图4显示I. cordatotriloba只有1个明显的峰,与K-mer结合分析得知,该样品为纯合峰。如图5,右方是测序深度分布,上方是GC含量分布,图中颜色越红,表示密度越大。GC含量分布在25%~55%,由上方含量分布峰可知40% 左右最密集,预估样本的GC含量为38.10%。图中未出现明显分层现象,且无高GC含量区域,故认为I. cordatotriloba无细菌污染。
3 讨论
基因组大小是分析种群进化、物种分类和生态学等领域研究的重要参照[21]。本研究通过对I. cordatotriloba基因组大小进行测定,为探究甘薯近缘野生种的基因组学信息提供参考。张志珂等[22]用萝卜、大豆、番茄做外参,通过流式细胞术估算‘解放钟枇杷基因组大小为654.399 Mb,与测序得到的结果773 Mb有较大的差异,误差达15.3%。Bennett等[23]以新杆状线虫和果蝇作为内标测得拟南芥的基因组大小为157 Mb,与早期测序得到的125 Mb也存在较大差异,误差为基因组大小的25.6%。本研究以Williams 82大豆为内参,通过流式细胞仪测定I. cordatotriloba的基因组大小为(539.69±13.76)Mb。基于K-mer分析得到的I. cordatotriloba的基因组大小为560.70 Mb,与流式细胞术得到的结果误差仅为3.7%,说明2种测定方法得到的结果较为接近。前人研究表明I. cordatotriloba是四倍体,基因组大小为3.3 pg/2C[16],与本研究得出的基因组大小差异较大。随着科学技术的发展,现代的流式细胞仪器更先进,准确性更高,且本研究根据染色体计数得出I. cordatotriloba为二倍体,结合survey预估的数据认为本研究的结果更为准确。
植物基因组杂合受到品系、繁殖方式等因素影响[24]。甘薯具有自交不亲和性[25],有性繁殖和无性繁殖共存。杂合率低的植物种群内及种群间基因交流程度低,基因资源稳定,环境适应能力较强[26]。郭水良等[27]认为同一科(或属)内相关物种间的DNA C-值较小的植物可能具有更强的入侵性。甘薯近缘野生种马鞍藤(Ipomoea pes-ca?praeL.)杂合率为0.99%,DNA C-值为1041.65 Mb[12],I. cordatotriloba杂合率为0.40%,DNA C-值为560.70 Mb;由此推测,I. cordatotriloba环境适应能力比马鞍藤更强,是进一步筛选优异基因资源、研究甘薯近缘野生种的重要材料。
从Sanger测序到第2代(Roche 454、SoLiDTM、Illumina)测序平台以及第3代PacBio测序平台,基因组测序的蓬勃发展使得测序技术普遍应用于植物研究中[28]。基因组越大、倍性越高对测序技术、机器性能要求越高;而杂合度会导致组装基因组偏大,数值高于0.5%则认为该品种不易组装,高于1%则认为该品种很难实现组装[29-30]。本研究利用二代Illumina测序平台对I. cord?a?totriloba进行K-mer分析,得到I. cordatotriloba基因组大小为560.70 Mb,杂合率为0.40%,重复序列比率为57.93%,GC含量为38.10%,具有一定重復率和较低的杂合度。结合染色体压片法进行染色体计数可知I. cordatotriloba为二倍体。综上所述,研究认为I. cordatotriloba为简单基因组,可尽快实施全基因组测序计划,可采用低成本二代测序技术进行全基因组测序。以上结果为I. cordatotriloba全基因组测序策略的选取和甘薯近缘野生种的利用提供参考。
参考文献
- 刘庆昌. 甘薯在我国粮食和能源安全中的重要作用[J]. 科技导报, 2004(9): 21-22.
- 曹清河, 马代夫, 张 安. 甘薯近缘种染色体核型及花粉粒超微结构分析[J]. 西北植物学报, 2008(8): 1610-1613.
- Srivastava G, Mehrotra R C, Dilcher D L. Paleocene Ipomoea (Convolvulaceae) from India with implications for an East Gondwana origin of Convolvulaceae[J]. Proceedings of the National Academy of Sciences, 2018, 115(23): 6028- 6033.
- 钟永达, 张 新, 李彦强, 等. 鹅掌楸全基因组调查[J]. 分子植物育种, 2017, 15(2): 507-512.
- 马鹏举, 周佳熠, 孙会改, 等. 基于流式细胞术和K-mer分析的好好芭基因组大小估测[J]. 北京师范大学学报(自然科学版), 2018, 54(6): 733-737.
- 邓果特, 刘清波, 蒋建雄, 等. 五节芒基因组大小测定[J]. 植物遗传资源学报, 2013, 14(2): 339-341, 346.
- 田新民, 周香艳, 弓 娜. 流式细胞术在植物学研究中的应用——检测植物核DNA含量和倍性水平[J]. 中国农学通报, 2011, 27(9): 21-27.
- 王利虎, 吕 晔, 罗 智, 等. 流式细胞术估测枣染色体倍性和基因组大小方法的建立及应用[J]. 农业生物技术学报, 2018, 26(3): 511-520.
- 武荣花, 葛蓓蓓, 王茂良, 等. 应用流式细胞术测定18个中国古老月季基因组大小[J]. 北京林业大学学报, 2016, 38(6): 94-100.
- 陈丙义, 李金凤, 霍恒志, 等. 6种野生草莓基因组大小估算[J]. 果树学报, 2015, 32(1): 51-56.
- 李秋实, 徐 江, 朱英杰, 等. 基于流式細胞技术的灵芝基因组大小估测[J]. 菌物学报, 2013, 32(5): 899-906.
- 霍恺森, 赵冬兰, 陈艳丽, 等. 甘薯属耐盐植物马鞍藤基因组大小及特征分析[J]. 植物遗传资源学报, 2019, 20(3): 728-735.
- 施季森, 王占军, 陈金慧. 木本植物全基因组测序研究进展[J]. 遗传, 2012, 34(2): 145-156.
- 杨 俊, 范维娟, 王红霞, 等. 番薯属植物基因组测序最新进展[J]. 植物生理学报, 2017, 53(5): 768-771.
- Schmutz J, Cannon S B, Schlueter J, et al. Genome sequence of the palaeopolyploid soybean[J]. Nature, 2010, 463(7278): 178-183.
- Ozias-Akins P, Jarret R. Nuclear DNA content and ploidy levels in the genus Ipomoea[J]. Journal of the American Society for Horticultural Science, 1994, 119(1): 110-115.
- Dolezel J, Greilhuber J, Suda J. Estimation of nuclear DNA content in plants using flow cytometry[J]. Nature Protocols, 2007, 2(9): 2233-2244.
- Dolezel J, Bartos J, Voglmayr H, et al. Nuclear DNA content and genome size of trout and human[J]. Cytometry Part A: the Journal of the International Society for Analytical Cytology, 2003, 51(2): 127-128.
- 杨慧娴, 孙文光, 欧晓昆, 等. 中国西南地区6种植物的核型研究及其系统学意义[J]. 西北植物学报, 2019, 39(4): 630-637.
- 张 伟, 王 瑞, 杨晓野, 等. 捕食性真菌Duddingtonia flagrans基因组DNA的提取及基因组survey分析[J]. 中国兽医学报, 2017, 37(11): 2090-2094.
- 尤禄祥, 谢梦梦, 伊贤贵, 等. 早樱种系基因组大小的研究[J]. 安徽农业大学学报, 2017, 44(6): 1093-1097.
- 张志珂, 王永清, 林顺权, 等. 借助细胞流式仪进行枇杷基因组学测序材料的倍性鉴定[J]. 果树学报, 2012, 29(3): 498-504.
- Bennett M D, Leitch I J, Price J H, et al. Comparisons with Caenorhabditis (~100 Mb) and Drosophila (~175 Mb) using flow cytometry show genome size in Arabidopsis to be ~157 Mb and thus ~25% larger than the Arabidopsis genome initiative estimate of ~125 Mb[J]. Annals of Botany, 2003, 91(5): 547-557.
- 宋立肖, 李国旗, 靳长青, 等. 大麻状罗布麻的全基因组分析和SSR标记开发[J]. 植物遗传资源学报, 2019, 20(5): 1309-1316.
- 张 安, 戴习彬, 周志林, 等. 甘薯祖先种三浅裂野牵牛自交不亲和研究进展[J]. 江西农业学报, 2017, 29(5): 17-21, 27.
- 王 雪, 周佳熠, 孙会改, 等. 新疆沙冬青基因组调查测序与基因组大小预测[J]. 植物遗传资源学报, 2018, 19(1): 143-149.
- 郭水良, 陈国奇, 毛俐慧. DNA C-值与被子植物入侵性关系的数据统计分析——以中国境内有分布的539种被子植物为例[J]. 生态学报, 2008(8): 3698-3705.
- Dolezel J, Bartos J. Plant DNA flow cytometry and estimation of nuclear genome size[J]. Annals of Botany, 2005, 95(1): 99-110.
- Feuillet C, Leach J E, Rogers J, et al. Crop genome sequencing: lessons and rationales[J]. Trends in Plant Science, 2011, 16(2): 77-88.
- Edwards M A, Henry R J. DNA sequencing methods contributing to new directions in cereal research[J]. Journal of Cereal Science, 2011, 54(3): 395-400.
