3D可视化联合3D打印在肝癌大部分肝切除术中的应用
2020-08-04洪峰华黄大海叶彬邱玉芬梁志银方兆山
洪峰华,黄大海,叶彬,邱玉芬,梁志银,方兆山
1.广西壮族自治区江滨医院放射科,广西南宁530021;2.广西壮族自治区妇幼保健院,广西南宁530000;3.广西医科大学第五附属医院肝胆胰腺外科,广西南宁530022
前言
随着数字智能化技术[1]的不断普及、接受及应用,以及“精准肝外科”理念[2]的不断深入人心,肝癌肝切除术,特别是大部分肝切除术的术前评估、手术规划,更加客观、量化分析,准确地评估残肝体积比,对大部分肝切除术的可行性和减少手术并发症具有重要意义。因为肝切除术后残余肝体积不足导致术后肝功能衰竭仍是肝脏手术后的主要死亡病因[3]。因此准确地评估肝脏体积,特别是残肝体积比具有非常重要的临床意义。残肝体积与其储备功能有着密切的关系。国外已将其视为与Child Pugh 分级同等重要的肝脏储备功能评价指标[4]。然而,由于不同个体身高、体质量存在差异,相同的残肝体积在不同个体表现出的肝功储备情况亦有所不同。以体表面积标准化的残肝体积可缩小个体差异,使个体间的比较成为可能且较为科学。残肝体积作为评估肝脏储备功能的重要指标之一,在评估患者肝脏手术承受能力、指导选择合适手术方式方面具有重要的临床意义[5]。本研究旨在探讨3D 系统软件、CT 软件在肝癌行大部分切除术评估相关肝体积准确性,以及3D 可视化技术、3D 打印在肝癌大部分肝切除术围手术期的应用价值。
1 资料与方法
1.1 一般资料
选取广西医科大学第五附属医院2017年2月~2020年1月收治的原发性肝癌患者46例,并随机分为观察组和对照组,每组23例。观察组(3D 组)患者采用3D 可视化技术和3D 物理打印模型进行围手术期的评估和指导大部分肝切除术,主要基于肝体积分析和3D打印评估等,并给出相应的具体手术方案;对照组(CT 组)患者采用传统CT 资料对术前进行相关肝体积评估后进行手术规划。纳入标准:(1)符合原发性肝癌诊断标准[6]并且有肝切除术手术意愿;(2)术前肝功能Child‐Pugh分级为A 级;(3)一般情况好,且经评估,可拟行大部分肝切除术[7]的患者。排除标准:(1)非大部分肝切除术患者;(2)严重心肺等功能不全;(3)难以根治性切除;(4)肝功能Child‐Pugh C 级,难以耐受手术者;(5)术后病理结果不是肝细胞肝癌。入院及术前充分告知病情,签署由医院伦理委员会批准的知情同意书和手术知情同意书。两组患者术前一般资料(年龄、性别、合并症、乙肝背景、标准肝体积等)比较,差异无统计学意义(P>0.05,表1)。
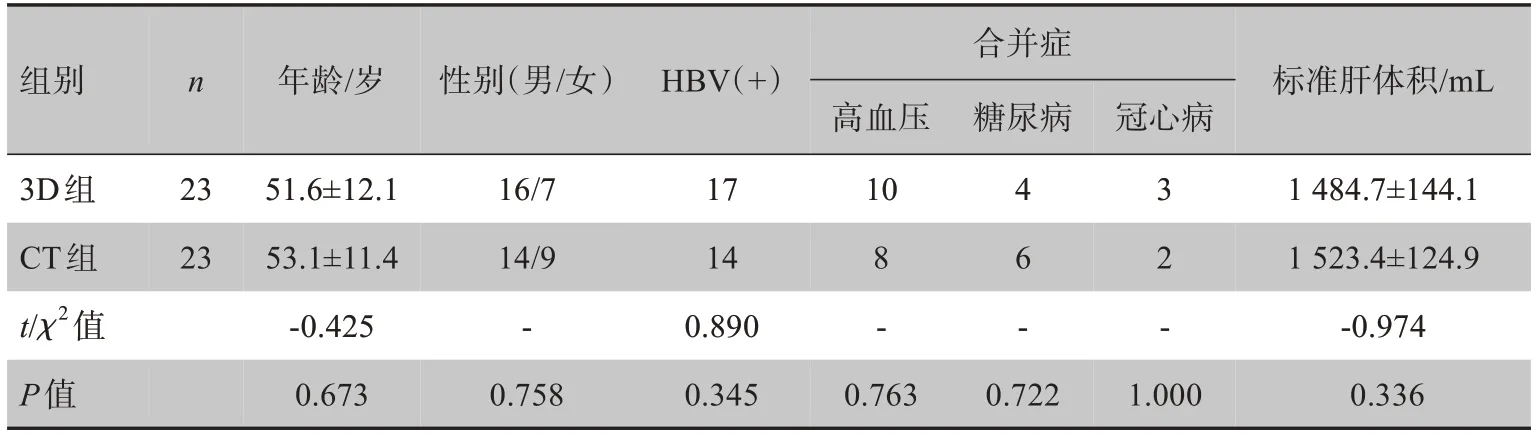
表1 两组患者术前一般资料比较Tab.1 Comparison of preoperative information in two groups
1.2 肝体积的测量方法和体积测量研究方法
所有患者术前、术后5~7 d 内均进行上腹部增强CT 扫描,根据相应组别进行3D 系统软件、CT 系统方法测算相关肝体积。采用以下相关概念:(1)体表面积测定根据参考文献[8]:体表面积(m2)=0.006 1×身高(cm)+0.012 8×体质量(kg)‐0.152 9。(2)标准肝体积(Standard Liver Ⅴolume, SLⅤ)计算方法[9]:SLⅤ=706.2×BSA+2.4;(3)残肝体积=全肝体积(正常肝体积和肿瘤肝体积)‐切除的肝体积;(4)虚拟(术前)残肝体积=全肝体积‐虚拟切除的肝体积;(5)实际(术后)残肝体积=术后实际残肝体积(基于术后CT);(6)标准残肝体积比=残肝体积/标准肝体积。
1.2.1 基于影像科CT 系统的肝体积测量方法采用64 层螺旋CT(GE,美国)测量肝脏体积。通过CT 系统获取平扫期、动脉期、门脉期CT DICOM 数据。手术主刀医生确定手术方案,影像科医生按照该方案进行基于CT 工作站系统计算相关肝体积。将器官(肝脏)原始数据切为多片(40~60 片),采用手工测量、半自动测量方法使用轨迹球人工勾勒出每一层面肝脏边缘,由计算机计算出每层面积,每层面积乘以层厚即为切片体积,将每一层的体积相加即为肝脏体积。
1.2.2 3D 软件测量体积采用3D 软件系统[10]:将获取CT 薄层(0.625~1.000 mm)(图1)数据(DICOM 格式)导入到3D 重建系统软件进行肝脏3D 重建[11],构建肝肿瘤和肝脏血管系统的3D图像模型。根据主刀医生确定手术切除范围,测量全肝体积、虚拟切除肝体积、残肝体积等,3D 系统定量分析手术的可行性,制定具体手术策略。3D 打印:将3D 重建感兴趣的STL 格式文件[12]导入Repetier‐host 1.06 软件按正常大小将肝脏、肿瘤和血管系统切片后保存,链接CoLiDo 3D 打印机使用聚乳酸材料,打印出3D 物理模型。在3D 系统软件及3D 打印模型上进行虚拟手术,分析确定手术方案[13‐14]。
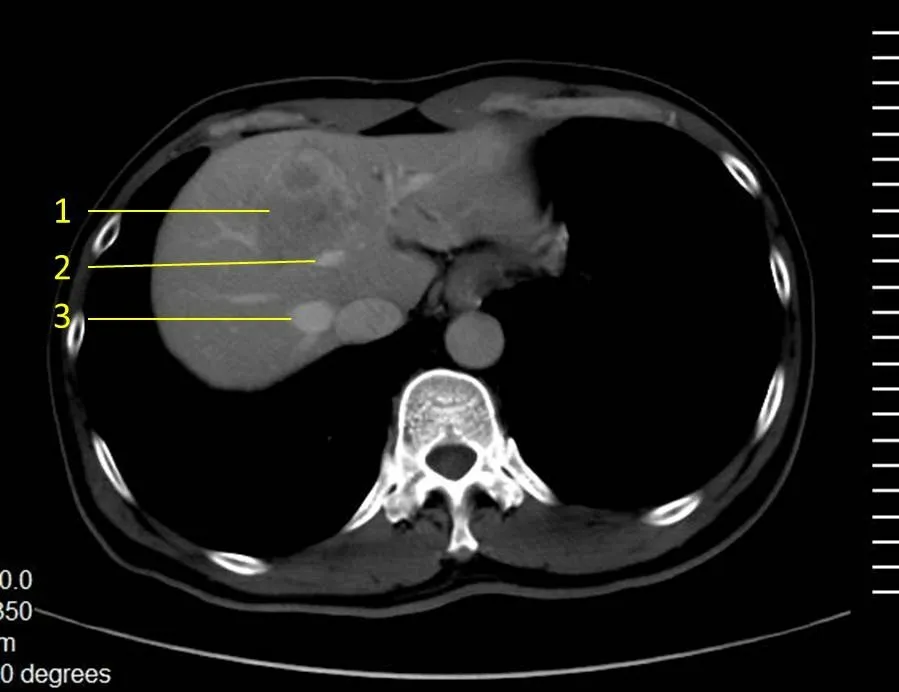
图1 肝癌门脉CT图像Fig.1 Portal venous phase CT image
1.2.3 实际手术规划及方法采用气管插管全麻,右上腹部倒“L”形切口进行开腹手术,同一组医师完成手术,两组术中结合术中超声排除微小病灶转移、明确肝静脉等脉管走行最终确定切除范围。3D组则再结合术中3D 图像、3D 打印物理模型指导实时手术。CT组则结合传统CT影像图片指导手术。
1.2.4 实际切除肝体积的测量采用量杯(排水法)测量体积[11,15]:术中切除的肝脏组织包括肿瘤和肿瘤周围的肝脏组织,采用排水法测量体积,排水法测量肝体积是将离体肝脏标本组织放入含水容器中,将肝脏放入容器后溢出(或升高)的水的体积则为肝脏体积,是目前公认的体积测量的“金标准”。
1.3 观察指标
(1)手术时间、术中出血量、虚拟肝切除体积、实际切除肝体积、残肝体积、标准残肝体积比、术后并发症。(2)肝功能衰竭采用“50‐50”标准[16]。(3)患者满意度:采用自制量表评估,总分100分,即非常满意90~100分,满意80~89分,一般60~79分,不满意<60分。
1.4 统计学分析
采用SPSS19.0软件进行统计学分析,计量资料用均数±标准差表示,分类资料用率(%)表示。两组计量资料比较采用独立t检验,两组分类资料采用卡方检验或Fisher's检验,组间比较采用配对t检验,相关性分析采用Pearson相关检验,P<0.05为差异有统计学意义。
2 结果
2.1 3D重建及3D打印情况分析
3D 组均获得满意的3D 图像模型、3D 打印物理模型。3D 组通过3D 系统软件构建3D 图像模型(图2),观察肝脉管与肝肿瘤空间关系,熟悉肝脏脉管、走行及变异、与肿瘤毗邻关系;3D系统虚拟切除分析肝体积(图3);1:1 比例打印肝脏3D 物理模型(图4),通过分析3D 物理模型,评估肿瘤的可切除性和需要注意的解剖重点,指导实时肝切除术。
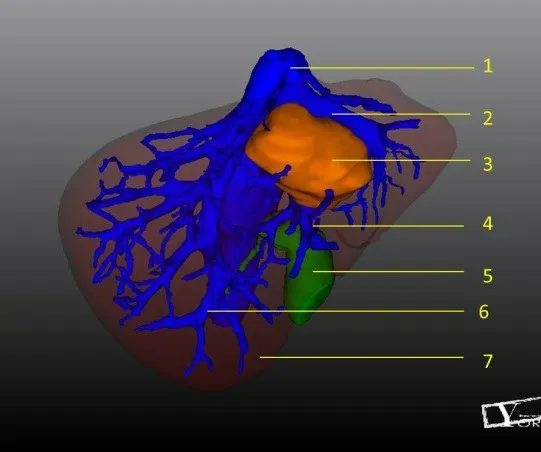
图2 肝脏3D可视化图像Fig.2 Three-dimensional visualization image of the liver

图3 虚拟肝切除Fig.3 Virtual liver resection

图4 3D打印物理模型Fig.4 A physical 3D printed model
2.2 两组相关肝体积测量及分析结果
(1)3D组虚拟切除肝脏体积为(993.2±212.0)mL,实际切除肝脏体积为(980.9±204.1)mL,两者比较差异无统计学意义(P>0.05),相关性分析显示呈正相关性(r=0.990,P<0.001)。CT 组虚拟切除肝体积为(1 070.6±235.8)mL,实际切除肝体积为(1 042.3±218.9)mL,两者比较差异无统计学意义(P>0.05),相关性分析显示呈正相关性(r=0.943,P<0.001)。(2)残肝体积:3D组虚拟(术前)残肝体积为(689.2±82.1)mL,实际(术后)残肝体积为(697.8±88.2)mL,两者比较差异无统计学意义(t=‐1.942,P=0.065),相关性分析显示两者呈正相关性(r=0.972,P<0.001)。CT 组虚拟残肝体积为(624.5±58.5)mL,实际残肝体积为(639.9±59.9)mL,两者比较差异有统计学意义(t=‐2.255,P=0.034),相关性分析显示两者呈正相关性(r=0.902,P<0.001)。(3)标准残肝体积比:3D 组虚拟(术前)标准残肝体积比为(46.8±7.4)%,实际标准残肝体积比为(47.4±7.6)%,两者比较差异无统计学意义(t=‐1.825,P=0.082),相关性分析显示两者呈正相关性(r=0.972,P<0.001)。CT组术前标准残肝体积比为(41.2±4.7)%,实际标准残肝体积比为(42.0±4.5)%,两者比较差异有统计学意义(t=‐2.174,P=0.041),相关性分析显示呈正相关性(r=0.931,P<0.001)。
2.3 两组围手术期结果比较
如表2所示,两组手术时间比较差异无统计学意义(P>0.05);3D 组术中出血量少于CT 组(P<0.05)。3D 组和CT 组输血率分别为26.1%(6/23)和39.1%(9/23),术后并发症发生率分别为21.7%(5/23)和34.8%(8/23),两组比较均无统计学差异(P>0.05)。经穿刺引流或加强非手术治疗治愈,两组患者均无围手术期死亡。3D 组患者满意度优于CT 组(P<0.05)。
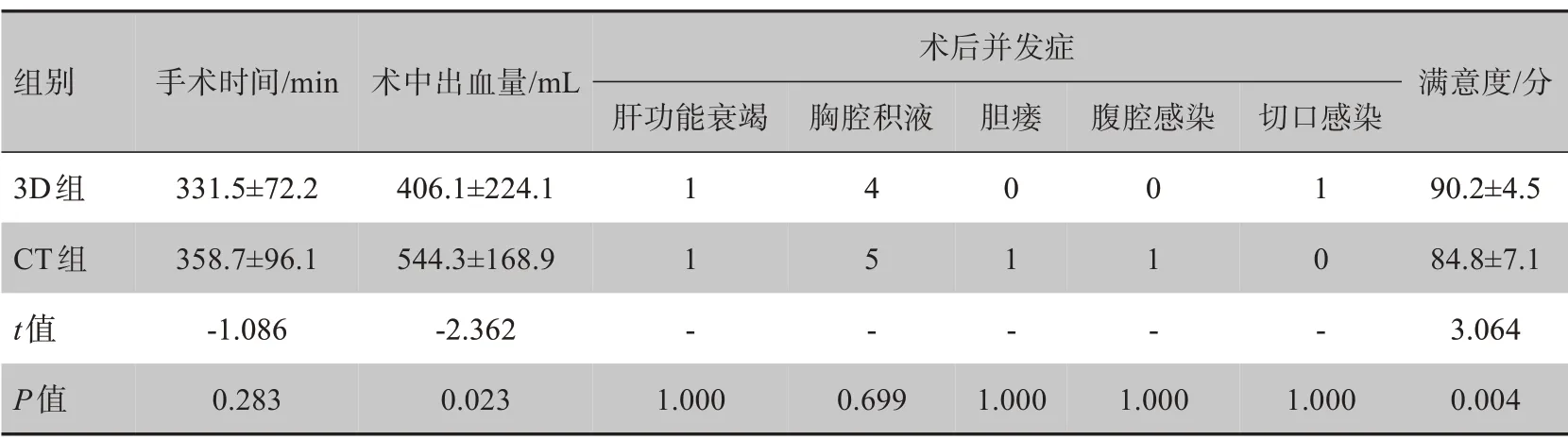
表2 术中和术后结果Tab.2 Intra operative indicators and postoperative outcomes
2.4 案例分析
易某,男,45 岁,因“体检发现肝占位3 d”住院,既往有“乙肝小三阳”20 余年病史。上腹部增强CT(肿瘤位于S4、S8段)和实验室检查等,诊断为:(1)中央型肝癌;(2)慢性乙型肝炎病毒感染。3D可视化和3D打印分析结果为:3D软件计算全肝体积1 086.2 mL,体表面积1.78 m2,标准肝体积1 257.8 mL,进行虚拟肝切除术,拟标准的左、右半肝切除术,则肿瘤残留;拟左三肝切除术,残肝体积471.7 mL,则标准残肝体积比为37.5%,术后有肝功能衰竭风险;拟扩大左半肝切除术,残肝体积673.9 mL,则标准残肝体积比53.5%;拟行中央型肝癌切除(S4+S5+S8段肝切除术),残肝体积649.7 mL,则标准残肝体积比51.6%,手术亦可行。中央型肝切除术,进行2个肝切除断面即手术难度明显增大,结合3D 打印物理模型等综合评估后,决定行扩大左半肝切除术+胆囊切除术,实际切除肝体积为465.0 mL。
3 讨论
3.1 大部分肝切除术中肝体积测量分析的重要性
肝体积的精确评估与肝功能Child Pugh 分级作为肝功能评价指标具有同等意义[17‐18]。残肝体积的评估是目前肝癌切除术前通行并且可行、可靠的办法。进行肝脏切除术时,术前准确评估残肝体积至关重要,高估了残肝体积可能导致术后致命性的肝功能衰竭,而低估了可能错失一个潜在的治愈性肝切除术机会。有研究显示标准残肝体积是评估肝切除术患者肝脏储备功能的有效且简便的方法, 对预测患者术后发生肝功能损害的程度及避免患者术后发生肝功能衰竭有重要的临床指导作用[19]。肝脏体积可客观反映肝脏大小和肝实质的容量,间接反应肝脏的代谢能力,肝脏体积越大,肝脏储备功能就越好,对手术耐受也越强,已被视为与CTP 分级同等重要的肝功能储备指标[20]。肝大部切除手术中,CT 术前测量术后残肝体积,客观且定量分析肝癌可切除性,以避免术后发生肝功能衰竭[21]。在肝切除术及肝移植术前使用CT 测量肝脏体积是目前比较常用的方法[22]。Cai 等[23]分析肝癌患者接受基于3D 软件系统(MI‐3DⅤS)的肝切除术,指出3D 虚拟软件具有使用简单、方便,可以准确评估术后肝脏体积,提高肝切除术的安全性。为消除体表面积对肝脏体积测量的影响,有研究采用CT 实际测量值除以患者的体表面积,计算出每个肝癌患者的单位体表面积CT 肝体积,且该研究表明单位体表面积CT 肝体积测定能准确地预测肝癌肝切除术后患者肝功能衰竭和死亡发生率[24]。近年来3D 重建软件,基于CT 数据进行3D 重建除了能准确提供肝脏残肝体积测量[25‐26],还能提供肝脏脉管结构与肝脏肿瘤的空间关系,对于术前手术规划、术中手术操作都有重要辅助意义[27]。
本研究结果显示无论3D 系统软件还是CT 系统测量的相关肝体积,3D组和CT组的虚拟切除肝和实际切除肝体积,术前(虚拟保留)残肝体积与术后实际残肝体积、术前(虚拟保留)标准残肝体积比和术后实际标准残肝体积比等均提示呈正相关,即无论是基于CT 系统还是3D 系统软件进行测量的标准残肝体积比和各项肝体积值是可行、准确、可靠的,CT测量体积或3D系统测量体积评估肝体积可作为临床大部肝切除术前重要的参考依据之一。与杨世忠等[28]研究结果相似。
本研究纳入的患者,3D组和CT组术前拟切除平均肝脏体积比实际排水法测量得到的肝体积略大,与陆战等[29]研究结果相似,考虑可能与切除下来的肝组织内血液流失致其体积缩小以及可能人为误差有关,虚拟切除线与术中实际切除线不完全一致。标准肝体积是一项科学、可靠、理想的肝功储备评估指标,特别适用于我国肝癌患病情况。医疗单位可根据医院的具体技术条件,选择采用CT 系统自带的CT计算系统或通过3D系统软件进行计算,结合相关公式计算体表面积[8]、标准残肝体积[9],从而计算出标准残肝体积[30]、残肝体积比,用于肝切除术的规划,评估手术的可行性。
3.2 3D 图像模型和3D 打印物理模型在大部分肝切除术中的临床价值
术前精确评估、定量分析,术中完整切除肿瘤,达到安全切缘,保留更多肝实质体积,防止术后发生肝功能衰竭,使病人获得快速康复[31]。本研究结果显示采用3D 技术的研究组,术中出血量少于CT 组,差异有统计学意义;3D组的手术时间、围手术期的输血率、术后并发症发生率均优于CT 组,尽管差异无统计学意义,考虑可能与纳入的样本量较小相关。研究显示3D 图像模型在肝切除术的价值:(1)3D 系统提供直观的肝脏脉管3D 图像模型,有助于熟悉肝脏的解剖和变异,以及进行3D 系统定量分析,3D 系统下进行虚拟肝切除术测算相关肝体积计算安全的肝切除量。目前认为,肝切除术后至少应保留的标准肝体积在40%~50%,如果存在肝硬化、门脉高压症,需要保留更多的标准肝体积。肝切除术后严重并发症的发生率与残肝体积密切相关[32]。通过虚拟肝切除术,准确评估手术风险,降低肝衰竭风险,确保手术的安全性。(2)3D 系统软件的量化分析,有助于预判性地保护保留肝脏流入道(肝动脉、门静脉)和流出道(肝静脉、肝短静脉)的完整性,减少副损伤。(3)3D技术辅助肝切除术让主刀医生团队定量准确分析肝切除术相关指标,肝体积、脉管与肿瘤空间毗邻关系,提高了手术安全性,同时能让患者直观了解手术方案及手术风险,促进医患沟通,减少不必要的医疗纠纷[12]。通过3D 打印技术的术前精准预判、对肝静脉和门静脉的解剖识别,结合3D 打印物理模型的间接导航有助于找到“无血管区”,减少重要脉管的损伤,减少手术中出血量。肝癌患者围手术期的输血率,可能导致免疫抑制,影响患者预后。因此,控制围手术期输血率,有助于改善患者预后。Zein 等[33]应用肝脏3D 打印用于活体肝移植,有助于关键解剖部位的定位,减少手术时间、术后并发症。方驰华等[15]将3D 打印技术应用于肝肿瘤外科诊治中,认为3D 物理模型可实时引导重要脉管的分离和肿瘤病灶的切除,降低手术风险。刘文瑛等[13]研究显示3D打印技术提高了复杂性肝癌精准肝切除的手术精准性和安全性。3D打印物理模型为肝大部分切除术实时手术提供更详细的信息,可减少潜在的手术并发症。3D 可视化图像模型和3D 打印物理模型有助于围手术期与患者的沟通,提高患者满意度。
综上所述,3D系统软件和CT软件在肝癌大部分肝切除术围手术期规划的肝体积评估是可行、准确的,均具有很好的临床应用价值,有助于肝切除术的安全实施。3D 可视化联合3D 物理打印模型在围手术规划可减少手术出血,提高患者满意度,在临床应用中具有潜在优势。
