利用RNAi技术沉默稻纵卷叶螟膜结合型海藻糖酶基因
2020-08-04李尚伟张泽杰
赵 凤,杜 娟,李尚伟*,张泽杰
(1.贵州大学 昆虫研究所/贵州山地农业病虫害重点实验室,贵州 贵阳 550025;2.遵义市第十八中学,贵州 遵义 563000)
【研究意义】海藻糖是一种非还原性双糖,由2个葡萄糖分子经半缩醛羟基结合而成,广泛存在于细菌、真菌、植物和无脊椎动物中[1-3]。在高温、高寒、高渗透压及干燥失水等恶劣环境条件下,海藻糖能在机体细胞表面形成独特的保护膜,可有效保护蛋白质分子不变性失活,从而维持机体的生命过程和生物特征[4-5]。海藻糖在昆虫体内的唯一分解代谢途径是在海藻糖酶(Tre)的作用下被水解为葡萄糖,葡萄糖最终作为细胞进行糖酵解的原料,为昆虫的各种生命活动提供能量[6]。由于海藻糖在昆虫生长发育中的重要性,其又被称为昆虫的“血糖”[7-8]。海藻糖酶是昆虫体内唯一能水解海藻糖的酶类,在海藻糖代谢过程中至关重要,同时海藻糖酶也是几丁质合成通路中的第一个酶,在几丁质代谢过程中发挥关键作用。因此,海藻糖酶已经成为防治害虫的理想靶标。【前人研究进展】海藻糖酶(Tre)是昆虫海藻糖代谢必不可少的一类酶,能专一催化1分子海藻糖水解为2分子葡萄糖。昆虫中的海藻糖酶最先由Frerejacaque在1941年发现,随后研究证实,昆虫体内存在2种类型的海藻糖酶,即可溶型海藻糖酶(Tre1)和膜结合型海藻糖酶(Tre2)。可溶型海藻糖酶主要存在于昆虫消化系统和循环系统中,如血淋巴、中肠和马氏管中,负责内源性海藻糖的分解[9];膜结合型海藻糖酶主要存在于昆虫的肌肉中,其主要功能是水解食物中的海藻糖,从而为肌肉运动和取食阶段中肠的运动提供能量[10]。海藻糖酶是由海藻糖酶基因编码合成,海藻糖酶基因的表达和酶活性直接与虫体正常发育、蜕皮、变态及繁殖等重要生理过程密切相关。1992年第一个可溶型海藻糖酶基因在黄粉虫Tenebriomolitor中首次被克隆[9],但第一个膜结合型海藻糖酶基因(CmTre2)直到2005年才在家蚕Bombyxmori中得以克隆验证[11]。到目前为止,已经有多种昆虫的海藻糖酶基因被克隆,如黑腹果蝇Drosophilamelanogaster、赤拟谷盗Triboliumcastaneum、西方蜜蜂Apismellifera[12]、甜菜夜蛾Spodopteraexigua[13-14]、灰飞虱Laodelphaxstriatellus[15]及飞蝗Locustamigratoria[16]等。【本研究切入点】水稻是世界上重要的粮食作物之一,无论是田间还是储存过程中会受到多种害虫的危害。稻纵卷叶螟Cnaphalocrocismedinalis,俗称卷叶虫、刮青虫、苞叶虫等,属于鳞翅目Lepidoptera螟蛾科Pyralidae,是对水稻危害最严重的主要害虫之一[17-18]。该虫是一种典型的迁飞性害虫,在我国和国外分布均广泛[19]。稻纵卷叶螟主要危害水稻和玉米等禾本科作物,其幼虫缀丝纵卷水稻叶片成虫苞,幼虫匿居虫苞之中取食叶肉,使叶片仅留表皮,形成白色条斑,影响水稻光合作用,造成水稻秕谷增加,导致产量大幅下降[18]。化学防治因其防效好、收效快、使用方便等特点,目前仍是一项防治害虫的主要措施,但大面积使用化学农药,容易造成农药残留且杀伤天敌,导致害虫产生抗药性。迄今为止,一些关于利用RNA干扰(RNA interference,RNAi)技术沉默害虫靶标基因的研究[20-24]为害虫的绿色防控展现出光明的前景。【拟解决的关键问题】运用RNAi技术沉默膜结合型海藻糖酶基因(CmTre2)的表达,定时观察稻纵卷叶螟对水稻的取食情况、虫体表型变化,并检测靶标基因表达水平的变化及海藻糖酶活性变化,以期为进一步明确该基因在稻纵卷叶螟生长发育过程中的重要作用,以及利用RNAi防治该害虫提供理论基础。
1 材料与方法
1.1 材料
供试昆虫:稻纵卷叶螟由贵州山地农业病虫害重点实验室饲养[25],在人工气候箱内用稻苗饲养,饲养条件为温度(26±1) ℃,相对湿度70 %~80 %,光周期14L:10D。
主要试剂与仪器:HP Total RNA Kit购自美国Omega Bio-Tek公司;TranscriptAid T7 High Yield Transcription Kit和GeneJET RNA Purification Kit购自美国Thermo Fisher公司;大肠杆菌EscherichiacoliJM109感受态细胞、DL2000 DNA marker、PrimeScript RT-PCR Kit及LATaqDNA聚合酶均购于大连TaKaRa公司;pGEM-T Easy载体购于美国Promega公司;iTaq Universal SYBR Green Supermix、Gel Extraction Kit和C1000 Thermal Cycler购自美国Bio-Rad公司;质粒提取试剂盒购自康为世纪生物科技有限公司;海藻糖酶活力测定试剂盒购自苏州科铭生物技术有限公司;显微注射器、PCR耗材、离心管及其他常规试剂和耗材均购于生工生物工程(上海)股份有限公司;引物合成及PCR产物测序均由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 靶位点的设计 根据CmTre2的开放阅读框(ORF),通过3个在线RNAi寡核苷酸靶位点设计工具(http://siDirect2.RNAi.jp;http://biotools.idtdna.com/Scitools/Applications/RNAi/RNAi.aspx;http://optirna.unl.edu),寻找具有较多Dicer酶切位点且无脱靶效应的靶标序列。用同样方法在维多利亚多管发光水母Aequoreavictoria的绿色荧光蛋白(GFP)基因(GenBank:CAA58789)中设计1个靶标位点,作为对照。
1.2.2 引物设计 利用Primer Premier 6.0针对上述靶序列设计PCR引物和合成dsRNA所需引物,在合成dsRNA所需每条引物的5′端加上一段20 bp的T7启动子序列,目的是使体外转录的RNA分子能形成dsRNA。另外,根据CmTre2、稻纵卷叶螟几丁质合成酶A基因(CmCHSA)和几丁质合成酶B基因(CmCHSB)的ORF设计实时荧光定量PCR(RT-qPCR)引物,以稻纵卷叶螟看家基因CmActin(GenBank登录号:JN029806)为内参对照,检测CmTre2、CmCHSA和CmCHSB的mRNA表达水平。引物信息见表1。

表1 稻纵卷叶螟膜结合型海藻糖酶基因的dsRNA合成引物和RT-qPCR引物
1.2.3 dsRNA的合成与注射 用表1中的引物对靶标序列进行PCR扩增,扩增产物经1 %琼脂糖凝胶电泳检测后用胶回收试剂盒纯化,回收产物进行TA克隆。然后用带T7启动子的引物按照TranscriptAid T7 High Yield Transcription Kit(Thermo Fisher,USA)说明书分别合成CmTre2的dsRNA(dsCmTre2)和GFP的dsRNA(dsGFP)。体外转录体系:5×TranscriptAid eaction buffer 4 μl,ATP/CTP/GTP/UTP各2 μl,DNA模板(两端带T7启动子)4 μl,TranscriptAid enzyme mix 2 μl,加Nuclease-free ddH2O补足至20 μl。在PCR仪中37 ℃反应5 h后,分别加入2 μl DNase I和RNase A,孵育15 min去除冗余的DNA及单链RNA,再分别加入2 μl EDTA终止反应。合成的dsRNA用GeneJET RNA Purification Kit(Thermo Fisher,USA)纯化,使其浓度大于3 μg/μl。
将体外合成的dsCmTre2和dsGFP注射到稻纵卷叶螟幼虫体内后,观察生长发育的变化。选取大小一致、生长健康和发育良好的稻纵卷叶螟3龄幼虫,沿着血液流动方向,分别在其腹部的8~10腹节间注射dsCmTre2,每头虫注射0.5 μl。以注射相同量dsGFP的稻纵卷叶螟作对照。每组设置3个重复,每个重复注射20头虫。分别将注射dsRNA和没注射的幼虫放在新鲜水稻叶片上,置于人工气候箱中培养,每隔24 h观察取食、表型及死亡情况。
1.2.4 沉默CmTre2及其对几丁质合成酶基因的影响 注射dsRNA后5 d,分别收集实验组和对照组存活的幼虫,提取总RNA,用PrimeScript RT-PCR Kit(TaKaRa,China)反转录合成第一链cDNA。在C1000 PCR仪(Bio-Rad,USA)上进行RT-qPCR,分别检测CmTre2、CmCHSA和CmCHSB的表达水平。用稻纵卷叶螟看家基因CmActin作为内参对照。RT-qPCR采用2步法程序:95 ℃预变性1 min;第1步95 ℃变性10 s,第2步60 ℃退火和延伸20 s,共进行40个循环。反应后进行溶解曲线分析,以排除非特异性PCR产物的污染。每个样本设3次重复。
1.2.5 海藻糖酶活性测定 称取0.1 g经dsRNA干扰后存活的稻纵卷叶螟,加入1 mL冷磷酸缓冲液,在冰上匀浆,4 ℃离心10 min,取上清液,用海藻糖酶活力试剂盒(苏州科铭生物)进行海藻糖酶活力测定。以每克样品每分钟催化产生1 nmol葡萄糖作为一个酶活力单位。
1.3 数据统计与分析
采用2-ΔΔCt法分析CmTre2、CmCHSA和CmCHSB基因mRNA在实验组和对照组的相对表达量。统计数据以平均值±标准差表示,采用SPSS 22.0中方差分析(ANOVA)的Duncan氏新复极差法检验。
2 结果与分析
2.1 靶基因CmTre2的沉默效应
RT-PCR结果显示,稻纵卷叶螟在注射dsRNA后5 d,注射dsCmTre2的实验组CmTre2mRNA相对表达量为0.463,注射dsGFP的对照组(CK)CmTre2mRNA相对表达量为1(图1)。与对照组相比,实验组CmTre2的表达水平较下降53.70 %,二者间差异达极显著水平,表明dsCmTre2能有效降低CmTre2的表达。
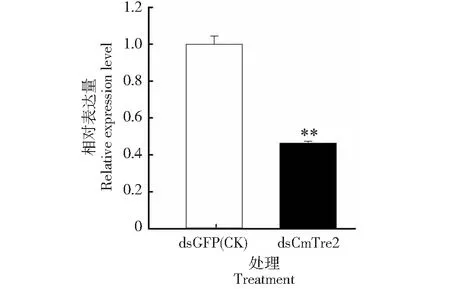
* 和**分别表示差异达显著(P<0.05)和极显著(P<0.01)水平,下同
2.2 沉默CmTre2后稻纵卷叶螟的生长发育
注射dsRNA后5 d,注射dsCmTre2的实验组幼虫体型变小,蜕皮受阻,并出现畸形和死亡现象;注射dsGFP的对照组(CK)虫体表型无明显变化,生长发育情况良好(图2)。注射dsRNA后5 d,注射dsCmTre2存活幼虫的平均体重为22 mg,对照组的平均体重为24.87 mg,注射dsCmTre2的幼虫体重显著小于对照组(图3)。表明,干扰膜结合型海藻糖酶基因的表达会导致稻纵卷叶螟不能正常生长发育。

图3 注射dsRNA后5 d存活稻纵卷叶螟幼虫的体重

图2 沉默CmTre2基因5 d后稻纵卷叶螟幼虫的表型变化
从图4可以看出,注射dsRNA第2天时,注射dsCmTre2幼虫的死亡率为13.33 %,CK仅有1.667 %,两者间的差异达显著水平;第3天,注射dsCmTre2幼虫的死亡率为25.00 %,CK仅有1.667 %,两者间的差异达极显著水平;注射dsRNA 5 d后,注射dsCmTre2幼虫的死亡率(51.67 %)是CK死亡率(3.33 %)的15.52倍。表明,沉默CmTre2能对稻纵卷叶螟引起显著的致死效应。
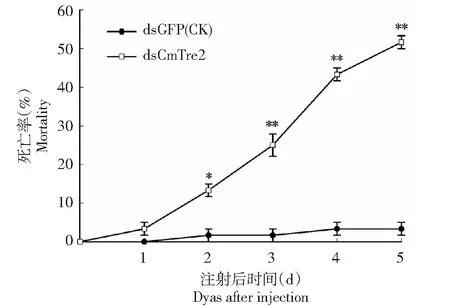
图4 注射dsRNA后稻纵卷叶螟幼虫的死亡率
2.3 沉默CmTre2后几丁质合成酶基因基因的表达
从图5可以看出,注射dsCmTre2 5 d后,幼虫CmCHSA的mRNA相对表达量为0.858,与CK(dsGFP)相比下降不明显;CmCHSB的mRNA相对表达量为0.6559,与CK相比下降34.41 %,达显著水平。表明,注射dsCmTre2不仅对CmTre2具有明显的沉默效应,对下游基因的表达也有不同程度的影响。
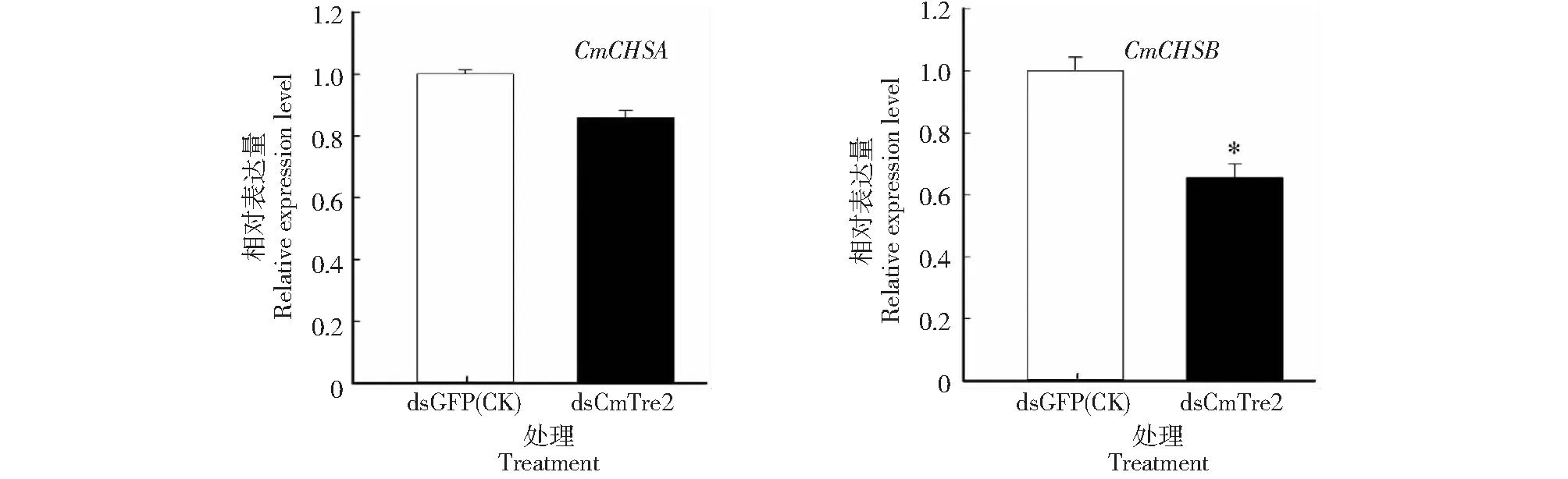
图5 注射dsRNA 5 d后几丁质合成酶基因的mRNA相对表达量
2.4 RNA干扰海藻糖酶的活性
从图6看出,注射dsCmTre2后5 d,稻纵卷叶螟幼虫体内海藻糖酶活性为2364.5413 U,为对照组的64.36 %,与对照组相比具有显著差异。表明,dsCmTre2对稻纵卷叶螟幼虫体内海藻糖酶活力具有明显的抑制作用。
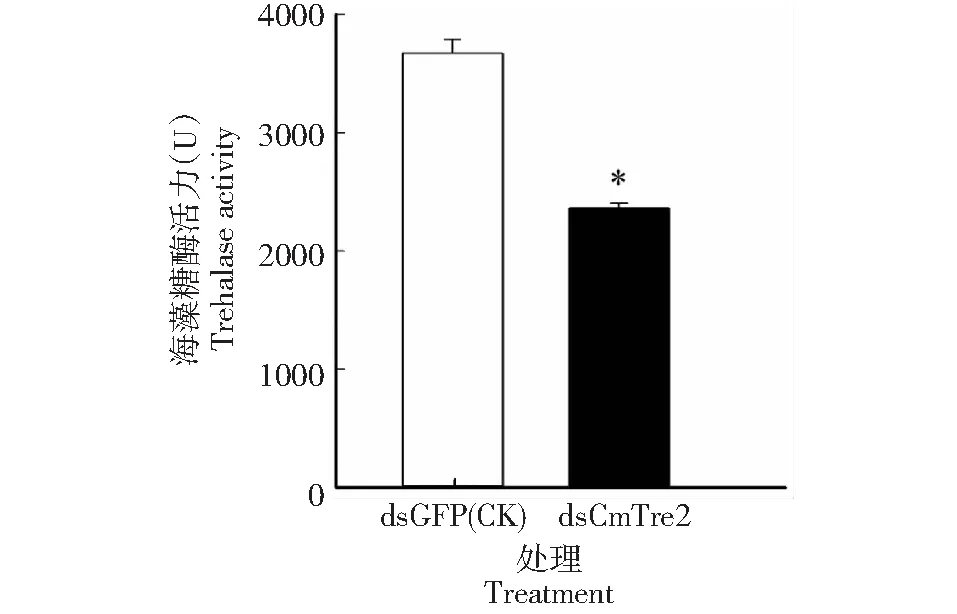
图6 注射 dsRNA 5 d 后稻纵卷叶螟幼虫的海藻糖酶活力
3 讨 论
RNAi是指在进化过程中高度保守的、由dsRNA诱发的、同源mRNA高效特异性降解的现象。目前,可以通过饲喂、注射和转基因等多种方法将体外合成的siRNA或dsRNA导入昆虫体内,其中,注射法是干扰效果最明显的方法[26]。RNAi具有高效性和特异性,被广泛应用于昆虫领域的研究[27-30]。Chen等[14]的研究结果显示,注射膜结合型海藻糖酶基因的dsRNA后,甜菜夜蛾S.exigua出现明显的畸形个体,或进入下一期的幼虫明显小于正常个体,死亡率明显高于对照组。该研究采用注射法成功将dsCmTre2注射入稻纵卷叶螟3龄幼虫的腹部,结果显示幼虫生长发育受抑制,虫体变小,体重减轻,死亡率大幅增加,膜结合型海藻糖酶基因表达水平显著下调;而注射dsGFP的对照组,CmTre2的表达水平及幼虫的生长发育和体重等均未受影响。该研究结果与Chen等[14-15]分别干扰甜菜夜蛾S.exigua和灰飞虱L.striatellus中的膜结合型海藻糖酶基因时显示的结果相一致。
海藻糖是昆虫的血糖,昆虫的各个组织器官利用海藻糖时必须先利用海藻糖酶将海藻糖降解为葡萄糖。在昆虫蜕皮及合成几丁质等各种生命活动中,都需要大量的海藻糖作为能源物质为其提供能量。海藻糖酶活力的高低不仅影响海藻糖的降解,还与昆虫血淋巴中糖类物质的运输效率密切相关,当昆虫体内海藻糖酶活力降低时,海藻糖去向减少,海藻糖含量升高,葡糖糖含量降低,血淋巴运送糖类物质的效率降低,这不仅会影响昆虫生长发育,还会影响几丁质的合成而产生致死效应[16,31]。在昆虫体内,海藻糖酶活性受多种激素的调节[32-34]。蜕皮激素可以提高海藻糖酶活力并加快海藻糖酶基因的表达[35-36]。滞育激素能提高家蚕B.mori卵巢海藻糖酶活性[37]。此外,当海藻糖酶基因的表达被干扰后,海藻糖酶活力也会降低。Zhao等[38]利用RNAi技术沉默褐飞虱Nilaparvatalugens海藻糖酶基因的表达,结果显示注射dsRNA后海藻糖酶活力明显降低,海藻糖酶含量增加,褐飞虱的生长受抑制。对稻纵卷叶螟幼虫体内注射dsCmTre2后,CmTre2基因表达量降低,海藻糖酶活性降低,造成昆虫发育受阻,体重降低。该研究结果与Zhao等[15,38]的研究结果相吻合。
海藻糖酶是昆虫海藻糖代中的一个关键酶,亦是几丁质合成通路上的第一个酶,能催化海藻糖水解成葡糖糖作为能源物质和合成几丁质的原料,几丁质的合成和降解对昆虫的生长发育至关重要。近年来,甜菜夜蛾S.exigua、褐飞虱N.lugens和赤拟谷盗T.castaneum等多种昆虫海藻糖酶-几丁质调控通路的研究结果均表明,海藻糖酶基因的表达对几丁质的合成与降解存在一定的调控作用。当海藻糖酶基因的表达被抑制后,海藻糖酶活力降低,海藻糖含量增加,葡萄糖含量减少,影响几丁质合成通路下游基因表达,几丁质代谢紊乱,导致昆虫生长发育受阻[38-39]。昆虫拥有可溶型和膜结合型2种类型的海藻糖酶,功能上存在差异,Tre1和Tre2分别调控昆虫不同部位几丁质的合成。Tre1主要在血淋巴、中肠和马氏管中高表达,负责内源性海藻糖的分解;Tre2主要在脂肪体、中肠和马氏管中高表达,负责外源性海藻糖酶的分解[40-41]。在甜菜夜蛾S.exigua的研究中,当SeTre1基因被干扰后,对几丁质合成酶A基因(CHSA)的影响较大,对几丁质合成酶B基因(CHSB)的影响很小;而SeTre2基因被干扰后,对SeCHSA基因的影响较小,对SeCHSB基因的影响较大[14]。该研究中,当CmTre2被干扰后,下游CmCHSB基因的mRNA表达量被显著抑制,但对CmCHSA基因的表达影响较小,这可能与CHSA有可变剪切现象相关。Yang等[42]的研究结果表明,CHS1(CHSA)有2个可变转录本(CHS1a和CHS1b),且CHS1a主要在表皮中表达,CHS1b主要在气管中表达。在敲低CmTre2后,未检测到CHSA表达量显著降低,可能检测的是CHS1a的mRNA表达量,下一步将针对此现象进行更深入的研究。Zhao等[38]将NlTre的dsRNA注射到褐飞虱N.lugens体内,结果表明,在48和72 h后几丁质合成酶基因的表达量明显下降。类似的研究结果在飞蝗L.migratoria等昆虫中也有发现[39]。此外,张露等[43]在研究褐飞虱N.lugens海藻糖酶基因调控几丁质代谢的过程中发现,上游海藻糖酶基因被干扰后,对下游部分几丁质酶基因的表达也有明显抑制作用,几丁质含量下降,褐飞虱出现蜕皮困难等现象。上述研究结果表明,海藻糖酶对昆虫几丁质合成和降解都有一定的影响,导致昆虫体重减轻,生长受阻,甚至出现大幅死亡现象。
近年来,随着昆虫RNAi机制的阐明,科学家们在成功鉴定多种昆虫基因功能的同时,将该技术用于农业害虫防治的研究也取得了突破性的进展[44-45]。几丁质是昆虫外骨骼、中肠和气管等器官的重要组分,对昆虫的生长发育至关重要。因此,明确几丁质合成相关基因在害虫生长发育过程中的重要作用,将为深入发掘昆虫致死基因作为RNAi的靶标提供理论依据。Arakane等[46]在赤拟谷盗T.castaneum的蛹和幼虫血腔内注射几丁质合成酶基因TcCHS1和TcCHS2的dsRNA,发现在幼虫-幼虫、幼虫(蛹和蛹(成虫3个阶段,均可导致试虫因蜕皮困难,无法摆脱旧表皮而致死。通过显微注射的方法分别沉默G6PI和UAP基因,可分别致使桔小实蝇Bactroceradorsalis出现蜕皮困难的致死表型[47]。该研究通过RNAi干扰技术沉默CmTre2后,稻纵卷叶螟幼虫生长发育受阻,体重减轻,出现畸形,最终因几丁质的合成受阻导致死亡,这与几丁质合成通路上的UDP-N-乙酰氨基葡糖焦磷酸化酶基因、几丁质合成酶基因的干扰现象[47-48]相似。
4 结 论
通过注射dsRNA到稻纵卷叶螟幼虫体内,成功抑制了CmTre2的表达,海藻糖酶活力降低,几丁质合成受阻,导致稻纵卷叶螟生长发育受阻,体重减轻,出现畸形表型,最终导致死亡。该研究为进一步利用RNAi技术在田间防治稻纵卷叶螟奠定基础,为该害虫的绿色防控开辟新的领域。
